基于16S rDNA分析大承气汤对过敏性哮喘小鼠肠道菌群的影响
王永安,李亚兰,吴佳佳,葛东宇,彭桂英
基于16S rDNA分析大承气汤对过敏性哮喘小鼠肠道菌群的影响
王永安1,李亚兰1,吴佳佳1,葛东宇2,彭桂英1
1.北京中医药大学生命科学学院,北京 100029;2.北京中医药大学中医学院,北京 100029
通过16S rDNA测序探讨大承气汤对过敏性哮喘小鼠肠道菌群的影响。SPF级C57BL/6 雌性小鼠,随机分为对照组、模型组、大承气汤组和地塞米松组。采用卵清蛋白-氢氧化铝法制备过敏性哮喘小鼠模型,成模后进行肺组织病理切片PAS染色,取粪便提取DNA进行高通量16S rDNA测序分析及菌群选择性培养、菌落计数。与对照组比较,模型组小鼠肺指数明显升高(<0.001),肺泡结构消失,支气管及血管周围大量炎性细胞浸润,气管内大量黏蛋白分泌;与模型组比较,大承气汤组小鼠肺指数明显下降,肺泡结构较清晰,炎性细胞浸润明显减少,气管内黏蛋白分泌量明显减少。肠道菌群物种组成分析显示,模型组小鼠乳杆菌属和螺杆菌属含量下降,大承气汤组含量增加;模型组小鼠拟普雷沃菌属含量增加,大承气汤组含量下降。模型组小鼠肠道菌群结构与对照组明显不同,大承气汤组菌群结构恢复;肠道菌群选择性培养结果显示,模型组小鼠肠道大肠杆菌及肠球菌数量显著增加(<0.001,<0.01),大承气汤组显著减少(<0.01,<0.05);模型组小鼠肠道乳酸杆菌数量显著减少(<0.01),大承气汤组明显增加(<0.01)。大承气汤可降低哮喘小鼠肠道大肠杆菌和肠球菌含量、提高乳酸杆菌含量,恢复肠道菌群结构。
过敏性哮喘;大承气汤;肠道菌群;16S rDNA测序;小鼠
过敏性哮喘是由气道上皮细胞、中性粒细胞、T淋巴细胞等多种细胞和细胞组分参与的,以气道慢性炎症为特征的异质性疾病,临床表现为喘息、气促、胸闷及咳嗽等多变的呼吸道症状伴可逆的呼气气流受限,属中医学“哮证”“喘证”范畴。西医治疗以糖皮质激素为主,但不良反应较多,如口腔念珠菌病、声音嘶哑、咽炎等[1]。近年来许多哮喘与肠道菌群相关研究显示,肠道与呼吸道在生理与病理上关系密切[2-3]。研究表明,成年人中过敏性哮喘患者粪便菌群整体组成与健康个体不同[4]。中医治疗过敏性哮喘具有独特优势。大承气汤出自《伤寒杂病论》,是从肠治肺的代表方。我们前期研究发现,大承气汤可改善哮喘小鼠肺组织炎症,抑制MAPK信号通路激活[5-6],但其机制是否与作用于肠道菌群、改变菌群群落组成有关,迄今尚未明确。因此,本研究从分析肠道菌群出发,进一步探讨大承气汤对哮喘小鼠疗效的可能机制。
1 材料与方法
1.1 动物
雌性C57BL/6小鼠24只,SPF级,6~8周,体质量18 g以上,北京维通利华实验动物技术有限公司,动物许可证号SCXK(京)2016-0002。饲养于温度20~26 ℃、相对湿度40%~70%环境,最大温差不超过4 ℃,噪音小于60 db,每小时保持通风换气数次,光照12 h/12 h明暗交替。
1.2 药物及制备
大承气汤(大黄12 g,枳实12 g,厚朴24 g,芒硝9 g,此为临床成人药量),饮片购自北京同仁堂总店,由北京中医药大学中药学院王秀丽副教授鉴定为正品。药物浸泡30 min,先武火煎煮10 min,再文火煎煮20 min,煎煮2次,合并煎液,水煎浓缩至含原药材1.9 g/mL,将所得药液用双层纱布过滤,置于4 ℃冰箱贮存备用。小鼠给药量按体表面积换算,给予临床等效剂量。地塞米松片,天津力生制药股份有限公司,批号1705016;将地塞米松片研成粉末溶于生理盐水,每日药量为5 mg/kg。
1.3 主要试剂与仪器
卵清蛋白(OVA,美国Sigma-Aldrich公司,货号41235),10×PBS(美国Invitrogen公司,货号1627690),氢氧化铝凝胶(40 mg/mL,50 mL,德国Thermo公司,货号77161)。PAS染色试剂盒(美国Solarbio公司,货号G1340)。TPY培养基、MRSA培养基(北京陆桥技术有限责任公司),KV培养基(北京奥博星生物技术有限责任公司),EMB培养基(北京奥博星生物技术有限责任公司),BEA培养基(北京陆桥技术有限责任公司)。医用雾化器(PARI Turbo BOY N),天平(ACS-3C型,广州中山市新和基科技开发有限公司),电热恒温鼓风干燥箱(DCG-9140B型,上海森信实验仪器有限公司),光学显微镜(日本Olympus公司),5415型高速离心机(德国Eppendorf公司),2.5 L三菱MGC圆底立式培养袋、三菱MGC厌氧产气袋、37 ℃普通培养箱、Ⅱ级生物安全柜(日本三菱公司),HM325型石蜡切片机(德国Microm公司)。
1.4 分组、造模及给药
动物适应性饲养1周,按随机数字表法将小鼠分为对照组、模型组、大承气汤组和地塞米松组,每组6只。采用OVA诱导制备过敏性哮喘小鼠模型[7]。全程分为2个阶段。①2次致敏:分别于第0、14日,模型组和给药组每只小鼠腹腔注射0.2 mL抗原液(每0.2 mL含2 mg 氢氧化铝、20 μg OVA),对照组小鼠给予等量生理盐水处理。②雾化激发:自造模第21日开始,将小鼠置于雾化箱中,模型组和给药组小鼠雾化吸入1%OVA激发,对照组小鼠给予生理盐水雾化,1次/d,30 min/次,连续7 d。从第21日起,雾化前1 h,大承气汤和地塞米松组分别给予大承气汤和地塞米松灌胃,每只0.2 mL,对照组和模型组给予等量生理盐水灌胃。
1.5 检测指标
1.5.1 肺指数
称重后脱颈处死小鼠,打开胸腔取出肺脏,摘除气管、肺门淋巴结等组织,吸干肺脏表面血液,称取肺脏质量。计算肺指数。肺指数(%)=肺质量÷体质量×100%。
1.5.2 肺组织形态
取肺组织,10%甲醛固定24 h,梯度乙醇脱水,二甲苯透明,石蜡包埋,组织切片(厚约5 μm,每个标本连续切3张),PAS染色,中性树胶封片后,镜下观察肺组织形态。
1.5.3 肠道菌群16S rDNA测序分析
收集对照组、模型组、大承气汤组小鼠粪便样本,-80 ℃冰箱保存。样品16S rDNA检测由北京奥维森基因科技有限公司完成,选取细菌16S rDNA的V3~V4区进行基因扩增与测序。引物序列:338F,5’-ACTCCTACGGGAGGCAGCAG-3’;806R,5’-GGA CTACHVGGGTWTCTAAT-3’。扩增反应体系:FastPfu Buffer(5×)4 μL、dNTPs(2.5 mmol/L)2 μL、Forward Primer与Reverse Primer各0.8 μL、DNA模板10 ng、FastPfu Polymerase 0.4 μL、BSA 0.2 μL,最后加ddH2O至20 μL。扩增反应条件:95 ℃,3 min;(95 ℃,30 s;55 ℃,30 s;72 ℃,45 s)×30;72 ℃,10 min。每个样本5个重复,将同一样本PCR产物混合,2%琼脂糖凝胶电泳检测,Tris-HCl洗脱,2%琼脂糖电泳检测。参照电泳初步定量结果,将PCR产物用QuantiFluorTM-ST定量系统进行检测定量,之后按照每个样本测序量要求,进行相应比例的混合。构建Illumina平台文库,进行Illumina测序。按指定测序区域,合成带有barcode的特异引物。分析前先对原始数据进行过滤处理,再进行序列拼接,得到优化序列。再去除嵌合体序列后进行OTU聚类分析,对OTU代表序列作分类学分析。基于OTU聚类分析结果,对OTU进行多种多样性指数分析及测序深度检测;基于分类学信息,在各分类水平上进行群落结构统计分析。在上述分析基础上,进行群落结构和系统发育的统计学和可视化分析。
1.5.4 平板菌落计数
利用选择鉴别培养基,采用平板活菌计数法对肠道主要固有菌群进行定性、定量分析。根据培养基说明书配制培养基,高压灭菌后倒入无菌培养皿中,冷却后放置4 ℃留用。取0.1 g近结肠端粪便,加入1 mL无菌生理盐水,混合均匀,按10-1、10-2、10-3……10-9进行样本稀释,将样本稀释液分别滴在培养基上,再用涂布棒涂布均匀,每个稀释度接种3块培养基,计数时取菌落平均数。EMB、BEA培养基置37 ℃孵育24 h,TPY、MRSA、KV培养基放入培养袋,将厌氧产气袋投入培养袋,封闭,37 ℃孵育48 h。观察菌落特征,计算活菌数,革兰氏染色初步鉴定目的菌群。
1.6 统计学方法
2 结果
2.1 大承气汤对哮喘小鼠肺指数的影响
与对照组比较,模型组小鼠肺指数明显增加,差异有统计学意义(<0.001);与模型组比较,大承气汤组和地塞米松组小鼠肺指数均明显下降,差异有统计学意义(<0.05,<0.01)。结果见表1。

表1 各组小鼠肺指数比较(±s,%)
注:与对照组比较,***<0.001;与模型组比较,#<0.05,##<0.01
2.2 PAS染色结果
对照组小鼠肺泡壁结构完整,肺泡隔厚度正常,黏膜下及气管周围未见炎性细胞浸润;模型组小鼠肺泡结构不清晰,支气管及血管周围大量炎细胞浸润,管腔内有大量分泌物,可见黏液栓,支气管壁略显增厚;大承气汤组和地塞米松组小鼠肺泡结构较清晰,炎性细胞浸润明显减少,气管内黏液分泌量明显下降。见图1。

注:红色箭头所指为气道中分泌黏蛋白
2.3 16S rDNA测序结果
造模后收集小鼠粪便,每组随机选择5只小鼠,提取总DNA进行16S rDNA测序分析。得到各样本平均reads数目为39 167个,OTUs数目为531个。3组共有OTUs数为373个,对照组、模型组和大承气汤组独有OTUs数分别为20、11、42个;对照组与模型组共有OTUs数为24个,对照组与大承气汤组共有OTUs数为33个,模型组与大承气汤组共有OTUs数为28个。结果见图2。
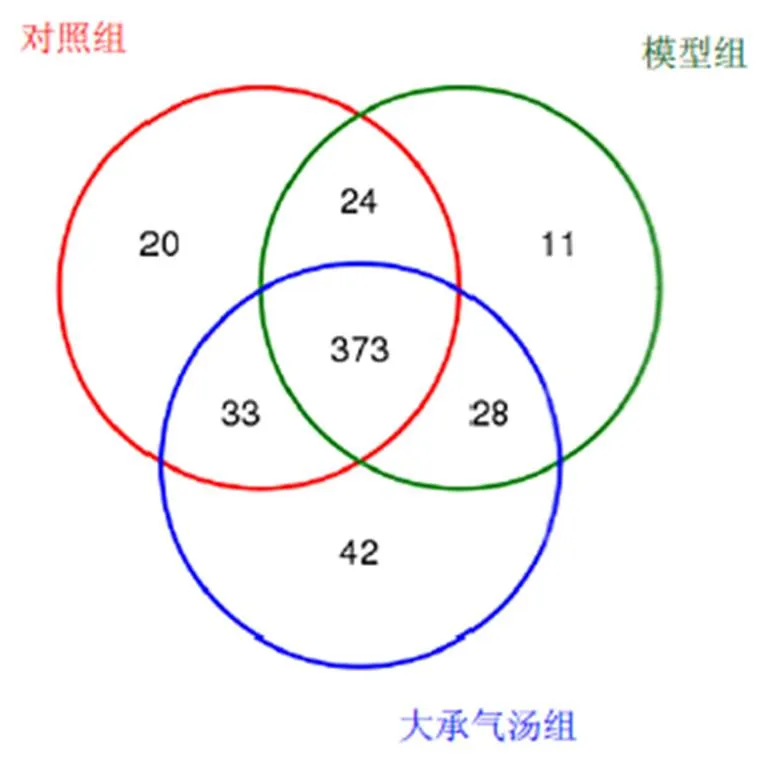
图2 各组OTU分布韦恩图
Chao1指数即菌种丰富度指数,用以估计群落中OTU数目。Shannon指数是用来估算样品中微生物多样性指数之一。与对照组比较,模型组小鼠肠道菌群Chao1指数和Shannon指数均升高,经大承气汤治疗后下降。见图3。

图3 各组小鼠肠道菌群alpha多样性分析
根据分类学分析结果,可得知一个或多个样本在各分类水平上的分类学比对情况。在属水平上,与对照组比较,模型组小鼠乳杆菌属和螺杆菌属含量下降,大承气汤组含量均增加;模型组小鼠拟普雷沃菌属含量增加,大承气汤组含量下降。见图4。
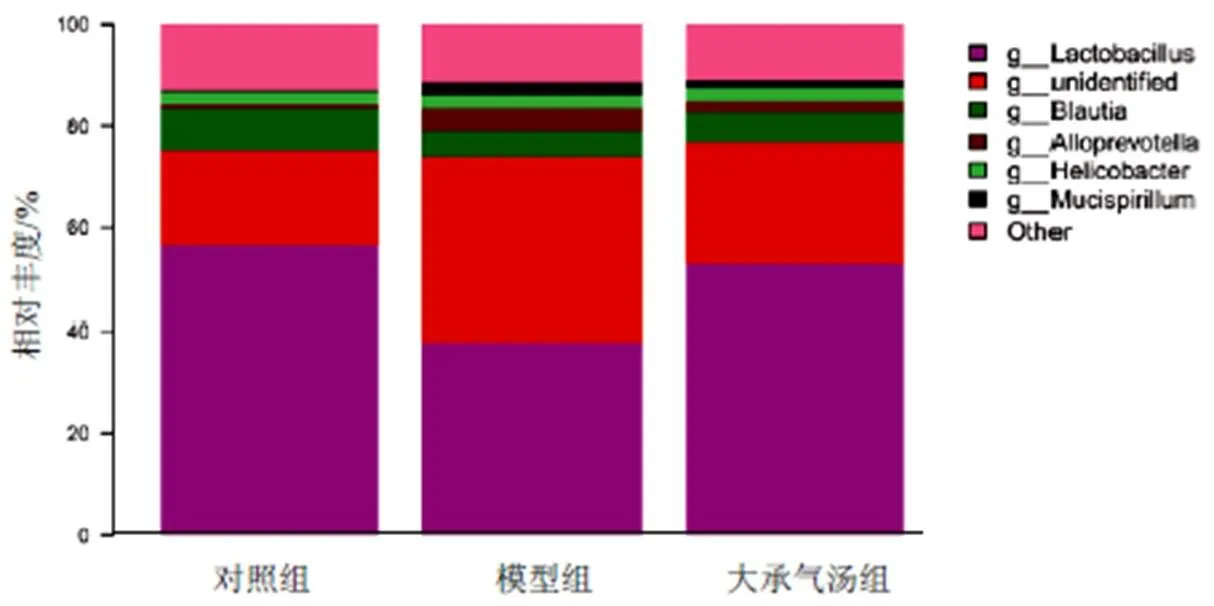
图4 各组小鼠肠道菌群属水平物种组成分析
主成分分析(PCA)是一种对数据进行简化分析的技术,通过分析不同样本OTU(97%相似性)组成可反映样本间的差异和距离,样本组成越相似,反映在PCA图中的距离越近。图5中每个点代表一个样品,点与点之间距离代表样品间物种组成的相似度,图中对照组与模型组菌群结构差异明显,而大承气汤组菌落结构向对照组靠近。

图5 各组小鼠肠道菌群PCA分析
2.4 大承气汤对哮喘小鼠肠道5种固有菌群数量的影响
与对照组比较,模型组小鼠肠道大肠杆菌及肠球菌数量显著增加(<0.001),乳酸杆菌数量显著减少(<0.01);与模型组比较,大承气汤组小鼠肠道大肠杆菌及肠球菌数量显著减少(<0.01,<0.05),乳酸杆菌数量显著增加(<0.01)。这与测序结果基本一致。各组双歧杆菌、拟杆菌数量比较差异无统计学意义(>0.05)。见表2。
表2 各组小鼠肠道固有菌群菌落数比较(±s,lgCFU/g)
注:与对照组比较,**<0.01,***<0.001;与模型组比较,#<0.05,##<0.01
3 讨论
“肺与大肠相表里”是中医经典理论,具有丰富的内涵。研究表明,肺部与肠道除在胚胎发育及生理功能上有相近之处外,许多肺肠疾病的发生发展存在一定的联系[8]。大承气汤为攻下通腑之方,能促进肠道蠕动,使胃肠气机得以通降,腑气通畅,则肺气得以宣发。本研究以OVA诱导的过敏性哮喘小鼠为动物模型,观察大承气汤对模型小鼠肠道菌群的影响。前期研究发现,大承气汤能改善OVA诱导的哮喘小鼠肺部炎症病理,降低血清IgE水平[6,9]。本研究发现,大承气汤治疗后哮喘小鼠肺指数下降,肺组织PAS染色显示,大承气汤对过敏性哮喘小鼠肺部炎症及气管黏蛋白过量分泌有明显的改善作用,与上述研究结果一致。
肺部疾病在一定程度上可影响肠道病理生理状态。Hijazi等[10]研究表明,过敏性哮喘儿童患者肠黏膜通透性明显高于健康儿童。肠道菌群是机体消化系统微环境的重要组成部分,与许多疾病尤其是过敏性疾病发生发展关系密切。研究表明,肠道菌群可参与肺部免疫调节和机体防御[11]。Trompette等[12]发现,肠道菌群对膳食纤维的代谢能影响气道过敏反应和稳态。本实验结果显示,过敏性哮喘小鼠肠道菌群菌落组成结构与对照组明显不同,经大承气汤治疗后,肠道菌群结构有所恢复。大肠杆菌是肠道中一类机会致病性细菌。Jong等[13]发现,过敏性哮喘患者病重程度与大肠杆菌入血指数呈正相关。乳酸杆菌是常见的肠道益生菌。Wu等[14]发现,LGG(Lactobacillus rhamnosus GG)能明显改善OVA诱导的小鼠气道炎症反应,同时促进气道重构和胶原蛋白表达。本实验结果显示,过敏性哮喘小鼠肠道大肠杆菌数量明显增加,乳酸杆菌数量明显下降,经大承气汤治疗后,大肠杆菌数量明显下降,乳酸杆菌数量明显增加,与上述相关研究结果基本一致。
综上所述,OVA诱导哮喘小鼠存在肠道菌群组成结构的改变,尤其大肠杆菌和肠球菌明显增加,乳酸杆菌减少,大承气汤可纠正哮喘小鼠肠道菌群组成结构的改变,这可能是大承气汤发挥治疗哮喘小鼠疗效的作用机制。然而,大承气汤对肠道菌群的调节作用是否为其疗效作用的关键,尚需使用广谱抗生素清除肠道菌群或利用无菌动物模型进一步证实。此外,肠道菌群及其代谢产物是如何影响哮喘小鼠肺部免疫功能和稳态的,均值得进一步研究。
[1] 周逸珊,李诚,刘晓清,等.玉屏风颗粒联合布地奈德福莫特罗粉吸入剂治疗支气管哮喘的疗效观察[J].广东医学,2019,40(24):3446-3451.
[2] 白志余,庞桂芬,胡晓蕴,等.肠道、肺部菌群直接或通过肠-肺轴对呼吸系统慢性疾病的影响[J].中国微生态学杂志,2018,30(9):1091-1095.
[3] 梁军,苑宏宇,刘俊希.基于“肺与大肠相表里”中医理论探讨肠道菌群与过敏性哮喘的相关性[J].中医药学报,2019,47(5):125-128.
[4] KOZIK A J, HUANG Y J. The microbiome in asthma:role in pathogenesis, phenotype, and response to treatment[J]. Ann Allergy Asthma Immunol,2019,122(3):270-275.
[5] 刘茈蕊,王永安,钟大玲,等.大承气汤对过敏性哮喘小鼠肺部炎症及MAPK信号通路的影响[J].中国实验方剂学杂志,2019,25(9):1-5.
[6] 钟大玲,吴佳佳,李根茂,等.大承气汤对过敏性哮喘小鼠肺组织形态及IgE水平的影响[J].中国中医药信息杂志,2016,23(7):58-60.
[7] REDDY A T, LAKSHMI S P, REDDY R C. Murine model of allergen induced asthma[J]. Journal of Visualized Experiments,2012(63):3771.
[8] MJÖSBERG J, RAO A. Lung inflammation originating in the gut[J]. Science,2018,359(6371):36-37.
[9] 董美玲,白慧梅.从“肺与大肠相表里”论大承气汤灌肠在哮喘中的应用[J].亚太传统医药,2017,13(18):122-123.
[10] HIJAZI Z, MOLLA A M, AL-HABASHI H, et al. Intestinal permeability is increased in bronchial asthma[J]. Archives of Disease in Childhood,2004,89(3):227-229.
[11] SAMUELSON D R, WELSH D A, SHELLITO J E. Regulation of lung immunity and host defense by the intestinal microbiota[J]. Frontiers in Microbiology,2015,6:1085.
[12] TROMPETTE A, GOLLWITZER E S, YADAVA K, et al. Gut microbiota metabolism of dietary fiber influences allergic airway disease and hematopoiesis[J]. Nature Medicine,2014,20(2):159-166.
[13] JONG YANG H J, BANG D W, RYOO E, et al. Asthma and risk of community-acquired blood stream infection caused by Escherichia Coli:A population-based case-control study[J]. Journal of Allergy and Clinical Immunology,2013,131(2):AB152.
[14] WU C T, LIN F H, LEE Y T, et al. Effect of Lactobacillus rhamnosus GG immunopathologic changes in chronic mouse asthma model[J]. Journal of Microbiology, Immunology and Infection,2019,52(6):911-919.
Effects ofDecoction on Intestinal Flora in Allergic Asthmatic Mice Based on 16S rDNA Sequencing
WANG Yong’an1, LI Yalan1, WU Jiajia1, GE Dongyu2, PENG Guiying1
To investigate the effects ofdecoction on intestinal flora in allergic asthmatic mice through 16S rDNA sequencing.SPF C57BL/6 female mice were randomly divided into control group, model group,Decoction group and dexamethasone group. The allergic asthma murine model was established by immunizing with ovalbumin and Al(OH)3mixture. At the end of the experiment, lungs were dissected for PAS staining and feces were collected for 16S rDNA sequencing as well as bacterial selective culture and microbial community count.Compared with control group, the lung index of mice in the model group significantly increased (<0.001), the alveolar structure disappeared, a large number of inflammatory cells infiltrated the bronchus and blood vessels, and a large amount of mucin was secreted in the trachea. Compared with the model group, the lung index of theDecoction group significantly decreased(<0.05), the alveolar structure was clearer, the inflammatory cell infiltration was significantly reduced, and the mucin secretion in the trachea was significantly reduced. The analysis of the species composition of the intestinal flora showed that the content ofandin the model group decreased, and the content increased inDecoction group; the content ofin the model group increased, but decreased inDecoction group. The community composition of intestinal microbiota from mice in the model group was significantly different from that of the control group, and the flora structure recovered inDecoction group; The results of selective culture of intestinal flora showed that the number of intestinalandin the model group mice increased significantly (<0.001,<0.01), and significantly decreased inDecoction group (<0.01,<0.05); the number of lactobacilli in the intestines of mice in the model group decreased significantly (<0.01), and increased significantly inDecoction group (<0.01).Decoction can reduce the content ofandin the intestinal tract of asthmatic mice, increase the content of lactobacilli, and restore the communities of the intestinal flora.
allergic asthma;Decoction; intestinal flora; 16S rDNA sequencing; mice
R285.5
A
1005-5304(2021)02-0076-05
10.19879/j.cnki.1005-5304.202008445

国家自然科学基金面上项目(81473656);北京中医药大学基本科研业务费项目(2019-JYB-TD014)
(收稿日期:2020-08-28)
(修回日期:2020-09-16;编辑:华强)

