盐酸酸洗废液制备α-纳米Fe2O3的工艺优化
张震斌 *,陈玥琪,陈杰,商井远
(1.辽宁工业大学化学与环境工程学院,辽宁 锦州 121001;2.秦皇岛天大环保研究院,河北 秦皇岛 066004;3.葫芦岛市生态环境保护服务中心,辽宁 葫芦岛 125000)
酸洗工序广泛应用于钢铁工业及电镀行业,它是金属表面清洁、除锈、改善结构的一道重要工序[1-2]。酸洗过程会产生大量的酸洗废液,欧盟每年来自钢铁行业的酸洗废液多达300 000 m3,其中有1/2不能立即处理而必须储存起来[3],而我国每年来自钢铁行业的酸洗废液约为1 000 000 m3[4]。酸洗废液因腐蚀性、高酸性和高金属含量而被列入危险废物名录之中[5]。酸洗废液不经任何处理便排入环境中,不仅造成严重污染,而且是资源浪费。酸洗废液的处理已经成为钢铁精加工行业面临的一大难题。酸洗废液资源回收与利用的主要方法包括膜法回收酸[6]、氧化−沉淀法回收铁[7-10]、蒸发法回收金属[11]、化学法制备絮凝剂[12-13]等。
某铁道机车车辆配件制造公司产生的酸洗废液主要含有以下成分(以质量分数表示):残酸(以 HCl计)14% ~ 17%,FeCl26% ~ 8%,FeCl31% ~ 3%,Cr3+0.8% ~ 1.0%,Mn2+0.5% ~ 1.0%。本研究以该酸洗废液为主要原料,采用空气−双氧水双重氧化及沉淀法制备纳米氧化铁,对产物进行了表征,并考察了工艺条件对氧化铁平均粒径和纯度的影响。
1 实验
1.1 材料及仪器
原料:盐酸酸洗废液和废旧氧化铁皮取自某铁道机车车辆配件制造公司。
试剂:30% H2O2、聚丙烯酰胺(PAM)、KMnO4、氨水、聚乙烯吡咯烷酮(PVP),均为分析纯。
仪器:DF-101S恒温加热磁力搅拌水浴锅(上海湃澜仪器设备有限公司),KH19A台式高速高性能离心机(湖南凯达科学仪器有限公司),SHZ-D(III)循环水式真空泵(巩义市科瑞仪器有限公司),KQ3200超声波清洗器(昆山市超声仪器有限公司),D/MAX PC-2500 X射线衍射仪(日本理学),Phenom ProX扫描电子显微镜(荷兰飞纳)。
1.2 实验流程
1.2.1 氯化亚铁的制备
首先,分别称取100 g酸洗废液和35 g废旧铁皮,加入到500 mL烧杯中,在磁力搅拌下充分反应掉残余的盐酸。然后加PAM絮凝沉淀未反应的废旧铁皮残渣,压滤、离心分离后制得绿色氯化亚铁粗产物A。
1.2.2 氯化亚铁中杂质的去除
将氯化亚铁粗产物A稀释后加入适量KMnO4,使其与溶液中Mn2+的物质的量比大约为2∶(3 ~ 5),直至出现二氧化锰絮体,用盐酸调节该絮体的pH为8。然后以50 r/min磁力搅拌溶液5 min,再以200 ~400 r/min磁力搅拌溶液30 min,静置后取上清液,加PAM絮凝沉淀杂质,再过滤、离心,制得氯化亚铁产物B[14]。
1.2.3 α-Fe2O3的制备
采用空气−双氧水双重氧化法制备α-Fe2O3。具体制备流程如下:在超声分散作用下,采用反向滴定法将100 g氯化亚铁溶液逐滴加入到一定质量浓度的氨水和PVP混合溶液中,得到Fe(OH)2胶体。然后通入一定量的空气和1 ~ 3滴30%双氧水进行氧化,得到羟基氧化铁(FeOOH)胶体前驱体,经过多次过滤、洗涤和离心,最后干燥、煅烧,得到α-Fe2O3红褐色粉末[15]。反应原理如下:
(1) 沉淀反应:FeCl2+ 2NH3·H2O → Fe(OH)2+ 2NH4Cl。
(2) 氧化反应:4Fe(OH)2+ O2→ 4FeOOH + 2H2O。
(3) 煅烧脱水:2FeOOH → Fe2O3+ H2O。
1.2.4 铁含量的测定
采用《清洗液中总铁含量的测定》(HG/T 4324-2012)和《水处理剂 氯化铁》(GB 4482-2006)中规定的方法测定Fe的回收率及产物中α-Fe2O3的含量。
1.2.5 α-Fe2O3的表征
采用X射线衍射仪对产物的相成分进行测定,采用扫描电子显微镜对产物的表面形貌进行分析。
2 结果与讨论
2.1 制备工艺对α-Fe2O3性能的影响
2.1.1 FeCl2质量浓度
向含有氨水5 g/L、PVP 2 g/L的100 g溶液的锥形瓶中逐滴加入不同质量浓度的FeCl2溶液,待沉淀反应完全后置于超声分散仪中超声分散,同时通入空气并加入1 ~ 3滴双氧水溶液,超声分散60 min后进行洗涤,再离心、干燥、煅烧,得到棕红色、鲜红色或红褐色产物。
从表1可知,随着FeCl2质量浓度的增加,α-Fe2O3平均粒径先减小后增大,当FeCl2为18 g/L时,α-Fe2O3平均粒径最小,产物的α-Fe2O3含量最高。当FeCl2质量浓度较低时,氨水浓度相对较高,虽然能形成大量晶核,但又因其表面能级高,且体系处于超声分散状态下,导致高表面能级的晶核相互碰撞并团簇成大聚合体,α-Fe2O3平均粒径较大;当FeCl2质量浓度过高时,体系成核速率快,但同时反应体系黏度过大,导致部分Fe2+被包裹而无法被氧化成Fe3+,从而生成Fe3O4,使α-Fe2O3纯度降低,粒径增大。
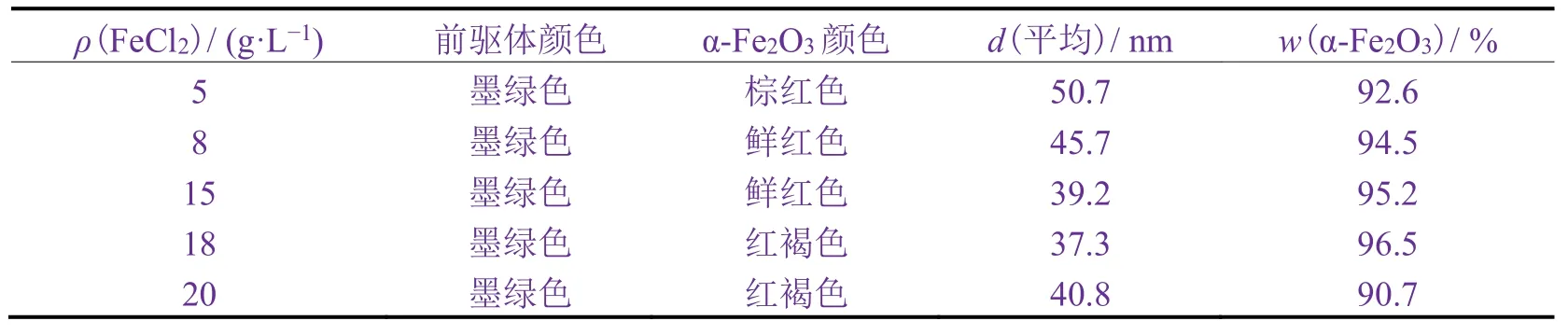
表1 FeCl2质量浓度对α-Fe2O3性能的影响Table 1 Effect of mass concentration of FeCl2 on properties of α-Fe2O3
2.1.2 氨水质量浓度
向含有FeCl218 g/L、PVP 2 g/L的100 g溶液的锥形瓶中逐滴加入不同质量浓度的氨水溶液,超声分散后同时通入空气并加入1 ~ 3滴双氧水溶液,超声分散60 min后进行洗涤、离心、干燥、煅烧,得到棕红色、鲜红色或红褐色产物。
从表2可知,随着氨水质量浓度的增加,α-Fe2O3平均粒径逐渐增大,当氨水质量浓度为5 g/L时,α-Fe2O3平均粒径最大,α-Fe2O3含量最高,Fe回收率为92.1%。作为沉淀剂的氨水,对晶核形成及晶粒生长速率有显著影响。随着氨水增多,晶核形成速率加快,生成小而多的晶粒。继续增大氨水用量,Fe(OH)2和 Fe(OH)2−x(OH)x沉淀不断形成。但由于氨水具有较强的配位能力,氨水太多会令沉淀发生溶解,不易形成稳定的晶粒[16],最终导致α-Fe2O3的平均粒径增大,含量降低。
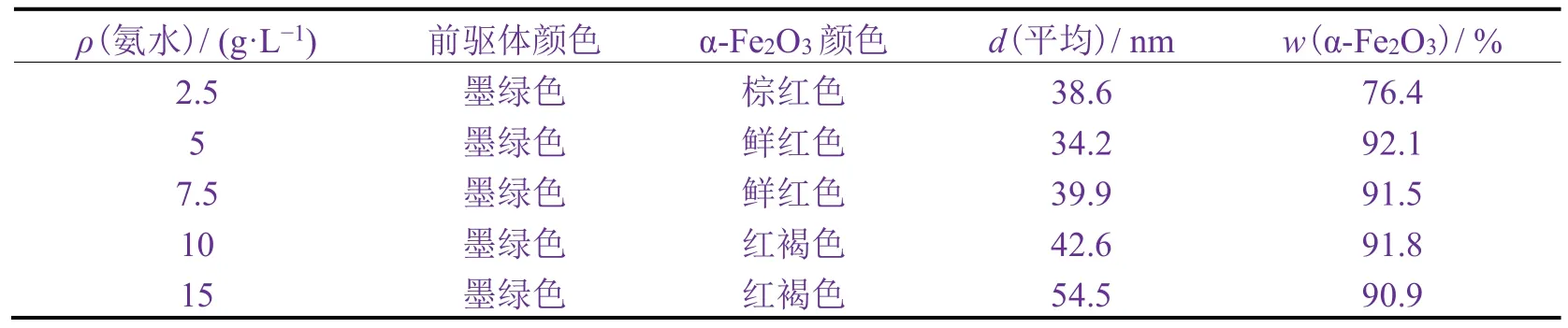
表2 氨水质量浓度对α-Fe2O3性能的影响Table 2 Effect of mass fraction of ammonia water on properties of α-Fe2O3
2.1.3 超声时间
图1给出了在FeCl2、PVP和氨水分别为18、2和5 g/L,105 °C干燥2 h,800 °C煅烧2 h的条件下,不同超声时间所得α-Fe2O3的SEM图像。从中可以看出,随着超声时间的延长,α-Fe2O3的分散性越来越好,平均粒径却逐渐增大。这是因为超声空化时产生的局部高温、高压或强冲击波、微射流等可大幅度地弱化纳米粒子间的表面能,改善微细粒子的团聚性[17]。但当超声时间为90 min时,由于热能和机械能的增加,颗粒碰撞的概率也增大,平均粒径反而变大。因此超声时间以60 min为宜,此时所制得的α-Fe2O3粉体粒径较小,分散性较好。

图1 不同超声时间所得α-Fe2O3的SEM图像Figure 1 SEM images of α-Fe2O3 prepared by ultrasonic agitation for different time
2.1.4 煅烧温度
图2给出了在FeCl2、PVP和氨水分别为18、2和5 g/L,105 °C干燥2 h,超声振荡60 min时,不同煅烧温度下所得α-Fe2O3的XRD谱图。可以看出,煅烧温度对α-Fe2O3的结晶度和粒径影响显著。800 °C煅烧2 h的情况下,α-纳米Fe2O3的衍射峰最窄、最高,表明该煅烧温度下获得的α-Fe2O3的粒径最小,结晶度最高。利用Jade6.0软件对各样品的衍射谱图进行拟合,计算出200、400、600、700和800 °C的结晶度依次为65.62%、75.83%、65.89%、95.43%和95.68%。显然,随着煅烧温度的升高,α-Fe2O3结晶度逐渐增大。这是因为温度越高越有利于 α-Fe2O3微粒间的水蒸发,α-Fe2O3的致密化程度将逐渐增强[7]。但煅烧温度太高时,晶粒平均粒径变大。因此,煅烧温度700 °C较为适宜。
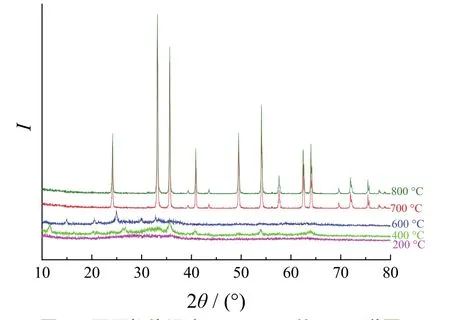
图2 不同煅烧温度下α-Fe2O3的XRD谱图Figure 2 X-ray diffraction patterns of α-Fe2O3 prepared by calcination at different temperatures
2.2 工艺优化
在主要制备工艺的单因素实验基础上,通过设计四因素三水平正交试验,进一步优化α-Fe2O3的制备工艺。正交试验结果见表3。
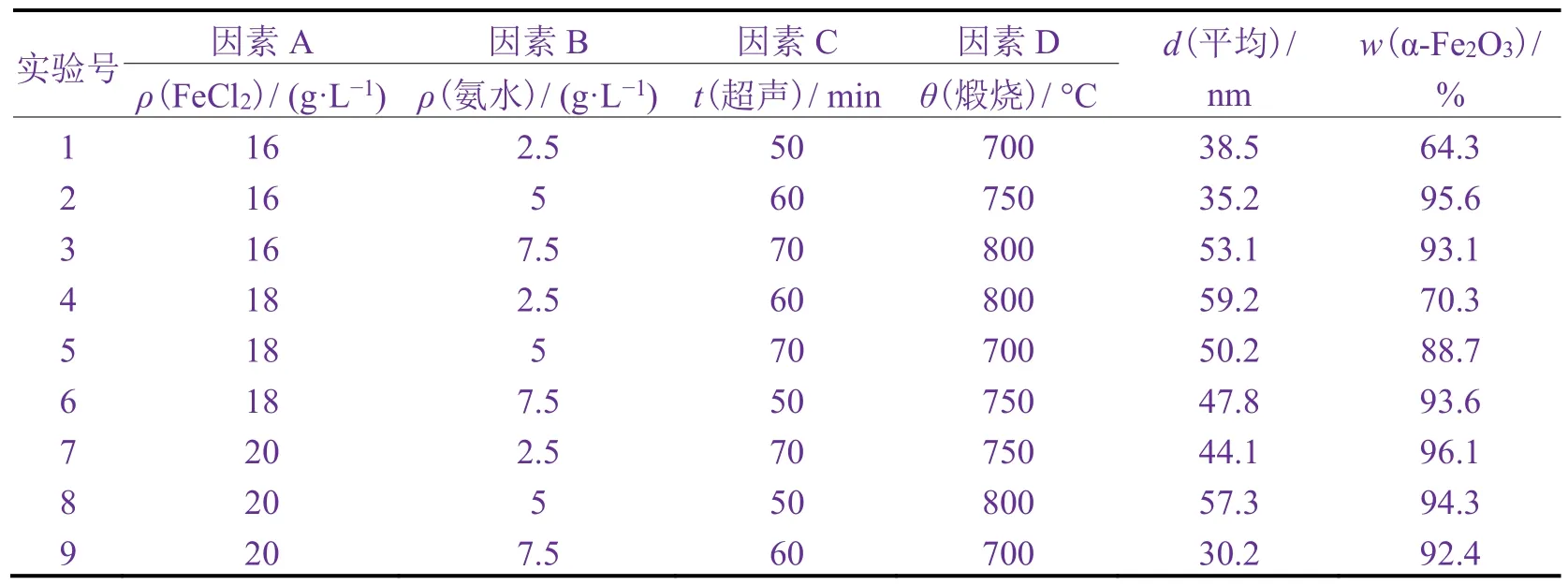
表3 正交试验结果Table 3 Result of orthogonal test
由表4可知,制备工艺的各个因素和水平对α-Fe2O3的平均粒径(d)和α-Fe2O3含量(w)的影响不同,因此,选择优化工艺必须考虑所有实验结果。影响α-Fe2O3平均粒径的主次顺序为D(煅烧温度)> A(FeCl2质量浓度)> C(超声时间)> B(氨水质量浓度),优化组合为FeCl216 g/L(A1)、氨水7.5 g/L(B3)、超声时间60 min(C2)、煅烧温度700 °C(D1)。影响α-Fe2O3含量的主次顺序为B(氨水质量浓度)> D(煅烧温度)>A(FeCl2质量浓度)> C(超声时间),优化组合为FeCl220 g/L(A3)、氨水7.5 g/L(B3)、超声时间70 min(C3)、煅烧温度 750 °C(D2)。
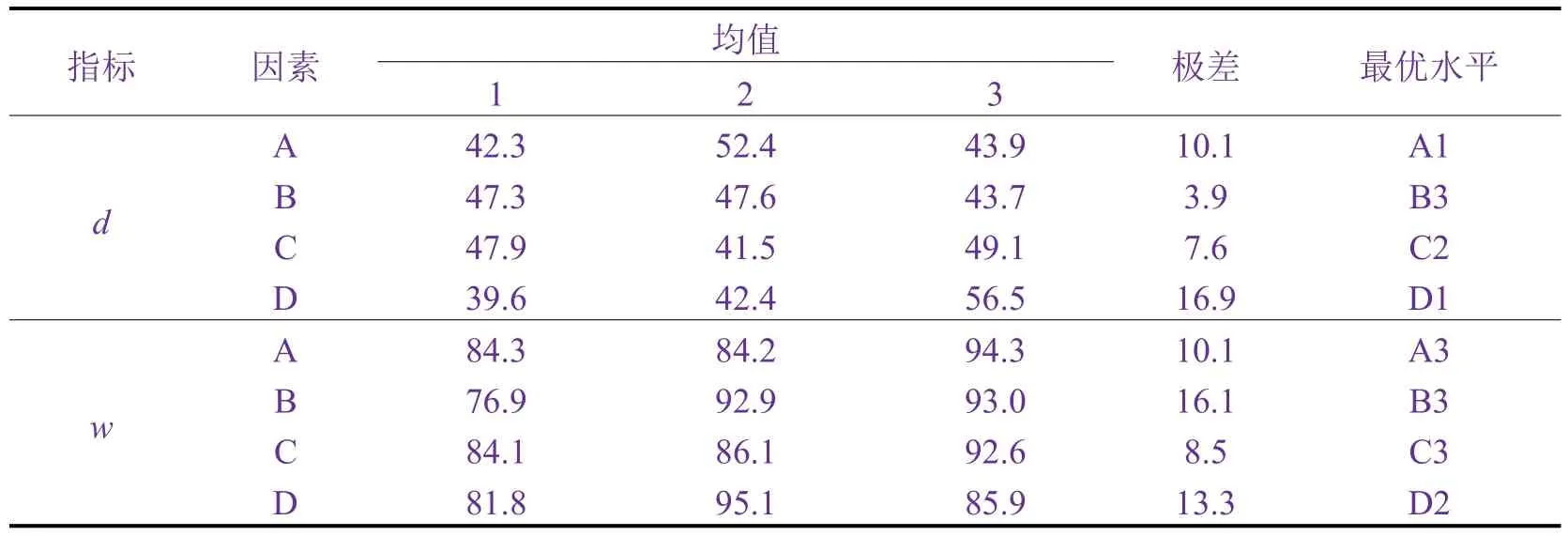
表4 正交试验直观分析Table 4 Intuitive analysis of the orthogonal test
由表5可知,FeCl2浓度对d和w有较显著的影响,氨水质量浓度对d影响不显著,对w有显著的影响,而超声时间对d和w的影响一般显著,煅烧温度则对d和w影响显著。
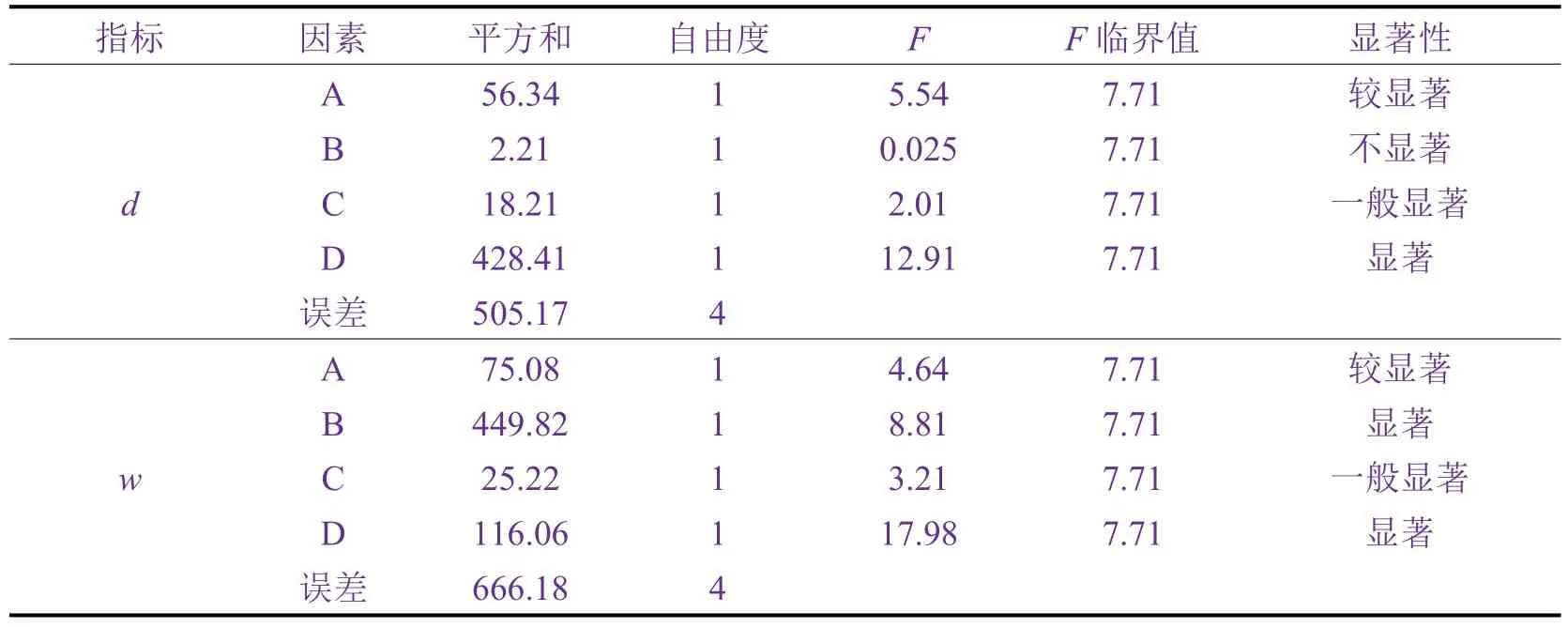
表5 方差分析结果Table 5 Result of variance analysis
综合表4和表5可知,煅烧温度对α-Fe2O3的d影响最大,氨水质量浓度的影响最小;氨水质量浓度对α-Fe2O3的w影响最大,超声时间影响最小。根据均值,氨水为5 g/L时,d= 47.6 nm,w= 92.9%;氨水为7.5 g/L时,d= 43.7 nm,w= 93.0%。综合考虑,氨水质量浓度优化结果为7.5 g/L。煅烧温度为700 °C时,d= 39.6 nm,w= 81.8%;煅烧温度为750 °C时,d= 42.4 nm,w= 95.1%。α-Fe2O3含量是关注的重点,煅烧温度优化结果为750 °C。FeCl2质量浓度对α-Fe2O3的d和w有较显著的的影响,而考虑到铁资源的回收,FeCl2质量浓度以16 g/L为宜。超声时间对α-Fe2O3的d和w的影响不显著,考虑到能源消耗,确定为50 min。
在上述优化工艺条件下,通过3组平行实验制备α-Fe2O3,测得其平均粒径为38.2 nm,α-Fe2O3的平均含量为95.3%。
2.3 产物的形貌和结构分析
从图3示出的优化工艺条件下制得的α-Fe2O3的SEM照片可以看出,合成的α-Fe2O3粉体的均匀性较好,分散性一般,平均粒径在30 ~ 50 nm之间。
优化工艺条件下得到的α-Fe2O3的XRD图谱(图4)与JCPDSNo.33-0664标准PDF卡片的衍射峰基本一致[18-19]。24.18°、33.17°、35.66°、40.88°、49.46°、54.03°、62.64°、63.92°等处的衍射峰分别对应(012)、(104)、(101)、(113)、(024)、(116)、(214)、(300)晶面。根据Scherrer公式计算(101)晶面的晶粒尺寸为(35.6 ± 2.5) nm,与SEM照片中的颗粒尺寸基本一致。

图3 最优工艺所得α-Fe2O3的SEM图像Figure 3 Scanning electron microscopic image of α-Fe2O3 prepared under optimal conditions
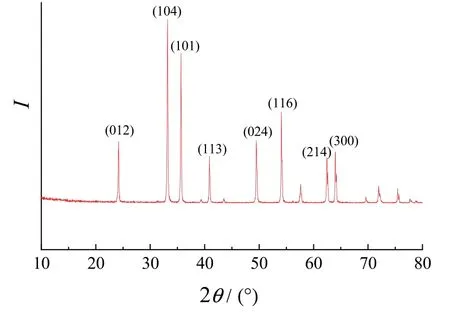
图4 最优工艺所得α-Fe2O3的XRD谱图Figure 4 X-ray diffraction pattern of α-Fe2O3 prepared under optimal conditions
3 结论
以某机车车辆配件制造公司产生的盐酸酸洗废液和废旧氧化铁皮为原料来制备α-Fe2O3,研究了制备工艺对α-Fe2O3性能的影响,得出以下结论:
(1) 以FeCl2为原料,采用空气−双氧水双重氧化及沉淀法制备α-Fe2O3时,氨水浓度对产物中α-Fe2O3的含量影响最显著,煅烧温度对α-Fe2O3粒径的影响最显著。
(2) 当FeCl2质量浓度为16 g/L,氨水质量浓度为5 g/L,超声时间为50 min,煅烧温度为750 °C时,获得α-Fe2O3的平均粒径为38.2 nm,α-Fe2O3的含量为95.3%。

