原发性心脏高级别B细胞淋巴瘤化疗缓解后复发1例报告
李 磊,王 智,由春媛
1.南京医科大学附属无锡第二医院心内科,江苏 无锡 214000;2.南京医科大学附属无锡第二医院血液科,江苏 无锡214000
原发性心脏淋巴瘤(primary cardiac lymphoma,PCL)是一种罕见恶性肿瘤。PCL占心脏肿瘤的1.3%,占结外淋巴瘤的0.5%[1-2]。PCL早期临床表现缺乏特异性,早期诊断比较困难,很多患者确诊时已存在较大肿块,常存在肿瘤侵犯心脏组织而引起的合并症,这也造成PCL预后不佳。本例患者确诊时,心脏已存在多发肿块合并Ⅲ°房室传导阻滞(atrioventricular block,AVB)。手术切除大部分肿瘤组织并接受9个疗程的CHOP方案化疗后得以缓解,但患者在淋巴瘤缓解半年后复发。本文结合该患者的特点,对原发心脏淋巴瘤分型、治疗、预后及淋巴瘤分型对治疗和预后的影响进行阐述。
1 临床资料
患者,女性,65岁。因“间断性咳嗽1个月”至南京医科大学附属无锡第二医院急诊科就诊。实验室查快速C反应蛋白249.3 mg/L;胸片:两肺纹理增多。门诊考虑“呼吸道感染”予头孢尼西钠、硫酸依替米星治疗,未见好转。自诉胸闷不适。查心电图:窦性心律;Ⅲ°AVB。2018年5月30日入南京医科大学附属无锡第二医院心内科进一步诊治。入院检查:体温为36.3 ℃,脉搏48次/min,呼吸18次/min,血压139/73 mmHg,浅表淋巴结未及肿大,心界无扩大,心率48次/min,未闻及病理性杂音及心包摩擦音,两肺未闻及湿性啰音,肝脾未扪及肿大,双下肢无水肿。血常规检查白细胞计数为3.82×109/L、红细胞计数为3.98×1012/L、血小板计数为176×109/L、血红蛋白为110 g/L。肝、肾功能指标在正常范围。乙型肝炎病毒(hepatitis B virus,HBV)、丙型肝炎病毒(hepatitis C virus,HCV)、艾滋病毒(human immunodeficiency virus,HIV)、EB病毒(Epstein-Barr virus,EBV)、梅毒抗体均为阴性。患者于2018年6月5日在数字减影血管造影(digital substraction angiography,DSA)下行双腔永久性起搏器植入术。术后患者无不适,于2018年6月11日出院。2018年7月9日,因“反复胸闷、心悸十余天”再次入南京医科大学附属无锡第二医院心内科。入院心电图:阵发性房性心动过速。实验室检查结果显示,脑利钠肽前体为4106 pg/mL。心肌酶谱结果显示,谷草转氨酶为89.2 U/L,a-羟丁酸为700 U/L,乳酸脱氢酶(lactate dehydrogenase,LDH)为937 U/L,肌酸激酶为66.0 U/L,肌酸激酶同工酶为8.3 U/L。2018年7月11日超声心动图检查发现三尖瓣前叶、隔叶及右心房顶可见不规则中等回声团块附着,大小分别为30 mm×16 mm、44 mm×24 mm、25 mm×9 mm,活动度小,边界不清(图1A)。肿块造成三尖瓣机械性狭窄,连续多普勒(continuous wave doppler,CWD)测三尖瓣血流速度2.5 m/s。左心室后壁房室沟及右心室侧壁房室沟分别可见一类椭圆形、中低回声团块,边界不清,不活动,与心肌分界不清,大小分别为35 mm×39 mm、25 mm×35 mm(图1B)。2018年7月13日行胸、上腹、中腹、盆腔计算机断层扫描(computed tomography,CT)平扫+增强:右心房、右心室腔内多发充盈缺损,心包混杂密度影;双侧胸腔少量积液;全身其余部位未见异常(图1C)。肿瘤标志物提示:癌胚抗原为1.08 ng/mL,甲胎蛋白为2.56 ng/mL,糖类抗原(carbohydrate antigen,CA)12-5为51.9 U/mL,CA15-3为4.99 U/mL,CA19-9为2.8 U/mL,铁蛋白为600.5 ng/mL。结合影像学资料及实验室检查数据考虑患者心脏肿瘤可能性大。为排除起搏器术后形成血栓,患者抗凝治疗1周后,复查超声心动图见心脏肿块较前增大,高度提示肿瘤可能。建议至上级医院心脏外科进一步手术治疗,明确病理学诊断。2018年8月7日在上海交通大学医学院附属仁济医院行全麻下心脏肿物切除术,并送病理学检查。术中探查心包黏连严重,为防止心包穿孔及肿物播散,心包肿物未处理。术后心脏肿物病理学检查报告结果显示,c-MYC和Bcl-6重排的双打击高级别B细胞淋巴瘤(high-grade B-cell lymphoma,HGBL)。免疫组织化学:肿瘤细胞CK(-)、LCA(+)、CD20(+)、CD19(95%+)、CD79a(+/-)、CD3(T细胞+)、CD10(小于5%)、Bcl-6(50%)、MUM-1(70%)、ki-67增殖指数(90%)、c-MYC(60%)、P53(++)、Bcl-2(60%)及CD5(T细胞+)。荧光原位杂交(fluorescencein situhybridization,FISH)检测:50%的肿瘤细胞出现c-MYC易位,40%的肿瘤细胞出现Bcl-6易位,Bcl-2未见易位。2018年8月20日再次入南京医科大学附属无锡第二医院血液科,完善骨髓穿刺,结果显示骨髓象未见明显异常。结合影像学资料、骨髓穿刺结果、病理学检查报告、免疫组织化学及基因检测结果,临床诊断为“原发性心脏高级别B细胞淋巴瘤”。2018年8月31日心脏超声检查结果提示,心腔内未见异常团块。左心室后壁房室沟及右心室侧壁房室沟分别见一类圆形、中低回声团块,与心肌分界不清,大小分别为33 mm×46 mm、23 mm×35 mm(图2A、B)。CT平扫:心包不规则增厚伴软组织影;双侧胸腔积液(图2C)。考虑患者术后肿瘤组织并未完全切除干净,建议行R-CHOP方案化疗,患者因利妥昔单抗价格高而拒绝。2018年9月11开始行CHOP方案化疗(环磷酰胺600 mg、表柔比星50 mg、长春地辛2 mg及地塞米松15 mg;1次/d×5 d)。2018年10月19日、2018年11月23日、2019年1月2日、2019年2月15日、2019年3月20日、2019年5月7日、2019年6月25日、2019年8月16日分别给与第2、3、4、5、6、7、8、9次化疗,剂量不变。每次入院化疗,患者均接受心脏超声检查,发现患者心包肿瘤随着化疗次数的增加逐步缩小。2019年6月24日心脏超声检查提示,心包肿瘤消失,心腔内未见异常回声。患者在接受7个疗程化疗后,心脏肿瘤消失。此后又接受2次化疗。化疗结束后,为防止肿瘤复发,建议服用来那度胺维持化疗,患者考虑肿瘤已消失,拒绝后续治疗。2020年1月10日患者因胸闷、咳嗽入院。2020年1月13日心脏超声检查可见左心室后壁房室沟及右心室侧壁房室沟分别见一类圆形、中低回声团块,与心肌分界不清,大小分别为37 mm×15 mm、26 mm×20 mm,右心室壁不规则增厚,中量心包积液(图3A、B)。CT平扫结果显示,心包不规则增厚伴软组织影,双侧胸腔积液(图3C)。结合患者以往心脏淋巴瘤病史,考虑心脏淋巴瘤复发。
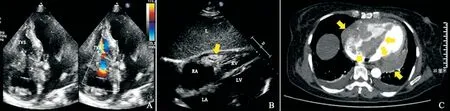
图1 患者起搏器安装术后1个月超声及CT检查Fig.1 The ultrasound diagnosis and CT scan of the patient 1 month after the cardiac pacemaker implantation

图2 患者心脏肿物切除术后超声及CT检查Fig.2 The ultrasound diagnosis and CT scan of the patient after the cardiac mass removal

图3 化疗缓解后复发的超声及CT检查Fig.3 The ultrasound diagnosis and CT scan found the relapse after chemotherapy remission
2 讨 论
原发心脏肿瘤是指病变仅累及心肌和(或)心包而无身体其他器官受累的结外淋巴瘤。PCL发病率低、临床表现缺乏特异性。患者可表现为胸闷、胸痛、气喘、发热、心律失常和体重减轻等[3]。当肿瘤累及其他部位,可表现出不同的症状,这在一定程度上造成及时、正确诊断的困难。当PCL累及心脏传导系统,心电图可表现为AVB、阵发性室性心动过速等[4]。当PCL累及右心室流入道和(或)右心室流出道,可引起三尖瓣机械性梗阻[1]。当PCL累及上腔静脉,患者可因静脉回流受阻而出现颜面部水肿[1]。当PCL累及中枢神经系统,患者可出现言语障碍、失用症等[5]。本例患者间断咳嗽为首发症状,后出现胸闷不适,查心电图提示Ⅲ°AVB,符合安装心脏起搏器指征。安装起搏器后,患者胸闷症状并未缓解,术后心脏超声检查发现心脏多处肿块。最后手术证实为心脏淋巴瘤。逆向推测患者咳嗽、胸闷是PCL的首发症状,Ⅲ°AVB是由PCL累及心脏传导系统所致。有研究表明,心脏起搏器可加速PCL的进展,可能与起搏器本身的钛金属材料有关[6]。心脏超声检查、CT、磁共振成像(magnetic resonance imaging,MRI)和正电子发射计算机断层显像(positron emission tomography,PET)可帮助PCL诊断,其确诊需要组织病理学和免疫组织化学检查结果。
有的PCL患者在化疗和(或)手术切除肿块达到缓解后,AVB可恢复正常[4,7-8]。有的PCL患者在化疗缓解后,Ⅲ°AVB仍没有消失,此类患者可能需要安装起搏器[8]。有的PCL合并Ⅲ°AVB患者在接受手术切除肿块后,可行起搏器安装术[9]。本例患者外科手术时并未拨出起搏器,一方面考虑患者存在Ⅲ°AVB,另一方面考虑后续化疗达到完全缓解后Ⅲ°AVB也许会消失。鉴于起搏器本身可能存在的促进癌症发生、发展的潜在危险,PCL合并Ⅲ°AVB患者是否需要安装起搏器,何时安装起搏器,目前没有统一的见解。希望通过更多的研究和总结,为PCL合并Ⅲ°AVB的患者制定出一个更为清晰的治疗策略。
PCL组织学分型以弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)为主,其余类型有滤泡B细胞淋巴瘤及Burkitt淋巴瘤(Burkitt lymphoma,BL)等[10]。本例患者术后心脏肿物病理学检查报告、免疫组织化学结果提示HGBL。FISH发现c-MYC及Bcl-6基因易位,Bcl-2未见基因易位。根据2016年WHO修订版淋巴组织肿瘤分型确定本例患者为伴有c-MYC和Bcl-6基因重排的HGBL[11]。伴有c-MYC、Bcl-2和(或)Bcl-6基因重排的高级别B细胞淋巴瘤,称伴双重打击或三重打击的HGBL[11],本例患者可称为伴双重打击的HGBL。除了滤泡淋巴瘤和淋巴母细胞淋巴瘤外,伴有c-MYC、Bcl-2和(或)Bcl-6基因重排的B细胞淋巴瘤都可称为伴双重打击或三打击的HGBL[11]。由此可见,双重打击或三打击的HGBL包括了DLBCL、BL及DLBCL/BL一系列形态谱系。R-CHOP是DLBCL是标准治疗方案。研究发现双打击淋巴瘤(double-hit lymphoma,DHL)应用R-CHOP方案后,预后很差,5年无进展生存(progression-free survival,PFS)率和总生存(overall survival,OS)率为20%~30%[12]。对于DHL患者的化疗方案,应选择剂量调整过的EPOCH-R、R-Hyper CVAD/MA、R-CODOX-M/IVAC强化治疗为一线治疗方案[13]。如果DHL患者未接受强化化疗只接受了R-CHOP化疗,还应继续采用自体造血干细胞移植(autologous stem cell transplant,autoSCT)治疗。有研究表明,只接受R-CHOP化疗的患者与接受R-CHOP和autoSCT比较,后者3年无复发生存(relapse-free survival,RFS)率和OS率均有所增加[14-15],预后也更好。DHL患者接受同种异体造血干细胞移植(allogeneic stem cell transplant,alloSCT)也会取得较好的预后,但是需要考虑其潜在移植相关的并发症[16]。由于DHL患者通常预后很差,这一类型的治疗方法也越来越多,如嵌合抗原受体T细胞(chimeric antigen receptor T cell,CAR-T)治疗也取得比较好的疗效[17],还有其他新的治疗方法包括Bcl-2抑制剂、BET家族抑制剂、PI3K抑制剂等。DHL患者较BL和DLBCL患者更易发生结外淋巴结受累,包括骨髓、中枢神经系统受累。有研究建议高侵袭性淋巴瘤患者应鞘内注射甲氨蝶呤和(或)阿糖孢苷,全身化疗时加入甲氨蝶呤以预防中枢神经系统受累[18]。有研究表明,DHL患者的LDH中位数为727 U/L,是BL组和DLBCL组的2倍[19],推测LDH水平是PCL患者预后不良的指标。本例患者LDH为937 U/L,提示患者预后不佳。本例患者在接受CHOP化疗缓解半年后复发。下一步需要评估患者的情况,采取造血干细胞移植或强化化疗方案,并考虑是否预防性治疗中枢神经系统受累。
PCL患者有化疗、放疗、手术治疗和造血干细胞移植等治疗手段。一般首选化疗,对于存在肿块造成右心梗阻的患者,可先姑息性切除肿块,再行化疗。PCL属于淋巴瘤,其治疗方案可参考淋巴瘤的治疗方案。虽然R-CHOP为目前主流的化疗方案,但考虑到PCL患者同样存在c-MYC、Bcl-6及Bcl-2基因易位,对于存在基因易位的PCL患者,其他的强化化疗方案如R-Hyper CVAD/MA、R-CODOX-M/IVAC和造血干细胞移植也值得一试。

