腺苷酸激酶4在肺腺癌中的表达及其临床意义
田 华,何小勇,王道猛,杨永国,梅 霞,钱 斌
1.扬州市江都人民医院病理科,江苏 扬州 225200;2.扬州市江都人民医院胸外科,江苏 扬州 225200
肺癌是世界范围内病死率第一位的恶性肿瘤,而腺癌是肺癌最常见的组织学类型,约占所有肺癌的50%[1]。目前研究[2]表明,大多数肺腺癌是通过肺泡上皮非典型腺瘤样增生(atypital adenomatous hyperplasia,AAH)、原位腺癌(adenocarcinomain situ,AIS)、微浸润性腺癌(microinvasive adenocarcinoma,MIA)到浸润性腺癌(invasive adenocarcinoma,IA)这个癌变顺序发展而来,但其具体机制尚不明确。腺苷酸激酶4(adenylate kinase 4,AK4)是一种调节腺嘌呤核苷酸代谢和体内稳态的关键调节酶,研究发现AK4可促进肺癌细胞的转移,且其表达与肺癌患者预后差密切相关。然而,AK4在肺腺癌发生、发展过程中的作用还不十分清楚,本研究应用免疫组织化学方法研究AK4在肺腺癌发生过程中的不同阶段的表达,同时分析其与IA临床病理学特征之间的关系,旨在探讨AK4在肺腺癌发生、发展过程中的作用,为肺腺癌的早期诊断提供一个生物标志物,也为肺IA治疗提供一个潜在的分子靶点。
1 资料和方法
1.1 病例资料
收集江苏省扬州市江都人民医院2017年1月—2019年12月胸外科手术切除的297例肺腺癌不同阶段病变的标本,所有病例均经病理学检查确诊,其中IA 152例,MIA 52例,AIS 60例和AAH 33例。同时选取因肺部非肿瘤性病变进行肺手术切除的肺组织30例作为正常对照。
1.2 免疫组织化学方法
1.2.1 免疫组织化学试剂
鼠抗人AK4单克隆抗体购自美国LifeSpan Biosciences 公司,工作浓度为1 ∶150;EnVision法免疫组织化学试剂盒、抗原修复液、DAB显色试剂盒等购自美国Dako公司;H-E染色试剂购自北京中杉金桥生物技术有限公司。
1.2.2 免疫组织化学方法
所有手术切除标本均采用4%中性甲醛溶液固定,常规石蜡包埋成蜡块,然后使用切片机切片5 μm厚,分别进行H-E染色和免疫组织化学染色。免疫组织化学染色采用EnVision法,主要步骤如下:切片先放置于67 ℃烤箱中烘片2 h,然后脱蜡至水后用磷酸盐缓冲液(phosphatebuffered saline,PBS)冲洗3次,每次3 min;采用高压锅在高温高压下进行抗原修复,抗原修复液为枸橼酸钠缓冲液(pH为6.0),高压锅煮沸后继续加热2 min,然后自来水下自然冷却,冷却后取出玻片,先用蒸馏水冲洗2次,然后用PBS冲洗2次,每次3 min;切片滴加1滴3%H2O2,室温下温育10 min,以阻断内源性过氧化物酶活性,然后PBS冲洗3次,每次3 min;切片上滴加一抗,放置湿盒中,4 ℃冰箱中温育过夜;次日湿盒取出后置于室温下30 min,PBS冲洗3次,每次3 min;滴加试剂A,室温下温育20 min,PBS冲洗3次,每次3 min;滴加试剂B,室温下温育30 min,PBS冲洗3次,每次3 min;滴加新鲜配制的DAB液,镜下控制反应时间,自来水终止染色;苏木精复染,0.1% HCl分化,自来水冲洗,蓝化,梯度乙醇脱水干燥,二甲苯透明,中性树胶封固,在显微镜下观察。
1.3 结果判断
所有免疫组织化学染色切片由病理科2名高年资主治医师在双盲条件下进行判读,结果不一致者在多头显微镜下共同阅片并达成一致。AK4阳性表达为颗粒状胞质阳性,结果判断参照参考文献[3],先根据染色强度分为:无染色,0分;弱阳性,1+;中等阳性,2+;强阳性3+;然后根据阳性细胞百分比为25%进一步分为2组,AK4染色结果分为高表达和低表达,当阳性细胞染色强度为2+或3+且阳性细胞比例>25%为高表达,其余则为低表达。
1.4 统计学处理
采用SPSS 22.0统计软件对数据进行统计学分析。肺腺癌发生不同阶段病变中AK4表达的差异采用χ2检验,IA中AK4表达与临床病理学指标之间的关系采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 肺IA临床病理学特征
152例肺IA中,患者发病年龄52~73岁,平均62.6岁;男性90例,女性62例;肿瘤位于左肺66例,右肺86例;吸烟者55例,不吸烟者97例;肿瘤最大径为1.1~5.3 cm,其中≤3 cm者102例,>3 cm者50例;肺腺癌组织学类型以主要结构作为该例主要组织学类型,腺泡型68例、贴壁型30例、微乳头型22例、实体型16例、乳头型16例;有淋巴血管侵犯者40例,无淋巴血管侵犯者112例;有胸膜侵犯者34例,无胸膜侵犯者118例;有淋巴结转移者53例,无淋巴结转移者99例;pTNM分期参照美国癌症联合会(American Joint Committee on Cancer,AJCC)第8版进行分期,Ⅰ期92例,Ⅱ期60例。
2.2 AK4在肺腺癌不同阶段病变中的表达
AK4阳性表达为细胞质内颗粒状阳性(图1)。正常肺组织中,所有病例均无AK4表达。AK4在AAH、AIS、MIA和IA中的高表达率分别为63.6%、75.0%、71.1%和81.6%,均明显高于正常肺组织,差异有统计学意义(P<0.01)。AK4在AIS与AAH、AIS与MIA、MIA与IA之间的高表达率差异无统计学意义(P>0.05,表1)。

表1 AK4在肺腺癌发生不同阶段病变中的表达Tab.1 Expression of AK4 in different lesions of lung adenocarcinoma
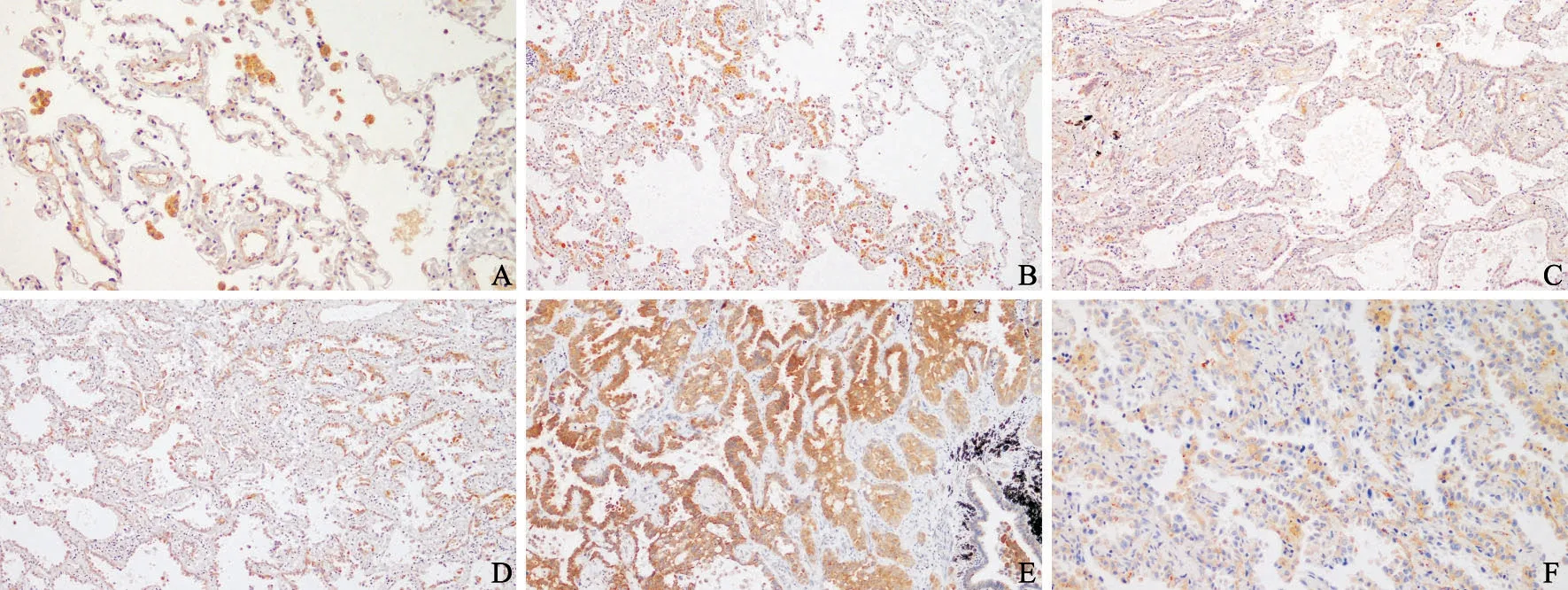
图1 AK4在肺腺癌发生不同阶段病变中的表达Fig.1 Expression of AK4 at different stages of carcinogenesis in lung adenocarcinoma
2.3 肺腺癌中AK4表达与临床病理学特征之间的关系
AK4高表达与肺腺癌患者的年龄、部位、吸烟状态、肿瘤大小、脉管侵犯和胸膜侵犯无关(P>0.05)。我们根据肺腺癌主要结构作为该例最终的组织学类型,结果显示,AK4在微乳头型、实体型肺腺癌中高表达率虽然高于腺泡型、贴壁型和乳头型腺癌,但差异无统计学意义(P>0.05)。AK4在有淋巴结转移的肺腺癌中高表达率高于无淋巴结转移者,差异有统计学意义(P<0.05);pTNM分期中,Ⅱ期肺腺癌中AK4高表达率高于Ⅰ期肺腺癌,差异有统计学意义(P<0.05,表2)。

表2 AK4高表达与肺IA临床病理学特征之间的关系Tab.2 The correlation between high expression of AK4 and clinicopathological features in invasive adenocarcinoma of lung
3 讨 论
肺癌是呼吸系统最常见的恶性肿瘤,近年来尽管包括外科手术、放疗、化疗、靶向治疗等多种治疗方法取得了很大进展,但肺癌患者的总体预后仍然很差,所有分期的5年生存率仅为15%,而且仅有16%的肺癌患者可在早期得到诊断[4]。因此,寻找肺癌发生、发展过程中的基因改变对于评估患者预后、提供肺癌早期诊断的生物标志物,以及提供肺癌治疗的靶点具有重要价值。
AK是多种生物活细胞中高能量磷酸化转移反应中的一类关键调节酶,在腺嘌呤核苷酸代谢和维持体内稳态中发挥重要作用[5]。目前在人体组织中发现了9种AK同工酶,它们共同调节不同细胞内的腺嘌呤核苷酸组成,以维持细胞的能量动态平衡[6]。不同AK在细胞内的定位不同,其中AK3和AK4表达于线粒体基质中,AK4与AK3具有高度的序列同源。但与AK3不同,AK4已被报道在体外无酶活性,但仍保留其核苷酸结合能力,生理上与线粒体ADP/ATP转运子相互作用,并作为一种应激反应蛋白维持细胞存活[7]。
AK4在恶性肿瘤中的作用近年来已有相关报道。郭嘉宁等[8]研究发现,前列腺癌中AK4阳性表达高于癌旁组织,且AK4异常表达与前列腺癌复发、远处转移和生存时间短密切相关。庞亮等[9]对肌肉浸润性膀胱癌AK4的研究发现,AK4在癌组织中高表达率显著高于癌旁正常组织,AK4高表达率与远处转移和脉管内瘤栓有关,生存分析显示,AK4高表达患者生存时间短于低表达者。李辰运等[10]研究发现,AK4在胰腺癌组织中的表达高于癌旁组织,AK4的异常表达与肿瘤分期、淋巴结转移、神经受侵犯、脉管内瘤栓相关,而且生存分析也提示AK4高表达患者生存时间短。Xin等[11]应用免疫组织化学和分子生物学方法研究发现,AK4高表达不仅与膀胱癌的肿瘤分期、远处转移和血管侵犯有关,还与膀胱癌患者不良预后相关,体外实验研究显示,AK4可促进膀胱癌细胞系的生长、侵袭和转移。Zhang等[12]研究发现,AK4可促进HER2阳性乳腺癌的进展。这些研究结果表明,AK4可以通过多种机制促进多种类型癌细胞的侵袭转移。
AK4与肺癌的相关研究目前国外较少,而国内尚未见相关报道。Jan等[13]首先采用微阵列数据库研究发现,AK4在肺腺癌中表达明显高于正常肺组织,肺癌中AK4高表达与肿瘤分期晚、疾病复发及预后差有关,进一步分析显示,AK4是通过下调ATF3从而促进肺癌细胞的侵袭转移。由于AK4的基因位于线粒体基质中,可能涉及到代谢相关的基因,Jan等[3]进行的另一项研究结果发现,HIF-1α活性在具有AK4代谢基因特征的肺癌中被显著激活,AK4过度表达使代谢向有氧糖酵解方向转变,增加细胞内活性氧水平,从而稳定HIF-1α蛋白水平,并以HIF-1α依赖性方式促进肺癌细胞的上皮-间质转化。他们通过分析癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库中肺腺癌RNA序列数据发现,相比于其他AK的基因,AK4和AK1的基因高表达者肺腺癌患者的预后更差,采用shRNA降低AK4的表达可降低表皮生长因子受体(epidermal growth factor receptor,EGFR)的基因突变细胞中EGFR的蛋白表达[14]。这些研究中虽然发现AK4在肺腺癌中高表达,但在肺腺癌发生过程中是早期还是晚期事件尚不清楚。我们应用免疫组织化学方法分析了肺腺癌发生不同阶段病变中AK4表达的变化,结果显示从AAH到IA中,AK4表达均明显高于正常肺组织,进一步分析显示,随着病变从AAH到腺癌进展,AK4表达率趋于增高,但它们之间差异无统计学意义。本研究结果提示AK4可能参与了早期肺腺癌的发生,提示AK4检测可以作为肺腺癌诊断的一个早期生物标志物。
本研究对AK4高表达与肺腺癌临床病理学特征之间的关系进行了分析,结果显示,AK4高表达与肺腺癌淋巴结转移和pTNM分期密切相关,淋巴结转移阳性及高pTNM分期者的肺腺癌中AK4表达率明显增高,本研究也进一步证实了AK4表达可以促进肺腺癌的侵袭转移。AK4高表达与患者年龄、性别、吸烟状态、肿瘤部位和脉管侵犯无关。本研究发现,肿瘤最大径>3 cm和有胸膜侵犯者中AK4表达率高于肿瘤最大径≤3 cm和无胸膜侵犯者,但差异无统计学意义,可能与本组资料中>3 cm和有胸膜侵犯的肺癌病例数少有关,尚有待于后期进一步积累病例研究。肺腺癌具有高度的异质性,同一肺腺癌可含有多种形态学结构,我们以肺腺癌主要结构进行AK4表达分析,结果发现,AK4表达率在实体型和微乳头型腺癌中高于其他类型的腺癌,但差异无统计学意义,需要进一步扩大样本量明确其意义。然而实体型和微乳头型已被明确为具有侵袭性的组织学结构,因此,AK4表达肺腺癌在临床生物学行为上可能具有高度侵袭能力,需要给予积极处理。
目前研究已经证实肺腺癌可存在多个驱动基因改变,AK4与这些驱动基因改变是否存在相关性还不清楚。由于本组病例中仅有少数病例进行了肺癌驱动基因的检测,我们未能进行这方面的相关分析,待以后肺癌驱动基因检测的病例数足够再进行深入的研究。
总之,AK4高表达在肺腺癌早期病变AAH中已经开始出现,提示AK4可能在肺腺癌的早期发生阶段发挥作用,AK4检测可以作为早期肺腺癌诊断的一种生物标志物。AK4高表达与肺腺癌的脉管侵犯、淋巴结转移和pTNM分期密切相关,通过肺腺癌AK4的检测可以更好地评估肺腺癌的恶性程度及预后。

