晚期胃肠间质瘤药物治疗进展
上海交通大学医学院附属仁济医院胃肠外科,上海 200127
胃肠间质瘤(gastrointestinal stromal tumor,GIST)是胃肠道最常见的间叶源性肿瘤,可发生于胃肠道的任何部位,最常见于胃部(60%)和小肠(30%)[1]。GIST全球年发病率为1/10万~2/10万,中国发病率与全球基本一致。山西省胃肠道间质瘤流行病学调查数据显示,GIST发病率为0.43/10万[2],上海地区为2.11/10万[3],目前中国10个省份正在开展GIST发病率登记研究。
GIST主要起源于胃肠道有分化潜能的间质干细胞或Cajal细胞[4]。约90%的GIST是由编码干细胞生长因子受体(KIT或CD117)的c-kit或编码血小板衍生生长因子受体α的PDGFRA基因突变驱动,其中80%~85%的GIST患者存在c-kit基因突变,5%~10%存在PDGFRA基因突变[5];常见的突变位点有c-kit外显子9、11、13和17以及PDGFRA外显子12、14和18。少部分无c-kit或PDGFRA突变的患者称为野生型GIST,可源于其他少见类型的突变,如SDHX、NF1、RAS和BRAF等[6]。
免疫组织化学检测是诊断GIST的重要手段,GIST患者中CD117阳性率94%~98%,DOG1阳性率为94%~96%,CD117与DOG1具有高度一致性[7]。基因突变检测和分型对于诊断GIST、指导治疗、预测靶向药物疗效以及患者预后具有重要作用。
伊马替尼(imatinib)是针对GIST的c-kit/PDGFRA致癌突变开发的酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),将GIST的治疗引入靶向治疗的时代。十余年间约85%的晚期GIST患者从伊马替尼的治疗中获益,中位无进展生存期(median progression-free survival,mPFS)达20~24个月,中位总生存期(median overall survival,mOS)达5年[8]。外显子11突变是c-kit基因最常见的突变,KIT外显子11点突变和插入突变的患者预后较好,然而,KIT外显子11缺失突变的患者预后较差。此外,外显子9突变的患者接受伊马替尼治疗预后也较差,而PDGFRA基因外显子18 D842V突变对伊马替尼原发耐药[6]。一线伊马替尼治疗失败后,二线药物舒尼替尼(sunitinib)和三线药物瑞戈非尼(regorafenib)均因无进展生存期(progression-free survival,PFS)相对较短(5.6个月和4.8个月)、客观缓解率(objective response rate,ORR)相对较低(6.8%和4.5%)、总生存期(overall survival,OS)无获益或不良反应限制了其长期使用[9-10]。以c-kit或PDGFRA开关控制抑制剂瑞派替尼(ripretinib)为代表的新型广谱TKI成为晚期GIST新的治疗选择。
1 近二十年晚期GIST药物治疗现状
在伊马替尼问世之前,晚期GIST患者因对放化疗不敏感,通常预后较差,伊马替尼彻底改变了晚期GIST患者的治疗局面。通过竞争性抑制激酶的ATP结合区,伊马替尼可以有效地抑制BCRABL、KIT或PDGFRA基因的活性[11-12]。对于不可切除、转移或复发的晚期GIST患者,国内外指南均推荐伊马替尼作为一线治疗用药。然而,并非所有的GIST患者都对伊马替尼的治疗产生应答,400 mg伊马替尼治疗后的临床应答与c-kit或PDGFRA的基因突变类型有关(表1)[13],同时KIT或PDGFRA的ATP结合区或各种活化环突变可导致伊马替尼耐药。伊马替尼治疗后2年内,约50%的GIST患者出现继发耐药,约4%的患者对伊马替尼不耐受[14]。
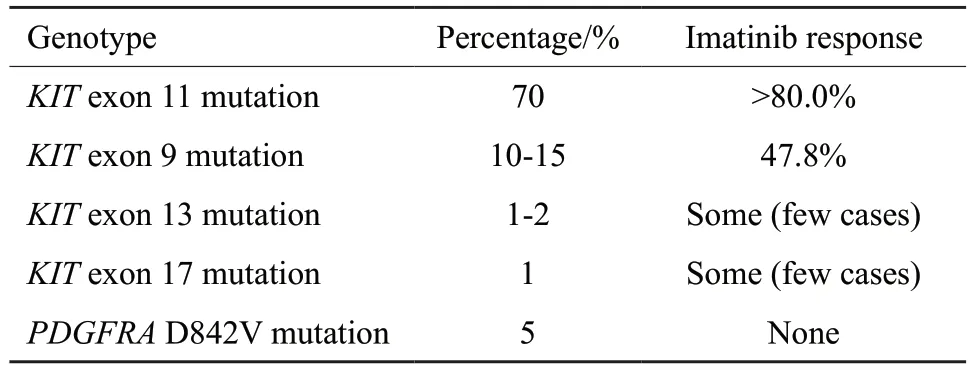
表1 接受400 mg/d伊马替尼治疗后晚期GIST患者的临床应答与基因突变类型的相关性Tab.1 The association between clinical response and type of gene mutation in patients with advanced GIST receiving 400 mg/d imatinib
针对伊马替尼耐药或不耐受的晚期GIST患者开展的多中心、随机、双盲和安慰剂对照的Ⅲ期临床研究[9]显示,多靶点TKI药物舒尼替尼和安慰剂的mPFS分别为24.1周vs6.0周(HR=0.33;95% CI:0.24~0.47;P<0.0001),ORR分别为6.8%vs0.0%(95% CI:3.7%~11.1%;P=0.006)。基于此研究,舒尼替尼被批准用于伊马替尼治疗失败或不耐受的晚期GIST患者。在该研究最初设定的OS最终分析中,舒尼替尼组的mOS为72.7周,安慰剂组为64.9周,两组mOS差异无统计学意义(HR=0.876;95% CI:0.679~1.129)。在后续的研究[15]中发现,长期暴露于舒尼替尼可使激酶活化环出现新的突变,常见于KIT外显子17(如D816H和Y823D),从而导致舒尼替尼耐药。
针对伊马替尼和舒尼替尼治疗进展的转移和(或)不可切除的GIST患者开展的多中心、随机、双盲和安慰剂对照的Ⅲ期研究(GRID研究)[10]显示,瑞戈非尼组和安慰剂组的mPFS分别为4.8个月和0.9个月(HR=0.27;95% CI:0.19~0.39;P<0.0001),ORR分别为4.5%vs1.5%,而两组mOS差异无统计学意义(HR=0.77;95% CI:0.42~1.14;P=0.199)。与瑞戈非尼相关的常见≥3级不良事件有高血压(23.5%)和手足皮肤反应(19.7%)。瑞戈非尼组较安慰剂组进行剂量调整的频次更高(72%vs26%)。
c-kit继发突变是导致TKI耐药的主要原因,且大多数患者体内存在多个突变,TKI抑制剂仅能抑制部分突变,其他耐药突变会使肿瘤继续生长,这也是二线舒尼替尼和三线瑞戈非尼PFS相对较短、ORR相对较低和OS无获益的原因所在。同时,与舒尼替尼和瑞戈非尼相关的减量或停止治疗发生率较高,影响其长期使用和患者疗效。
2 新药研究进展
2.1 新型TKI
2.1.1 瑞派替尼
与ATP竞争性结合药物有所不同,瑞派替尼是一种新型的广谱酪氨酸激酶开关控制抑制剂,对发生在ATP结合区和活化环的两种突变均具有活性,可广泛、有效地抑制GIST中已知的KIT6个外显子的激活突变,并且还可抑制PDGFRA中外显子12、14和18的突变[16]。
瑞派替尼Ⅰ期研究[17]招募了美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分标准评分为0~2分且携带c-kit或PDGFRA突变的难治性GIST患者184例,其中142例GIST患者被分配接受150 mg qd瑞派替尼治疗,包括剂量递增期12例和剂量扩展期130例。其中二线治疗31例(21.8%)、三线治疗28例(19.7%)和≥四线治疗83例(58.5%)。接受二线、三线和≥四线治疗患者的mPFS分别为10.7、8.3和5.5个月,12个月PFS率分别为33.5%、29.2%和21.2%,ORR分别为19.4%(n=6/31)、14.3%(n=4/28)和7.2%(n=6/83)。不良反应总体较轻,大多为1~2级,易于控制。因不良事件而减量的患者有26例(18.3%),暂停用药的患者有77例(54.2%)。仅8例(5.6%)患者因药物相关不良事件而终止研究治疗。2020年9月欧洲临床肿瘤学会(European Society for Medical Oncology,ESMO)年会上更新了GIST患者疾病进展后瑞派替尼剂量递增(IPDE)研究[18]结果,数据截至2020年5月8日,原二线、三线和≥四线治疗患者分别有10例、17例和40例进入IPDE研究。接受瑞派替尼150 mg qd治疗获得的第1个周期PFS(PFS1)分别为11.0、8.3和5.5个月,疾病进展后接受瑞派替尼150 mg bid治疗获得的第2个周期PFS(PFS2)分别为5.6、3.3和4.6个月。剂量增加后的PFS获益与疾病进展前原剂量治疗的PFS获益之比分别为51%、40%和84%。可见无论是接受瑞派替尼作为二线、三线还是≥四线治疗的患者,疾病进展后都可以从增加瑞派替尼剂量的治疗中取得进一步有意义的PFS获益。由于Ⅰ期临床结果令人鼓舞,随后开展了两项Ⅲ期研究。其中,INVICTUS研究(NCT03353753)[19]纳入了129例进展中的≥四线的晚期GIST患者,按照2∶1的方式随机分为两组,分别接受150 mg qd瑞派替尼或安慰剂治疗。结果显示,瑞派替尼组和安慰剂组的mPFS分别为6.3个月和1.0个月(HR=0.15,P<0.0001)。瑞派替尼组和安慰剂组的mOS分别为15.1和6.6个月(HR=0.36,P=0.0004)。瑞派替尼最常见的3级或4级治疗相关不良事件包括脂肪酶升高(5%)、高血压(4%)、疲劳(2%)和低磷血症(2%),而安慰剂组最常见的3级或4级治疗相关不良事件包括贫血(7%)、疲劳(2%)、腹泻(2%)、食欲下降(2%)、脱水(2%)、高钾血症(2%)、急性肾损伤(2%)和肺水肿(2%);两组总体安全性相当。基于此研究结果,2020年5月,美国食品药品管理局(Food and Drug Administration,FDA)批准瑞派替尼用于治疗经包括伊马替尼在内的3种TKI治疗失败的晚期GIST患者,瑞派替尼成为晚期GIST患者的首个标准四线治疗药物。2020年9月ESMO会议更新了INVICTUS研究的进一步随访结果[20],其中安慰剂组患者疾病进展后可交叉至瑞派替尼150 mg qd组,所有接受150 mg qd治疗患者疾病进展后可接受150 mg bid治疗,数据截至2020年3月9日。对于主要研究终点PFS,瑞派替尼组患者mPFS为6.3个月,安慰剂组为1.0个月(HR=0.16),与前期结果基本一致。同时更新数据还显示,不同亚组患者都可以从瑞派替尼治疗中取得PFS获益。对于次要研究终点OS,瑞派替尼组患者mOS尚未达到,安慰剂组mOS为6.3个月(HR=0.42)。与前期随访结果中瑞派替尼组mOS 15.1个月相比,此次OS数据延长(至随访截止日期仍未达到)。安全性方面,延长随访中瑞派替尼治疗组新增不良事件或因新的不良事件导致剂量调整或患者死亡事件都极少见,与前期发表数据基本一致。在2020年结缔组织肿瘤学会(Connective Tissue Oncology Society,CTOS)年会上,INVICTUS研究[21]数据再次更新,显示瑞派替尼对所有突变都有效,验证了瑞派替尼对KIT/PDGFRA突变激酶的广谱抑制作用。此外,比较瑞派替尼和舒尼替尼二线治疗GIST患者的另一项Ⅲ期INTRIGUE研究(NCT03673501)[22]正在开展中,计划招募358例晚期GIST患者,预计将于2021年6月完成。如果结果为阳性,将重塑当前疗法,有望改变未来晚期GIST整体治疗格局。
2.1.2 阿伐替尼
阿伐替尼(avapritinib)是针对PDGFRAD842V突变具有高度选择性的Ⅰ型抑制剂。Ⅰ期研究(NAVIGATOR)[23]纳入56例D842V突变的GIST患者。针对存在PDGFRAD842V突变的晚期GIST患者,阿伐替尼在几乎所有情况下(98%)可使肿瘤缩小,ORR为84%。5例(9%)完全缓解(complete response,CR),44例(79%)部分缓解(partial response,PR)。3级或4级治疗相关不良事件发生率为57%。有40%的患者出现认知相关不良事件,包括记忆障碍(30%)、认知障碍(10%)和思维混乱(9%)等。认知相关不良事件主要为1级(23%),有2%的患者因此停止治疗。鉴于已批准药物对PDGFRAD842V突变均无效果,该突破性疗法被大家期待已久。美国FDA依据Ⅰ期研究的数据于2020年1月批准了阿伐替尼用于治疗携带PDGFRA外显子18突变(包括D842V突变)的不可切除或转移性GIST。2020年9月ESMO更新了NAVIGATOR研究的进一步随访结果[24],数据截至2020年3月9日,中位随访时间为27.5个月,5例既往未接受过TKI治疗的患者服用阿伐替尼300/400 mg后,有2例达CR,3例达PR。阿伐替尼300/400 mg治疗的中位缓解持续时间(median duration of remission,mDOR)为22个月(95%CI:14~NR),mPFS为24个月(95% CI:18~NR),mOS未达到;在36个月时,阿伐替尼300/400 mg的PFS率和OS率估计为34%和71%。8例(21%)患者因治疗相关不良事件而终止治疗。剂量中断和(或)减量,是改善≥2级认知相关不良事件的有效方法,改善的中位时间是12 d。需要注意的是,D842V突变人群使用300/400 mg剂量后,认知相关不良事件发生率为63%,颅内出血发生率为5%,临床应用时应密切关注。
比较阿伐替尼和瑞戈非尼的Ⅲ期研究(VOYAGER)[25],共纳入二线或三线治疗后进展的晚期GIST患者476例,按1∶1随机分组。阿伐替尼组和瑞戈非尼组的mPFS分别为4.2和5.6个月,差异无统计学意义,研究未达到主要研究终点,使阿伐替尼拓展后线治疗适应证受阻。
2.1.3 Crenolanib
Crenolanib是一种高选择性PDGFRA和FLT3抑制剂,用于治疗PDGFRA外显子18(D842I、D842V或D842Y)突变的GIST患者,crenolanib被证明比伊马替尼更为有效,特别是在抑制PDGFRAD842V突变方面,其效力比伊马替尼强约135倍[26]。针对严重耐药的PDGFRAD842V突变GIST患者,crenolanib的临床获益率为31%。后续正在进行的Ⅲ期研究[27]旨在比较crenolanib(100 mg tid)与安慰剂用于PDGFRAD842V突变GIST患者的疗效和安全性,患者以2∶1随机分配,主要研究终点是PFS,并且不允许交叉。如果该结果呈现阳性,对于先前原发耐药的GIST将有阿伐替尼和crenolanib两种药物可以选择,为使患者获益最大化,两种药物的使用顺序该如何选择仍有待探讨。
2.1.4 其他TKI
马赛替尼(masitinib)是一种高选择性TKI,Ⅰ期临床研究中观察到对c-kit突变和野生型GIST有效[28]。一项Ⅱ期研究[29]使用舒尼替尼作为对照,评估伊马替尼治疗失败后的GIST患者接受马赛替尼二线治疗的疗效。与舒尼替尼相比,马赛替尼组患者的mOS明显更长,达到12.4个月(HR=0.27,P=0.016),马赛替尼组患者毒性及不良反应更小(52%vs91%),正在进行的Ⅲ期研究(NCT01694277)将进一步验证该结果。
阿昔替尼(axitinib)是一种抗血管生成药,靶向VEFGR1-3、KIT和PDGFRA,与帕唑帕尼(pazopanib)、索拉非尼(sorafenib)及舒尼替尼相比,其IC50值更低。在GIST原代细胞,针对密码子559或576相关c-kit原发突变和对伊马替尼耐药的T670I和V654A相关c-kit继发突变(ATP结合区),阿昔替尼比伊马替尼、舒尼替尼和瑞戈非尼活性更强[30]。
卡博替尼(cabozantinib)是一种靶向MET、VEGFR、RET、AXL、KIT和FLT3的新型TKI,在不同c-kit突变(外显子9、11和17)的GIST异种移植瘤模型中显示出活性[31]。一项在日本开展的Ⅰ期研究[32],共纳入4例对伊马替尼及舒尼替尼耐药的GIST患者,结果证实卡博替尼可使疾病稳定6~20个月。针对伊马替尼和舒尼替尼治疗后进展的GIST患者开展的Ⅱ期研究(CaboGIST)[33],共纳入50例患者接受卡博替尼治疗,58.8%的患者在12周时无进展,mPFS为5.5个月(95%CI:3.6~6.0),mOS为18.2个月(95% CI:14.3~22.3)。7例(14%)患者获得客观缓解。进一步分析发现,同时具有c-kit外显子11和17突变的患者获得客观缓解。广泛突变(包括c-kit外显子9、13和14突变)的患者有临床获益[PR或稳定(stable disease,SD)为最佳应答]。
帕纳替尼(ponatinib)是一种新型多靶点TKI,可抑制ABL、KIT、PDGFRA、VEGFR2、FGFR1和SRC等。临床前研究显示其对广泛的耐药突变具有较强的活性,包括816号密码子的活化环突变[34]。帕纳替尼Ⅱ期研究[35]共纳入45例严重耐药的GIST患者,接受45 mg帕纳替尼治疗。结果显示,KIT外显子11原发突变的患者在第10周时临床获益率达37%,其最明显的治疗相关不良事件是心血管事件。
达沙替尼(dasatinib)不仅是一种高效的BCR-ABL抑制剂,还可抑制各种KIT突变体。达沙替尼一线治疗GIST的Ⅱ期研究[36]共纳入42例初治GIST患者,平均随访67.2个月。第4周的PET/CT缓解率(CR和PR)为74%:14例CR、17例PR、6例SD、3例PD及2例无法评估。mPFS为13.6个月,mOS未达到。3级和4级不良反应发生率为53%,最常见的是胃肠道和肺部不良反应,有28例患者减量或中断治疗。
培唑帕尼(pazopanib)是一种多靶点血管生成抑制剂,Ⅱ期PAZOGIST研究[37]评估培唑帕尼用于对伊马替尼和舒尼替尼耐药或对其他疗法无效的GIST患者的疗效。培唑帕尼组4个月PFS率高于单纯最佳支持治疗(best supportive care,BSC)组(45%vs17%,P=0.029)。培唑帕尼组mPFS为3.4个月,单纯BSC组mPFS为2.3个月(HR=0.59,P=0.030)。
凡德他尼(vandetanib)是一种合成的苯胺喹唑啉化合物,可同时作用于肿瘤细胞EGFR、VEGFR和RET,还可选择性地抑制其他酪氨酸激酶及丝氨酸/苏氨酸激酶,多靶点联合阻断信号转导。一项凡德他尼治疗GIST的Ⅱ期临床研究[38]正在进行,共纳入9例野生型儿童和成人GIST患者,其结果即将公布。
法米替尼(famitinib)是一种靶向c-kit、VEGFR2、PDGFR、VEGFR3、FLT1和FLT3的受体酪氨酸激酶(receptor tyrosine kinase,RTK)抑制剂。一项正在进行的Ⅱ期临床研究[39],共纳入88例经伊马替尼治疗后出现进展的晚期或转移性GIST患者,目前结果还未公布。另一项法米替尼对比舒尼替尼的Ⅲ期临床研究[40]于2020年9月启动,预计招募304例伊马替尼治疗失败的晚期GIST患者。
AZD3229是一种有效的泛KIT突变体抑制剂,在异种移植瘤模型中显示出对KIT或PDGFRA的快速、广泛和持续性抑制,肿瘤消退率为60%~99%。临床前研究[41]已表明,与伊马替尼、舒尼替尼、瑞戈非尼、阿伐替尼及瑞派替尼相比,AZD3229在有效性和选择性方面更具优势。预计该药的临床开发将在未来几年进行,重点针对c-kit耐药性突变的GIST患者。
2.2 生物制剂
奥拉单抗是一种PDGFRA受体拮抗剂。最近公布了一项针对21例GIST患者(包括6例PDGFRAD842V突变)的Ⅱ期研究[42]结果,奥拉单抗的剂量为20 mg/kg,14 d为1个治疗周期。D842V突变队列的12周临床获益率为50%,而KIT突变队列为14.3%,mPFS分别为32周和6周。该研究样本量较小,而且仅是描述性的,也未观察到肿瘤缩小,需开展证据等级更高的研究进一步验证。
2.3 MEK抑制剂
单独的MEK抑制似乎对GIST无效,然而,KIT和MAPK双重抑制具有协同作用[43]。培西达替尼(pexidartinib)是一种靶向CSF1R、KIT和FLT3的抑制剂,比美替尼(binimetinib)则是一种MEK抑制剂,一项Ⅰ期剂量递增研究[44],纳入经伊马替尼治疗进展的晚期或转移性GIST患者2例,接受培西达替尼(早间400 mg和晚间200 mg)联合MEK抑制剂比美替尼(30 mg bid)治疗。结果显示,2例患者表现出疾病长期稳定:1例携带c-kit外显子11突变的GIST患者(先前接受过5种治疗)PFS和OS分别为6.1和14.6个月;1例携带NF-1突变的GIST患者PFS超过19个月,肿瘤负荷降低27%。NF-1突变的GIST患者单用MEK抑制剂能否实现长期稳定需后续进一步验证。
2.4 免疫检查点抑制剂
免疫浸润的特征可能会影响GIST 的预后[45],因而免疫疗法可能在GIST治疗中占有一席之地。针对经伊马替尼治疗后进展的GIST患者进行的一项Ⅱ期研究[46],随机接受纳武单抗或纳武单抗联合伊匹单抗治疗,联合治疗组(12例)中有1例患者(8.3%)达PR,2例(16.7%)达SD,而单用纳武单抗组(15例)中有7例(46.7%)达SD。单用纳武单抗组和联合治疗组的mPFS分别为8.57周和9.10周。两名携带c-kit外显子17突变的患者出现肿瘤缩小,提示这类患者可能受益于免疫治疗。
斯巴达珠单抗(spartalizumab)是一种人源化的IgG4抗程序性死亡[蛋白]-1(programmed death-1,PD-1)抗体,可阻断PD-1与程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)及PD-L2的结合。一项Ⅰ/Ⅱ期临床研究[47]评估斯巴达珠单抗联合伊马替尼用于TKI标准治疗失败的晚期GIST患者,目前尚未见结果报道。
阿维鲁单抗(avelumab)是一种完全人源化抗PD-L1的IgG1单克隆抗体。一项正在进行的Ⅰ/Ⅱ期临床研究[48]将阿维鲁单抗与瑞戈非尼联合用于实体瘤和GIST患者。另一项Ⅱ期临床研究[49]评价阿维鲁单抗联合阿昔替尼用于标准治疗失败后无法切除或出现转移的GIST患者,两项研究结果均还未公布。
2.5 TRK抑制剂
在野生型GIST中可以找到构成原肌球蛋白受体激酶(tropomyosin receptor kinase,TRK)的融合蛋白,且对TRK抑制剂拉罗替尼(larotrectinib)有应答[50],表明野生型GIST可能对高度选择性的TRK抑制剂敏感。一项I期研究[51]纳入3例GIST患者接受拉罗替尼治疗,最终这3例患者均PR。需进一步开展大样本研究验证该结果,并获得更详细的生存数据。
2.6 CDK抑制剂
瑞博西林(ribociclib)是一种高度特异性的CDK4和CDK6抑制剂。一项多中心、开放标签的Ⅰb期研究[52]评价瑞博西林和斯巴达珠单抗联合治疗晚期GIST患者,目前尚处于患者招募阶段。
3 GIST药物选择策略
GIST中KIT和PDGFRA突变体存在异质性,一项循环肿瘤DNA(circulating tumor DNA,ctDNA)动态监测GIST分子异质性的研究[53]表明,未经药物治疗的患者中36%存在肿瘤特异性突变,经TKI治疗的患者中50%存在肿瘤特异性突变。1例经伊马替尼治疗出现疾病进展患者的ctDNA分析表明多个耐药突变会同步存在。此外,长期暴露于TKI引起的继发耐药也是GIST治疗的重要挑战。越来越多的证据表明,每个TKI都有自己的耐药特性。解决上述问题的潜在策略是选择广谱的KIT/PDGFRA抑制剂或者联合使用TKI,尽可能减少耐药的发生,联合使用时则要考虑各种TKI引起的不良反应。
3.1 广谱KIT/PDGFRA抑制剂
随着瑞派替尼的上市,以舒尼替尼和瑞戈非尼为代表的二线和三线治疗已发生根本性转变。瑞派替尼作用于开关口袋,在c-kit突变肥大细胞模型中显示出对体外各种抗药性突变具有更广泛的抑制作用。比较瑞派替尼与舒尼替尼的Ⅲ期INTRIGUE试验[22]正在进行,作为里程碑的临床研究,将重塑晚期GIST的治疗格局。另一种新型泛KIT突变体抑制剂AZD3229在临床前研究中也表现出普遍的活性。
3.2 TKI与其他药物联合使用
临床前研究已提示,伊马替尼联合PI3K抑制剂比伊马替尼单药治疗活性更强,可使肿瘤体积显著缩小。因此,一项Ⅰ期研究[54]拟验证PI3K抑制剂buparlisib联合伊马替尼治疗的有效性和安全性。该研究共纳入伊马替尼和舒尼替尼治疗失败的GIST患者60例,包括剂量递增组25例和剂量扩展组35例。未观察到PR或CR。在扩展期,估计mPFS为3.5个月。98.3%的患者发生治疗相关不良事件,其中45.0%为3级或4级不良事件。总体而言,两者联合临床获益不明显。
鉴于免疫浸润对GIST预后会产生影响,TKI联合免疫检查点抑制剂的研究也在进行中。一项Ⅰb期研究[55]评估了达沙替尼联合伊匹木单抗用于20例难治性GIST患者,结果显示mPFS为2.8个月。按照实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)评估,无患者客观缓解;但按照Choi标准,13例可评估的患者中有7例PR。总体结果可能与达沙替尼本身对KIT的抑制作用较强有关。
双重抑制KIT和MAPK通路在临床前GIST模型中已显示出协同抗肿瘤活性。后续开展的一项为期28 d的Ⅱ期研究[56],纳入初治的晚期GIST患者39例,接受伊马替尼(400 mg qd)联合MEK抑制剂比美替尼(30 mg bid)治疗。38例可评估患者中26例达到PR,最佳ORR为68.4%。3/4级毒性反应包括磷酸肌酸激酶升高(无症状,61%)、中性粒细胞减少(11%)、斑丘疹(8%)和贫血(8%),没有观察到其他的不良反应。
3.3 TKI的安全性
几种TKI关键研究的安全性数据已汇总(表2)。其中,Ⅲ期研究报道使用舒尼替尼发生血液学相关不良事件较安慰剂明显,主要通过减量、中断治疗和标准支持疗法处理相关不良反应。总体上舒尼替尼组和安慰剂组分别有9%和8%的患者因不良反应而停止治疗。瑞戈非尼Ⅲ期研究显示最常见的3级或更高治疗相关不良事件是高血压、手足综合征和腹泻。瑞戈非尼组有72%的患者因不良反应而调整剂量,而安慰剂组仅26%。阿伐替尼Ⅰ期研究报道最常见的3~4级治疗相关不良事件为贫血(17%)。特殊不良事件主要是认知相关不良事件,包括记忆障碍(30%)、认知障碍(10%)、思维混乱(9%)、精神障碍(4%)、谵妄(3%)和精神失调症(3%)。不良事件导致84%的减量或中断治疗,有18%的患者因不良事件而停药。瑞派替尼Ⅲ期研究结果表明,3级或4级治疗相关不良事件发生率较低,瑞派替尼组和安慰剂组因不良事件导致减量的患者分别为8.2%和2.3%,因不良事件而停药的患者分别为26%和21%。总体上看,与其他TKI相比,瑞派替尼因治疗相关不良事件减量或停药的比例似乎更低。
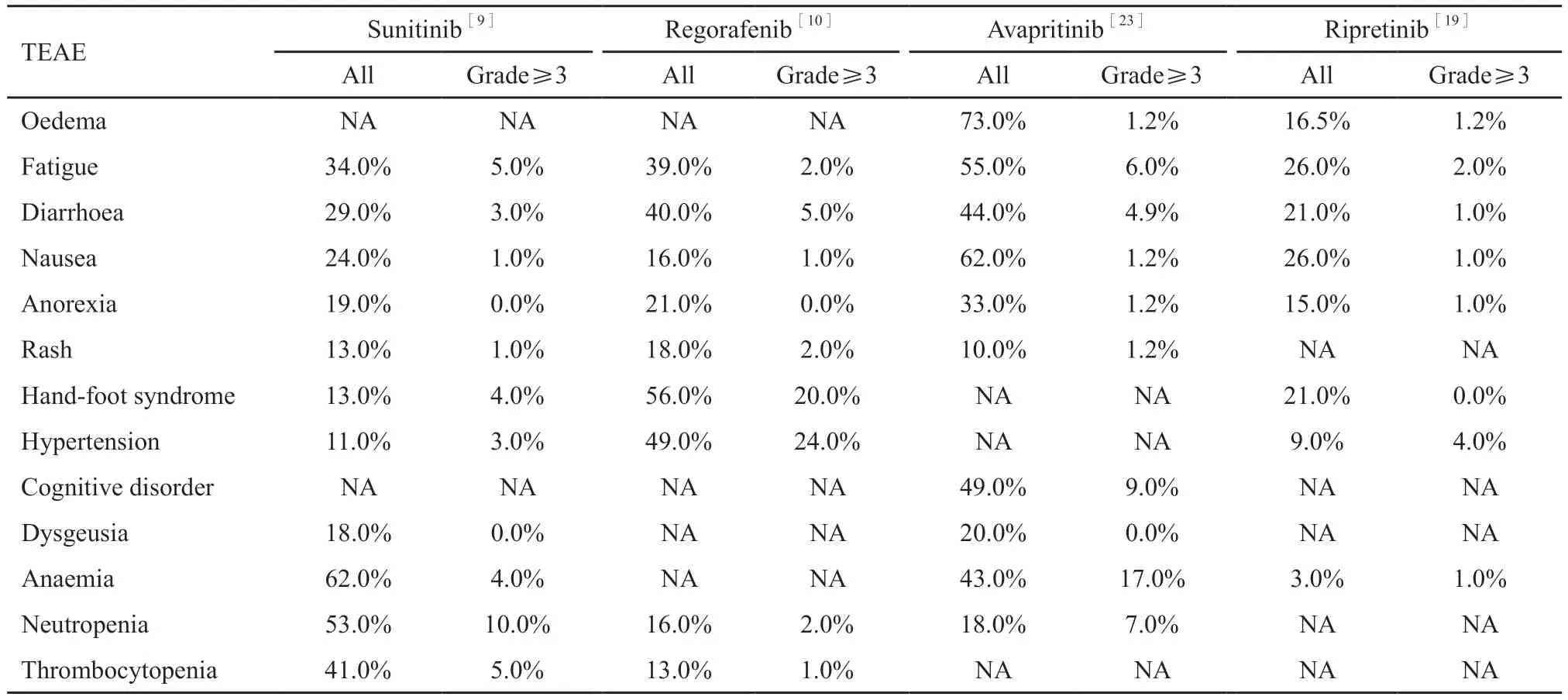
表2 关键研究中治疗相关不良事件汇总Tab.2 Summary of treatment emergent adverse events (TEAE) in key studies
一项meta分析[57]纳入瑞戈非尼治疗结直肠癌和GIST的28项研究,共涉及305例GIST患者和2815例转移性结直肠癌患者。与65岁以上患者相比,65岁以下患者发生不良事件更常见(71.3%vs27.6%,P=0.001)。不良事件的发生与160 mg剂量之间存在显著相关性(r=0.967)。常用应对策略包括减量(41.0%)、间断停药(66.7%)和完全停药(19.0%)。大约57%的患者在降低初始剂量后可恢复。考虑到安全性因素,对于GIST患者,非标准剂量瑞戈非尼(120 mg)可能是更好的选择。
4 GIST靶向治疗展望
c-kit和PDGFRA激活突变的发现以及TKI的引入彻底改变了GIST的治疗策略,开辟了GIST靶向治疗的新时代。随着特异性和高选择性TKI阿伐替尼获批,之前原发耐药的PDGFRAD842V突变GIST患者有了标准的治疗。随着晚期GIST患者接受伊马替尼、舒尼替尼和瑞戈替尼治疗后出现继发耐药的情况日益增多,瑞派替尼作为广谱KIT/PDGFRA抑制剂的代表,四线治疗GIST已经显示出强大的治疗效力,且安全性似乎比其他TKI更好,发生减量和停药的比例更低。可以预见的是,瑞派替尼在早期治疗中可能更有效,与舒尼替尼头对头比较用于伊马替尼治疗失败GIST患者的Ⅲ期研究正在进行,如为阳性结果将可能改变晚期GIST的治疗格局。
野生型GIST属于独特的临床和分子亚型,目前批准的TKI治疗效果并不确切。RAS/MAPK激活和NTRK融合基因等通路是该亚型GIST的潜在靶点,未来需要更多临床研究来阐明。为了对抗耐药问题,科学家们正在不断寻找具有其他作用机制或联合疗法的替代药物,例如MEK抑制剂、免疫疗法和TRK靶向疗法等,尽量在不增加毒性的情况下避免耐药的发生。最后,分子检测的应用和对生物标志物的探索,将有助于寻找可能受益于不同疗法的GIST患者,树立个性化精准治疗典范。

