Ku86通过调控TOP1和COPS5影响上皮性卵巢癌细胞对于顺铂的化疗敏感性
马 倩,刘懿萱,开今言,郭 林,卢仁泉
1.复旦大学附属肿瘤医院检验科,复旦大学上海医学院肿瘤学系,上海 200032;2.西安交通大学第一附属医院检验科,陕西 西安 710000
卵巢癌是女性第5常见的癌症[1]。在全球范围内,它是妇科肿瘤中死亡率排名第1的恶性肿瘤,每年约有239000例新诊断病例,每年有150000例死亡[2]。人类卵巢癌的标准治疗方法包括手术与铂类药物(如卡铂或顺铂)联合化疗。然而,尽管对铂类药物化疗起始有效,多数晚期卵巢癌患者在单药治疗后仍会复发,并具有致命的后果[3]。对卵巢癌而言,疾病的分型至关重要[4-5]。卵巢癌有两种主要的亚型,由组织来源决定,分为上皮性和非上皮性。上皮性卵巢癌是最常见的亚型,其特征是基因组不稳定和对铂类化学疗法的敏感性[6]。
DNA修复的主要途径有5种:错配修复(mismatch repair,MMR)、碱基切除修复(base excision repair,BER)、核苷酸切除修复(nucleotide excision repair,NER)、同源重组(homologous recombination,HR)和非同源末端连接修复(non-homologous end joining,NHEJ)[7]。这些不同途径之间的协同作用导致DNA修复和细胞存活。低水平的修复可能导致多种病理学变化,包括肿瘤的发生和对药物耐药性的产生[8-9]。Ku86,也称为Ku80或X线修复交叉互补蛋白5(X-ray repair cross complementing 5,XRCC5),与Ku70一起形成二聚体复合物,并通过非同源末端连接修复DNA双链损伤(DNA double-strand break,DSB)[10]。Ku86参与人体的许多重要生理过程,目前对哺乳动物细胞NHEJ的研究已应用于肿瘤治疗[10]。但是,关于Ku86在药物敏感性方面的研究仍然很少。因此,本项目旨在研究Ku86在上皮性卵巢癌药物敏感性中的作用,并探讨Ku86与相关分子之间的关系。
1 材料和方法
1.1 组织样本
卵巢癌组织和正常组织取自于2014—2016年在复旦大学附属肿瘤医院妇科的原发性卵巢癌患者,患者通过病理学检查确诊。本研究得到复旦大学附属肿瘤医院伦理委员会的批准(证书编号:050432-4-1212B),所有患者均签署知情同意书。
1.2 免疫组织化学检测
免疫组织化学分析使用抗Ku86 鼠抗体(sc-5280,美国Santa Cruz公司),并用PBS以1∶50稀释。如前所述进行免疫组织化学法(immunohistochemistry,IHC)染色[11]。
1.3 细胞培养
在含有10%胎牛血清和1%青霉素-链霉素的RPMI-1640培养基中培养A2780和HO8910细胞系。将HEK-293T细胞在含有10%胎牛血清和1%青霉素-链霉素的DMEM中培养。所有细胞系均在37 ℃培养箱中于CO2体积分数为5%的条件下培养。上述试剂均购自美国Gibco公司。
1.4 顺铂处理细胞
将细胞以3×105个细胞/孔的密度接种在6孔板中。将顺铂(2CL)添加到A2780和HO8910细胞培养液中,并以无顺铂的孔作为对照,将细胞培养24 h。
1.5 建立Ku86或COP9信号复合体的第5种成分(the fifth component of the COP9 signalosome,COPS5)敲低的细胞模型
短发夹RNA(short hairpin RNA,shRNA)是使用制造商的RNAi Designer程序设计的,其序列如表1所示。将shRNA克隆到pLKO.1-puro双酶切质粒(Age1和EcoR5)(美国Addgene公司)中,以产生重组质粒。使用LipofectamineTM2000转染试剂(美国Invitrogen公司)将重组质粒,包装质粒psPAX2和包膜载体pMD2.G(美国Addgene公司)转染到HEK-293T细胞中。48 h后,收集病毒上清液,并使用浓度为8 μg/mL的聚乙烯(美国Sigma-Aldrich公司)将其转移至卵巢癌细胞系中24 h。使用2 mg/mL嘌呤霉素(美国Sigma-Aldrich公司)筛选稳定转染的细胞7 d。并通过蛋白质印迹法(Western blot)检测验证敲低效率。
1.6 实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)
操作步骤和方法请参见参考文献[11]。RTFQ-PCR中使用的特异性引物列于表2。
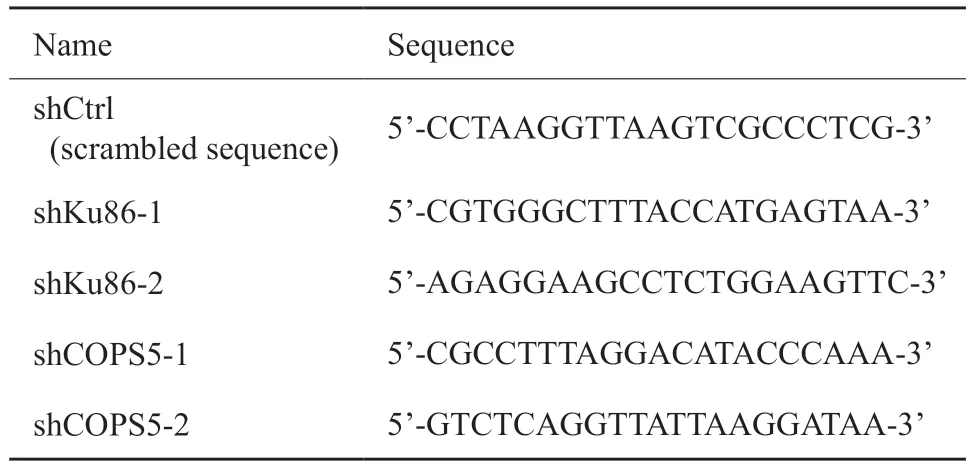
表1 用于转染的shRNA序列Tab.1 Sequence of shRNA for transfection
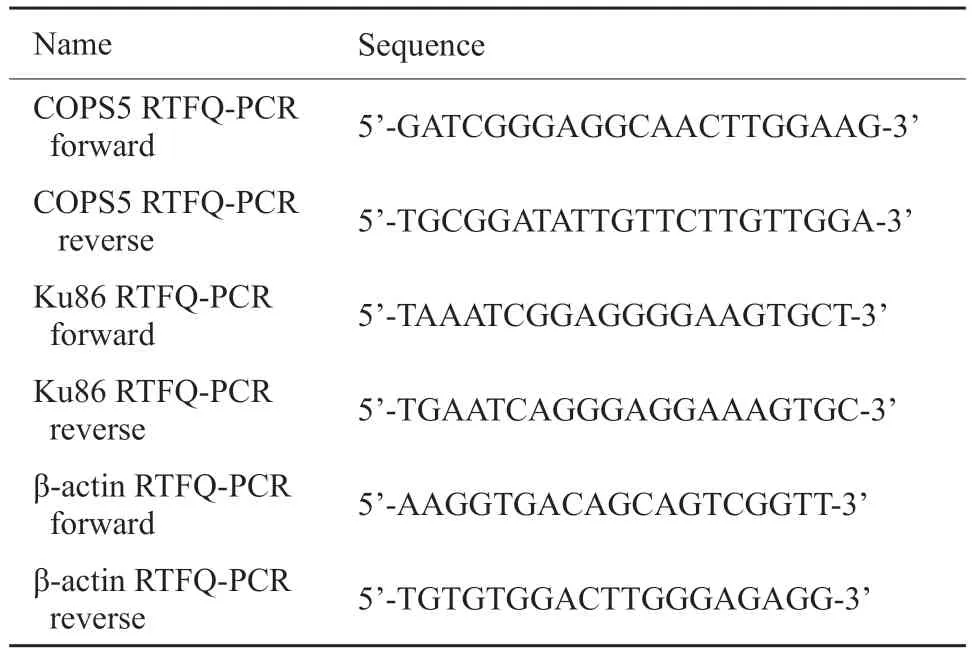
表2 RTFQ-PCR的引物序列Tab.2 Primer sequences for RTFQ-PCR
1.7 Western blot检测
Western blot的具体操作方法参见参考文献[11]。用于检测的抗体为:Ku 86(sc-5280,浓度1∶500,美国Santa Cruz公司),TOP1(ab121681,浓度1∶3000,美国Abcam公司),COPS5(浓度1∶1000,英国Bethyl公司),β-actin(60008-1-lg,浓度1∶3000,武汉三鹰生物技术有限公司)。蛋白质条带的密度通过Image J软件(美国国立医学图书馆)定量。
1.8 细胞凋亡检测
收获细胞并重悬于0.5mL结合缓冲液中,然后与AnnexinV/PI 双重染色剂(B D Biosciences)一起温育15 min,最后通过流式细胞仪测定。
1.9 IC50检测
将细胞接种到96孔板中,并用不同浓度的顺铂(0~64 μg/mL)处理48 h。之后向每个孔中加入CCK-8试剂(日本同仁化学研究所),并在37 ℃温育2 h。用酶标仪在450 nm处检测吸光度(D)值。使用以下公式确定细胞存活率:(D实验-D背景)/(D未经处理-D背景)/100%。使用非线性回归计算与未处理的对照组相比存活的细胞降低了50%时顺铂的IC50值(GraphPad Prism v3.0)。
1.10 细胞免疫荧光检测
细胞在24孔板里的盖玻片上生长,用预冷的PBS洗涤,在室温下用4.0%多聚甲醛固定10 min,然后在0.5%Triton X-100上破膜15 min。用牛血清白蛋白(bovine serum albumin,BSA)封闭1 h后,将样品与所需的第一抗体在4 ℃温育过夜。洗涤后,将样品与1∶5000稀释的二抗(Alexa Fluor 488和594,美国Life Technologies公司)在室温下于黑暗中温育45 min。洗涤后,将样品用含有DAPI(美国Invitrogen公司)的Prolong Gold防褪色试剂固定。使用多光子共聚焦显微镜系统(德国LAS-AF-Lite公司)捕获图像。
1.11 统计学处理
使用SPSS 20.0软件进行统计分析。通过方差分析(ANOVA)和Studentt检验来检验组之间的差异。P<0.05为差异有统计学意义。
2 结果
2.1 Ku86在细胞内的表达部位及相关水平
首先在卵巢癌细胞中对Ku86进行定位。应用细胞免疫荧光技术在上皮性卵巢癌细胞系A2780中对Ku86进行定位。用DAPI对细胞核进行定位后发现,Ku86主要在细胞核内的细胞核膜上表达(图1A)。使用IHC对来自于患者的癌和癌旁组织进行染色后发现,Ku86在细胞核内表达较多,并且与正常卵巢组织相比,Ku86在卵巢癌组织中的表达较高(图1B)。以上结果说明Ku86在细胞内存在于细胞核上,并且可能影响细胞核内相关的生物学效应。
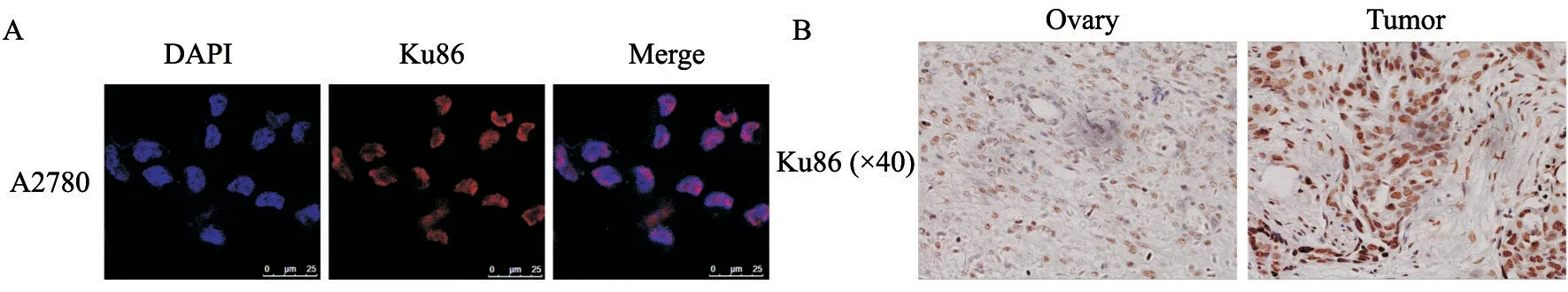
图1 Ku86在卵巢癌细胞内主要定位于细胞核Fig.1 Ku86 was mainly localized in the nucleus in ovarian cancer cells
2.2 Ku86与TOP1在卵巢癌铂类药物敏感性中的关系
Ku 86 是DNA 依赖性蛋白激酶(DNAdependent protein kinase,DNA-PK)的调节亚基。拓扑异构酶Ⅰ(topoisomerase Ⅰ,TOP1)也是一种细胞核酶,可在DNA复制和转录过程中催化超螺旋DNA的松弛[12]。TOP1与药物敏感性的研究成果已在临床上应用[13]。因此,接下来我们研究了Ku86与TOP1的关系,通过Oncomine(https://www.oncomine.org/)数据库对相关数据进行分析。结果显示,与对顺铂敏感的细胞相比,Ku86和TOP1的mRNA水平在对顺铂不敏感的细胞中都较低(图2A)。为了探讨Ku86和TOP1对于顺铂的敏感性,我们用不同浓度的顺铂处理A2780后,检测了蛋白表达水平的变化。结果显示,随着药物浓度的增高,TOP1的蛋白表达明显下调,而Ku86变化则不明显(图2B)。为了进一步研究Ku86与TOP1在卵巢癌药物敏感性中的关系,我们通过Gepia(gepia.cancer-pku.cn/)分析了Ku86和TOP1在卵巢癌中的表达相关性。结果显示,随着Ku86 mRNA水平的上升,TOP1的mRNA水平也增高,呈现一种正相关的趋势(图2C)。接下来我们使用RANi技术在A2780细胞系将Ku86敲低。结果显示,与对照组相比,下调Ku86后TOP1表达明显上调(图2D)。Ku86与TOP1同为存在于细胞核上的两种重要核酶,因此当下调Ku86时,TOP1可能补偿性升高。提示Ku86与TOP1存在明显的相关性,推测Ku86与TOP1是一种竞争的关系。
2.3 Ku86和COPS5在卵巢癌中的关系
COPS5通过调节DNA损伤修复途径在细胞对顺铂的反应中起重要作用。我们之前的研究发现,COPS5参与卵巢癌的发生、发展过程,近期也有文献[14]表明,COPS5与卵巢癌的药物敏感性有关。那么Ku86与COPS5的关系又如何呢?我们将Ku86敲低后检测COPS5的变化,无论是在A2780还是HO8910细胞系中,与对照组相比,当Ku86的mRNA水平下调时,COPS5的mRNA水平也明显下调(图3A~B)。在蛋白水平进一步验证结果,发现下调Ku86会导致COPS5的蛋白表达减少。而将COPS5敲低时,Ku86的蛋白表达水平不受影响(图3C~D)。这些结果说明,Ku86会影响到COPS5,而COPS5不会影响到Ku86。进一步查看Ku86和TOP1在卵巢癌中的表达相关性,结果显示,当Ku86表达较高时,COPS5的表达也较高(图3E)。接下来我们通过Gepia探索了COPS5高表达和低表达时对卵巢癌患者生存情况的影响。结果显示,在前60个月,COPS5的高表达与低表达对患者的生存状态不产生明显影响。但是60个月后,高表达COPS5的患者组与低表达COPS5的患者组相比表现出较好的生存情况(图3F)。
2.4 顺铂处理后,下调Ku86使细胞凋亡减少
引发凋亡是铂类药物发挥抗癌作用的重要环节[14]。为了探究Ku86对顺铂药物敏感性的影响,我们接下来检测了在药物作用下细胞的凋亡情况。加入2 μg/mL的顺铂处理细胞48 h后,使用流式细胞术对细胞凋亡情况进行检测。结果显示,在A2780和HO8910细胞系中,与对照组相比,下调了Ku86的实验组细胞凋亡程度较少(图4A)。我们进一步检测了各组细胞的IC50,结果显示Ku86下调组的细胞IC50值增加(图4B),说明下调Ku86降低了卵巢癌细胞对于顺铂的敏感性。简而言之,下调Ku86会使TOP1表达升高,TOP1的高表达又会使细胞的凋亡程度减少。当用顺铂处理卵巢癌细胞时,Ku86下调的细胞通过调控TOP1来使细胞的凋亡程度减少,使细胞对顺铂的敏感性降低。此外,下调Ku86也会使COPS5表达减少,但是如何通过调控COPS5来改变顺铂的敏感性仍有待研究(图4C)。这些结果提示我们针对于Ku86的靶向治疗可改变卵巢癌的顺铂敏感性。

图2 Ku86与TOP1在卵巢癌铂类药物敏感性中的关系Fig.2 The relationship between Ku86 and TOP1 in cisplatin sensitivity of ovarian cancer
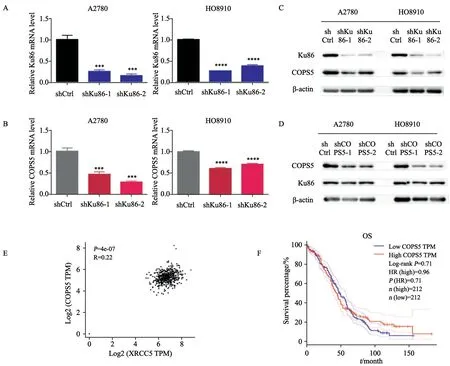
图3 Ku86与COPS5在卵巢癌中的关系Fig.3 Relationship between Ku86 and COPS5 in ovarian cancer
3 讨 论
Ku86通过参与NHEJ来修复DSB。异常的DNA损伤修复以及与之相关的细胞凋亡是铂类药物发挥作用的重要机制。但是,Ku86在铂类药物敏感性方面的作用与机制仍不清楚。本研究发现,下调Ku86后由顺铂导致的细胞凋亡减少,细胞的IC50值增高,说明低水平的Ku86使细胞对顺铂的作用不敏感。此外,本研究还发现,Ku86与TOP1和COPS5有显著的相关性,Ku86可通过影响这两个分子来调节药物敏感性。
异常的DNA修复是导致铂类药物敏感性降低的重要机制。TOP1通过释放转录或复制过程中产生的拓扑DNA应力在维持基因组完整性方面起着至关重要的作用[15]。喜树碱(camptothecin,CPT)是一类重要的抗癌药物,其发挥作用的机制主要是抑制TOP1[16]。已有研究报道,TOP1的抑制剂可以增加细胞凋亡率[17]。本研究发现,下调Ku86可导致TOP1表达明显增高,并且在顺铂作用后,下调Ku86的细胞凋亡率较低,这种现象可能是Ku86通过调控TOP1来完成的。

图4 Ku86的下调减少了顺铂诱导的细胞凋亡Fig.4 Down-regulation of Ku86 reduces cisplatin-induced apoptosis
顺铂的化疗抵抗一般是因为细胞具有较强的DNA损伤修复能力。Ku86与TOP1同为参与DNA损伤修复的分子,它们的存在能够有效修复受损断裂的DNA,维持基因组稳定性。加入顺铂处理会造成DNA双链断裂,Ku86能通过直接连接受损末端的方式进行DNA修复,理论上下调Ku86的细胞会因为DNA的损伤修复能力减弱而对顺铂更敏感。但实际上,由于下调Ku86会造成TOP1的补偿性升高,有文献[18-19]报道,TOP1可使DNA修复增加,从而使肿瘤细胞对DNA的损伤产生抵抗,使基因组趋向稳定,从而使细胞对顺铂不敏感。
COPS5最初被认为是c-Jun辅助激活剂,也被称为COP9信号复合体的第5种成分[20]。先前的研究表明,COPS5通过调节DNA损伤修复途径在细胞对顺铂的反应中起重要作用。最近,越来越多的证据[21-22]表明,COPS5在癌症进展中具有重要作用,包括DNA损伤反应和细胞凋亡。本研究发现,下调Ku86可以导致COPS5的蛋白质和mRNA水平下降。并且发现在卵巢癌疾病后期(60个月左右)COPS5的高表达对应较好的生存率。敲低Ku86会使细胞对顺铂的敏感性降低,这是否与Ku86调控COPS5有关仍有待研究。
综上,本研究发现,下调Ku86可以减少由顺铂引起的细胞凋亡,并且Ku86可以调控TOP1和COPS5,下调Ku86可使TOP1增多,使COPS5减少。Ku86、TOP1和COPS5都是参与DNA损伤修复的分子,而异常的DNA损伤修复是导致铂类耐药的重要机制。本文着重探讨了卵巢癌中与铂类药物敏感性有关的生物标志物之间的关系,提示针对Ku86的靶向治疗可能是提高铂类药物化疗敏感性的有效策略,未来有较好的应用前景。

