盐度胁迫对小黄鱼(Larimichthys polyactis)抗氧化酶、非特异性免疫酶和Na+/K+-ATP 酶活力的影响
王梦洁,储天琪,刘峰,詹炜,楼宝,徐万土
(1.浙江海洋大学 水产学院,浙江 舟山 316022;2.浙江省农业科学院水生生物研究所,浙江 杭州 310021;3.象山港湾水产苗种有限公司,浙江 宁波 315700)
1 引言
盐度是影响水生生物生长、存活的重要环境因子[1]。受到人为或自然因素的影响,养殖区域盐度会发生变化,对鱼体产生一定的渗透调节胁迫,从而使鱼体产生应激反应,这不仅会导致机体免疫力降低、渗透压调控机制紊乱等生理变化,甚至可能出现死亡[2−3]。鱼类通过引起非特异性免疫系统中抗氧化酶(超氧化物歧化酶、过氧化氢酶)活力的变化,来抵御盐度的胁迫[4]。例如在长期低盐或高盐度胁迫下,抗氧化酶可以清除体内由于应激反应产生的过多的氧自由基(ROS),减轻氧化性的损伤,增强机体免疫功能[5]。磷酸酶参与磷酸基团的转移和代谢,能够将代谢产物水解成磷酸和乙醇,其水解生成的小分子物质将会被排出体外,最终完成水生生物机体去磷酸化过程。因此,一定程度上,非特异性免疫酶活力变化可以作为反映不同盐度胁迫下鱼体适应能力和免疫机能的生理指标。通常认为鱼类存在一个等渗点,当盐度超出等渗点时多数广盐性鱼类会消耗能量来进行体内离子含量调节,以维持自身内部的水盐平衡来适应盐度大范围的变化[6],此为渗透压调节过程。Na+/K+-ATP 酶与渗透压调节密切相关,通过参与细胞内Na+、K+离子的主动跨膜转运,维持鱼体内外渗透压平衡,因此可作为衡量鱼类渗透压调节主要指标[6−7]。目前,研究人员已对大麻哈鱼(Oncorhynchus keta)[8]、克氏双锯鱼(Amphiprion clarkii)[7]、银鲳(Pampus argenteus)[9]、多鳍南极鱼(Notothenia neglecta)[10]等水产动物进行了盐度对其生理指标,包括抗氧化酶、非特异性免疫酶、Na+/K+-ATP 酶活力等的影响研究。对盐度胁迫下鱼体内生理变化开展研究,有助于了解盐度变化对鱼体生理的影响,同时也为养殖生产实践中改善水环境状况、提高养殖效益提供了指导。
小黄鱼(Larimichthys polyactis),隶属于鲈形目(Perciformes),石首鱼科(Sciaenidae),黄鱼属(Larimichthys),广泛分布于渤海、黄海、东海以及朝鲜半岛西岸地区,昼夜栖息于近底层,为暖温性近底层鱼类[11]。受到自然环境与人为因素的影响,野生小黄鱼资源利用程度明显锐减,现今所捕到的渔获物中以低龄为主[12]。因此,实施一系列保护和恢复渔业资源的项目,以此实现小黄鱼资源可持续利用就显得尤为重要[13−14]。随着小黄鱼人工规模化繁殖技术的突破[15],通过人工增殖放流的方式助力小黄鱼的资源恢复成为可能。同时以人工养殖品种代替捕捞小黄鱼满足消费者需求,可以极大程度降低小黄鱼的捕捞压力,促进小黄鱼种质资源的恢复。但在养殖过程中,夏季风暴雷雨频发以及干旱、水体富营养化等问题的出现,导致近岸海水盐度时有变化,对海水鱼类的养殖产生了很大的影响。因此养殖地区盐度条件是开展养殖必需要考虑的一个重要因素。
本研究中,以小黄鱼幼鱼为实验对象,在正常海水盐度为22.1 的养殖条件下,直接转入盐度为5 的低盐和盐度为34.5 的高盐条件下保持10 d,测定其肝脏中抗氧化酶(超氧化物歧化酶(Superoxide Dismutase,SOD)、过氧化氢酶(Catalase,CAT))、磷酸酶(酸性磷酸酶(Acid Phosphatase,ACP)、碱性磷酸酶(Alkaline Phosphatase,AKP))以及鳃、肾组织中Na+/K+-ATP 酶的活力水平,探讨盐度变化对肝脏中抗氧化酶、磷酸酶以及肾脏和鳃中的Na+/K+-ATP 酶活力的影响,阐明肝脏、肾脏和鳃在盐度适应过程中发挥的作用,以期为开展人工海水养殖的水体盐度调节、半咸水或淡化养殖提供理论依据,从而达到高效生产的目的。
2 材料与方法
2.1 实验材料及实验设计
实验鱼取自象山港湾水产苗种有限公司人工繁育的小黄鱼群体,选取规格整齐,体质健壮个体(体长为(11.8±0.9)cm;体质量为(12.6±3.1)g),进行实验。实验开始前,实验鱼在2 500 L 的实验桶中暂养7 d,养殖用水为经黑暗沉淀、砂滤后的自然海水,温度为(29.6±1)℃,盐度为22.1,投喂鱼宝稚鱼3 号(粒径为3 mm)颗粒饲料,每天7:00 和16:00 进行2 次饱食投喂,投喂后半小时进行换水排污处理。通过预实验确定低盐和高盐胁迫所用盐度。实验设置3 个盐度,分别为低盐组(盐度为5.0±0.3)、对照组(盐度为22.1)和高盐组(盐度为34.5±0.4),每组设置3 个平行实验。低盐组通过添加曝气后的淡水调配而成;高盐组通过添加商品化海水晶调配而成。实验开始前一天停止投喂饲料,将暂养后的实验鱼转入调好盐度的300 L 实验桶中,每桶实验鱼40 尾。实验期间,停止投喂饵料。
2.2 样品的采集及酶活力的测定
实验鱼在盐度处理10 d 后,每个平行随机取样5 尾,置于冰盘上冰冻处死后解剖,取肝脏、鳃和肾脏放入离心管中,液氮速冻后,置于−80℃保存。肝组织用于检测非特异性免疫酶活力,包括SOD、CAT、ACP 和AKP,鳃和肾组织测定Na+/K+-ATP 酶活力。准确称取0.2 g 组织重量,按重量体积比加入9 倍体积的生理盐水制成10% 的组织匀浆,2 500 r/min,离心10 min,取上清再用生理盐水稀释至测定所需浓度。蛋白含量的测定采用考马斯亮蓝法[2],SOD 和CAT 的测定分别采用羟胺法、钼酸铵法[16],ACP 和AKP 的测定采用金氏法[16];Na+/K+-ATP 酶的测定采用定磷法[17]。所有组织中的蛋白含量和酶活力的测定均采用南京建成公司检测试剂盒,按照操作说明完成。
2.3 数据处理与分析
实验结果均用平均值±标准差(mean±SD)表示,利用SPSS 19.0 软件对数据进行正态性分布与方差齐性检验后进行单因素方差分析(One-way ANOVA)、多重比较(Tukey)以及双独立样本检验(Mann-Whitney U)。p<0.05 为存在显著性差异。
3 结果
3.1 小黄鱼存活率
对小黄鱼的盐度耐受范围进行预实验,表1 为不同盐度急性胁迫下24 h 内小黄鱼的存活情况。从表中可以看出,急性胁迫盐度为3.9 时,小黄鱼24 h 内存活率为(71.0±2.57)%,10 d 内存活率为0;小黄鱼在急性胁迫盐度为5.0 时成活率为100%,在实验过程中极少数个体出现轻微异常。当急性胁迫盐度在41.6~45.0之间时,小黄鱼虽在1 h 内均未出现个体死亡,但却无法保持平衡,出现侧翻、狂游现象,在3.5 h 内全部鳃盖扩张死亡。盐度在36.0~40.0 时,6 h 以内应激性死亡尾数超过一半,24 h 内的存活率低于40.0%,在为期10 d 的高盐胁迫中仍出现少数死亡,表现为体表发黏、变黑行动迟缓的现象。盐度为34.5 时24 h 内存活率为(91.0±2.35)%,10 d 内存活率为(85.0±2.04)%。经预实验确定低盐组盐度为5.0,高盐组盐度为34.5进行急性盐度胁迫实验。
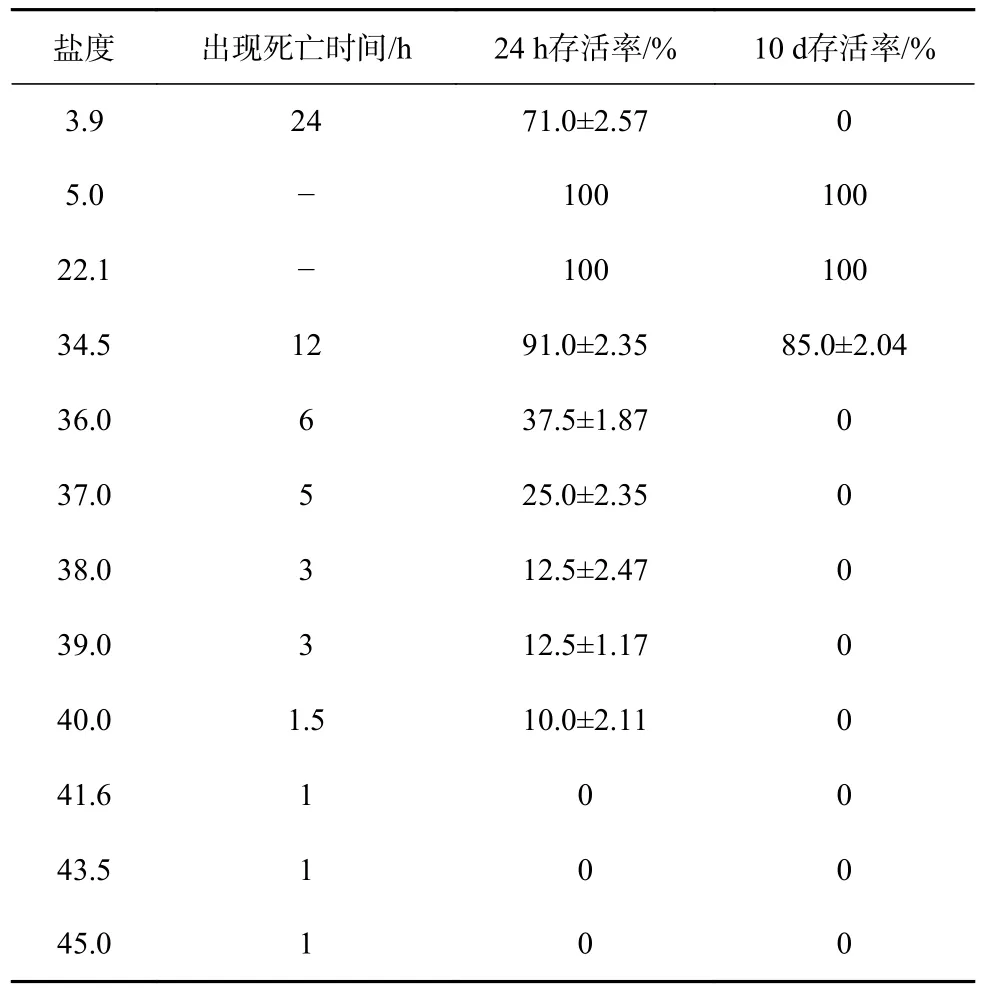
表1 不同盐度胁迫下小黄鱼的存活情况Table 1 Survival of L.polyactis under different salinity stress
3.2 小黄鱼肝脏抗氧化酶活力
不同盐度胁迫下小黄鱼肝脏组织中抗氧化酶活力见图1,从图中可以看出,盐度胁迫(高盐、低盐)下,小黄鱼肝脏组织中SOD 活力与CAT 活力均有不同程度的升高。其中,低盐组的SOD 活力为(517.37±1.56)U/mg,显著高于对照组(p<0.05),但是与高盐组差异不显著(p>0.05);CAT 活力与对照组无显著性差异。高盐组的CAT 活力最大,为(8.08±0.37)U/mg,显著高于对照组(p<0.05),但是与低盐组差异不显著(p>0.05)。
3.3 小黄鱼肝脏组织磷酸酶活力
图2 为不同盐度处理后ACP 和AKP 活力变化对比分析结果。其中,ACP 活力在高盐组中显著低于对照组和低盐组(p<0.05),而低盐组与对照组之间差异不显著(p>0.05)。AKP 活力在高盐组中最高,为(14.05±1.36)U/mg,显著高于低盐组(p<0.05),但是与对照组差异不显著(p>0.05)。对比ACP 和AKP 发现,两种酶活力在3 个处理组中的变化趋势相反:前者逐渐降低,后者逐渐升高。

图1 不同盐度胁迫下小黄鱼肝脏组织抗氧化酶活力Fig.1 Antioxidant enzyme activity in liver of L.polyactis under different salinity stress
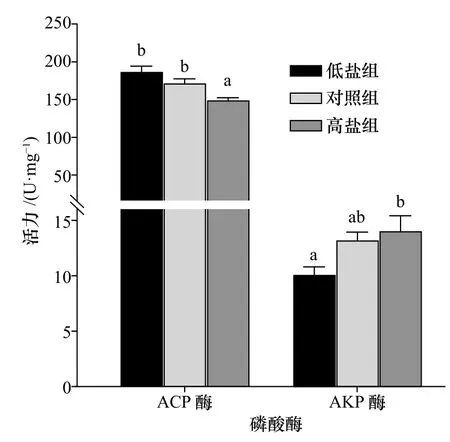
图2 不同盐度胁迫下小黄鱼肝脏组织磷酸酶活力Fig.2 Phosphatase activity in liver of L.polyactis under different salinity stress
3.4 小黄鱼鳃和肾脏组织Na+/K+-ATP 酶活力
图3 为不同盐度条件下,小黄鱼鳃和肾脏中Na+/K+-ATP 酶活力的分析结果。比较发现,低盐组的鳃组织中Na+/K+-ATP 酶活力为(0.74±0.05)U/mg,显著性低于对照组和高盐组(p<0.05),而高盐组与对照组差异不显著(p>0.05)。此外,经低盐和高盐处理后,肾脏组织中Na+/K+-ATP 酶活力均上升,且高盐组与对照组差异显著(p<0.05)。
4 讨论
4.1 盐度胁迫对小黄鱼存活率的影响
盐度可影响鱼类的摄食量、生长存活及免疫能力[18]。在高盐胁迫过程中,小黄鱼出现狂游及体表发黏、变深的现象。此现象与褐点石斑幼鱼(Epinephelus fuscoguttatus)在高盐(60、65)胁迫中的表现较为一致,即鱼苗行为异常、体色变深、体表黏液变多[19]。在漠斑牙鲆(Paralichthys lethostigma)的研究中发现,其在盐度最低(0)和最高(40)的突变下,出现应激性上下窜动行为和体色变白的现象[20]。这些研究表明,水环境中盐度的变化会引起鱼类行为和体色方面的应激改变。不同盐度下鱼体内渗透压存在较大差异[21],通常情况下,淡水鱼和海水鱼体液含盐质量分数相差约为7%[22]。渗透压的调节不仅维持了渗透浓度的稳定,也决定鱼类机体对盐度的适应能力。短期内的盐度剧烈变化会使鱼体产生应激反应引起渗透调节机制的改变[23],达到一定时间后,渗透压逐渐向变化前恢复,维持自身内环境稳定,而一旦超出其适应范围则会出现生理状态紊乱、行为异常及摄食量下降现象,最终消耗能量过多,机体衰竭,导致死亡[23-24]。本次研究中,低盐组未出现死亡,说明该盐度在小黄鱼能够承受的范围,在该盐度条件下,小黄鱼通过自身的调节可以维持机体内环境的稳定。而在高盐组中出现少量个体死亡,表明高盐的胁迫已超出部分个体机体内部调节的范围,同时也表明小黄鱼个体间对高盐的适应具有较大的差异性,该现象对于通过选择育种培育耐高盐的优良品种(系)具有重要意义。
4.2 盐度胁迫对小黄鱼肝脏抗氧化酶活力的影响
肝脏是鱼类新陈代谢的主要器官,在机体抗氧化、糖原合成、分泌胆汁等生理过程中发挥着重要作用[25]。鱼类在盐度胁迫下,由于应激反应会产生过多的氧自由基,机体自身的自由基量和抗氧化能力的动态平衡被打破,产生氧化胁迫[5]。为了抵御氧化胁迫,抗氧化防御系统得到了调用。其中,SOD 和CAT 是抗氧化系统重要的组成部分,SOD 能清除超氧阴离子自由基,保护细胞免受氧化损伤。清除过程中产生的H2O2能在CAT 的催化下生成H2O 和O2,二者协同作用,保护肝脏组织免受损伤[26]。已有研究表明,盐度、水温等环境条件的变化可引起鱼体中抗氧化酶活力改变,如低盐胁迫下,黄鳍棘鲷(Acanthopagrus latus)肝脏SOD 活力变化显著[23],点篮子鱼(Siganus guttatus)不同组织CAT 活力增强[27];条石鲷(Oplegnathus fasciatus)幼鱼肝脏中SOD 和CAT 活力随着盐度升高逐渐增强[28]。本研究中,盐度胁迫导致小黄鱼肝脏中SOD 和CAT 活力均呈现不同程度的上升。表明盐度胁迫会造成机体中大量的自由基积累,而抗氧化酶活力的升高可以一定程度降低肝脏组织的损伤。
4.3 盐度胁迫对小黄鱼肝脏磷酸酶活力的影响
ACP 和AKP 主要在免疫反应中负责转运与代谢磷酸基团,通过巨噬细胞溶酶体对细胞体起到重要的代谢调控作用,是免疫防御体系中重要的水解酶[29]。本次研究发现,小黄鱼肝脏中的AKP 活力在低盐下受到明显抑制,但随着盐度升高不断增强。在房子恒等[30]对半滑舌鳎(Cynoglossus semilaevis)的研究中同样发现,AKP 活力在盐度为0~20 的范围内呈现出不断上升的趋势。原因可能是海水中金属离子含量的升高对AKP 活力具有显著的促进作用[31]。据此推测,盐离子浓度的增加对小黄鱼肝脏组织的AKP 活力有一定的促进作用。白秀娟等[32]和李娜等[33]的研究均指出盐离子浓度增加,ACP 活力受到抑制。本次研究发现,高盐组ACP活力显著低于对照组,受到明显的抑制,研究结果与上述报道结果相一致,这可能是由水环境中的离子浓度变化抑制了ACP 的合成和分泌,导致其活力降低[33]。
4.4 盐度胁迫对Na+K+-ATP 酶活力的影响
在水环境中,鱼类主要依赖鳃丝中的泌氯细胞(MR 细胞)完成渗透压调节中的离子排放,泌氯细胞表面蕴含着丰富的Na+/K+-ATP 酶[34]。Na+/K+-ATP 酶在生物体内离子调节过程中发挥着至关重要作用,其功能是保持细胞内高K+、细胞外高Na+的离子浓度梯度平衡[25]。鳃和肾脏是鱼类渗透浓度调节和离子运输的主要器官,在维持内环境稳定和渗透平衡中发挥重要作用[4]。在盐度胁迫条件下,Na+/K+-ATP 酶活力发生明显变化。研究表明[7],当盐度降至15 时,克氏双锯鱼鳃丝Na+/K+-ATP 酶活力在第96 h 稳定后出现最小值,低于其他盐度组。花鲈(Lateolabrax maculatus)在盐度为10 的环境下,Na+/K+-ATP 酶活力最低[35]。本次研究中发现,低盐组小黄鱼鳃丝的Na+/K+-ATP 酶活力最低,显著低于高盐组,研究结果与上述报道相一致。出现这种现象,可能是鱼类通过降低鳃丝中Na+/K+-ATP 酶活力,减少细胞对Na+、Cl−离子的通透性,阻止了Na+、Cl−离子流动,以此适应生存环境的盐度变化[34]。高盐胁迫时,小黄鱼肾脏中Na+/K+-ATP 酶活力显著增强。据李学军等[36]报道,罗非鱼(Oreochromisspp)肾脏中Na+/K+-ATP 酶活力随盐度的升高而增强。在最高和最低盐度条件下,条石鲷肾脏中Na+/K+-ATP 酶活力均显著高于对照组[37]。卵形鲳鲹(Trachinotus ovatus)肾脏组织中的Na+/K+-ATP 酶活力在24 h 的高盐胁迫下显著性高于对照组[38]。肾脏组织中的Na+/K+-ATP 酶活力在24 h 的高盐胁迫下显著性高于对照组。这些均与本研究有相似之处,说明为了维持高渗环境下鱼体内环境的稳定,肾脏中的Na+/K+-ATP 酶活力增强,使机体建立起新的渗透压平衡。研究指出,在低盐环境中,广盐性鱼类由于渗透代谢水平较低,从而可以消耗更多能量去用于生长,生长水平相比海水环境可能更占据优势[35,39−40]。一定程度上表明,小黄鱼在低盐环境中所需渗透代谢耗能较少,从渗透代谢方面来讲,相比较高盐度海水更有利于小黄鱼的生长,此结果对于进行小黄鱼低盐度或者淡化养殖均有较好的指导意义。
5 结论
综上所述,小黄鱼幼鱼对盐度有较强的调节能力。急性盐度胁迫下,小黄鱼幼鱼能够及时调动非特异性免疫酶、Na+K+-ATP 酶进行体内生理调节,消除机体过多的自由基和维持内外环境的渗透压平衡。在低盐条件下,小黄鱼存活率较高且所需渗透代谢耗能较少,为今后小黄鱼咸淡水养殖提供理论参考。但在高盐下,鱼体内环境遭到破坏,自由基代谢紊乱,抗氧化防御机制受到影响,导致机体免疫能力降低,个体之间对高盐耐受能力差异较大,为耐盐品种选育奠定了基础。

