降解聚乙烯塑料芽孢杆菌LC-2 的分离鉴定及降解特性研究
江婷婷,丁慧平,冯丽娟,张大海,李苓,刘彦东,李先国*
(1.中国海洋大学 化学化工学院,山东 青岛 266100;2.海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100)
1 引言
全世界每年石油基合成塑料的产量超过3 亿t,废弃塑料的环境污染问题已经引起人们的日益关注[1-2]。聚乙烯(Polyethylene,PE)塑料由于廉价、轻便、耐用的特点被广泛用于人们的日常生活,但由于PE 是一种稳定性很好的聚合物,在环境中难以降解,容易造成“白色污染”[3]。环境中废弃的塑料由于风化和降解作用会破碎成尺寸更小的塑料碎片,最后形成尺寸小于5 mm 的微塑料。微塑料广泛存在于环境中[4-6],其很有可能进入食物链,还可能吸附和运输各类污染物,进而成为有毒、有害化学物质的载体,增强其在生态系统中的累积和放大作用,加剧环境和健康问题[7-11]。当前,解决塑料污染的方法主要有焚烧、填埋、微生物降解、回收利用[12]以及可降解塑料的开发等。在塑料垃圾治理方面,焚烧和填埋都会造成比较严重的二次污染,微生物降解则被认为是最为环保的有效途径[13-14],特别是在塑料垃圾集中的区域,若能找到并高效利用塑料降解菌,将是一种安全且可行的方法。目前从环境中分离得到的能够降解PE 材料的微生物,大多数是细菌和真菌,主要包括蜡样芽孢杆菌(Bacillus cereus)、假单胞菌(Pseudomonasspp.)、玫瑰红红球菌(Rhodococcus rhodochrous)和微杆菌(Microbacterium phyllosphaerae)等[15-20]。这些微生物大多是从土壤、垃圾填埋厂和一些生物的肠道中获得,极少来源于海洋环境。若能从海洋环境中获得有效降解PE 的微生物,对于丰富PE 降解微生物资源库及促进海洋生态系统的物质和能源循环都具有积极的意义。
2 材料和方法
2.1 样品采集
从李村河口随机收集3 块有严重分解迹象的塑料,比如有裂纹、孔洞或者有褪色等现象,放于无菌塑料袋中,低温保存带回实验室。
2.2 用于细菌筛选和培养的塑料样品的制备
市售PE 保鲜膜,将其剪成大小约3 mm×3 mm(用于降解实验)和3 cm×3 cm(用于PE 降解菌的筛选)的块状。降解菌筛选和PE 降解实验之前,样品根据文献[21]的方法在无水乙醇中浸泡灭菌,超净台中风干,室温存放于超净台以备下一步使用。
2.3 培养基
培养基的配方参照文献[17]。液体无碳培养基:0.7 g KH2PO4、0.7 g K2HPO4、0.7 g MgSO4·7H2O、1.0 g NH4NO3、0.005 g NaCl、0.002 g FeSO4·7H2O、0.002 g ZnSO4·7H2O、0.001 g MnSO4·H2O、去离子水1 000 mL,调节pH 为7.0~7.2。固体无碳培养基由液体无碳培养基添加20 g/L 的琼脂粉制得。营养肉汤培养基:蛋白胨10 g、牛肉膏3 g、NaCl 5 g、去离子水1 000 mL、调节pH 为7.0~7.2。营养琼脂培养基由营养肉汤培养基添加20 g/L 的琼脂粉制得。以上培养基均在121℃高压灭菌30 min。
2.4 菌株的分离筛选
将从李村河口采集的塑料样品剪碎,装于盛有100 mL 灭菌生理盐水的锥形瓶中,向其中加入灭菌的玻璃微珠。使用摇床在180 r/min,35℃条件下恒温振荡3 h 后静置。吸取5 mL 悬浮液加入含有100 mL液体无碳培养基的锥形瓶中,并向其中加入1 g 灭菌的PE 薄膜作为唯一碳源。为筛选合适的PE 降解菌,将锥形瓶放于摇床上,于120 r/min,35℃条件下孵育20 d。20 d 后将锥形瓶中的塑料薄膜弃去,剩余的培养液用无菌生理盐水梯度稀释后分别取10−4、10−5、10−6的稀释液各0.2 mL 涂布于营养琼脂平板上,以获得单一菌落,用四分体划线法将其转接至新鲜营养的琼脂平板上进行培养,多次转接,直至获得菌株的纯培养物。菌株培养温度均为35℃,共分离出52 个单一菌落。
2.5 PE 片法验证PE 降解菌株
将所获得的单一菌落在营养肉汤培养基中富集培养,然后6 000 r/min 离心,弃去上清液,加入生理盐水洗涤细菌沉淀物3 次,再次离心,弃去上清液,以确保除去其中的营养物质。将获得的细菌沉淀物重悬于生理盐水中,吸取0.2 mL 涂布在固体无碳培养基上,在平板表面覆盖上3 cm×3 cm 的无菌PE 薄膜,置于恒温培养箱中,培养几天后通过观察PE 薄膜周边是否有菌落形成来判断是否是潜在的PE 降解菌。对获得的3 株具有潜在降解PE 能力的菌株进行进一步的分子生物学鉴定。所有实验均进行3 次平行实验。
2.6 降解菌株的分子生物学鉴定
16SrRNA 测序在青岛睿博兴科生物技术有限公司进行,所得序列使用美国国家生物技术信息中心的BLAST 数 据 库(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行相似性搜索,并上传到GeneBank(gbsub@ncbi.nlm.nih.gov)获得登录号,从中选择匹配度为95%以上的细菌菌株,使用MEGA7.0 软件提供的邻接法构建系统发育树。
2.7 微生物接种物的制备及PE 塑料的降解实验
2.8 分析过程
2.8.1 PE 塑料失重率的测定
为了监测降解过程中PE 塑料的重量变化,分别在实验的第7 天、第14 天、第21 天、第28 天取样测定PE 塑料的失重率。将培养基中的PE 塑料用孔径为0.45 μm 的玻璃纤维滤膜过滤分离,在2%的十二烷基硫酸钠溶液中浸泡4 h,然后用去离子水反复淋洗干净,以除去PE 塑料表面附着的微生物膜,最后将洗净的PE 塑料在50℃的烘箱中干燥过夜,冷却至室温后称重。PE 塑料的失重率由下式计算:

2.8.2 无碳培养基中细菌浓度变化
用稀释涂布平板法测定降解过程中培养基中游离的细菌数,分别在第7 天、第14 天、第21 天、第28 天取样,将培养基中的液体摇匀后,吸取50 μL 培养液,用无菌生理盐水梯度稀释后,涂布在营养琼脂平板上,培养24 h后,记录菌落数,所有实验均进行3 次平行实验。
2.8.3 PE 塑料的SEM 分析
采用S-4800 台式扫描电子显微镜(日本Hitachi)对降解前后的PE 塑料表面形貌进行表征。样品在氩气气氛下溅射喷金,10 kV 真空条件下观察并拍摄。
2.8.4 PE 塑料表面的疏水性变化
由式(3)可知,在测点半径为10~120 mm的测试区域内,近似以r为28 mm(R为56 m·kt-1/3)为分界点,靠近爆心的区域内粒子速度峰值的幂衰减指数为1.46,远离爆心的区域内粒子速度峰值的幂衰减指数为2.60。由表1可以看出,由r1和r2均小于30 mm区域内的实测粒子速度给出的频率衰减因子的比例系数κ整体上明显小于r1和r2均大于30 mm区域内的κ值。时域和频域的分析结果都表明,在半径r为30 mm(R为60 m·kt-1/3)附近时,球面波粒子速度峰值的衰减出现了转折。另外,上述结果也表明:本文提出的球面波频域分析方法给出的结果和时域的结果在物理上是相符的。
使用JC2000DM 接触角测量仪(上海中晨数字技术设备有限公司)测定降解前后PE 薄膜表面的水接触角(室温下使用去离子水测定)。
2.8.5 PE 塑料的FTIR 分析
使用Nexus 670 FTIR 光谱仪(美国Nicolet)对样品进行FTIR 表征,长度范围为4 000~400 cm−1,分辨率为4 cm−1,扫描次数为20 次。
2.8.6 PE 塑料的分子量变化
使用乌氏黏度计(毛细管直径为0.5 mm,上海宝山启航仪器厂)测量降解前后PE 塑料的黏均分子量。十氢萘为溶剂,70℃恒温水浴测量。
2.8.7 PE 塑料的热重分析
选用TGA2 热分析仪(梅特勒−托利多)对材料的热稳定性进行表征,升温速率为10℃/min,从25℃开始升温至600℃,其流速为20 mL/min,吹扫气为N2,保护气(N2)流速为15 mL/min。
3 结果和讨论
3.1 细菌菌株的分离与鉴定
对分离出的PE 降解菌株LC-2,选取曲霉菌(Aspergillus flavipes)作为外群,基于16S rRNA 基因序列构建系统发育分析树。如图1 所示,其16S rRNA 基因序列与两株典型菌株Bacillussp.Marseille-Q1617(相似度为100%)和Bacillus aquimarisstrain PBCS1(相似度为99%)的序列以极高相似度聚在一条进化分支上,确定其为芽孢杆菌属的一个菌株,命名为LC-2。其GeneBank 登录号为MW199054。
3.2 PE 塑料的失重率
通过比较PE 塑料的干重损失(图2) 来评估PE塑料的表观降解速率。结果表明,孵育28 d 后,PE塑料的重量损失在9%左右,直观地说明了LC-2 对PE塑料的降解。对照组在第7 天后的少量重量损失可能与PE 塑料在洗涤转移中的损失有关。
3.3 培养基中的细菌浓度变化
从图3 结果可以看出,在培养的前7 天,细菌浓度增长缓慢,可能是细菌对环境有一个适应过程;在第7~21 天,细菌开始大量增长,说明细菌可以利用PE 塑料作为唯一碳源来进行自身的生长繁殖;在第21~28 天,培养基中的细菌数开始下降,主要是因为培养基中的无机盐被消耗殆尽,也有可能是细菌产生的代谢物对自身的生长繁殖起了抑制作用,或者是更多的细菌附着在了PE 塑料的表面,导致培养基中的细菌浓度降低。
3.4 PE 塑料的扫描电镜观察
PE 塑料表面形貌的变化是被LC-2 降解的间接证据。未接种LC-2 的PE 薄膜表面完整光滑、没有裂痕(图4a);降解28 d 后的PE 塑料表面出现了明显的孔洞(图4b)、裂痕(图4c)和凹坑(图4d)。这说明LC-2 可以附着在PE 塑料表面,形成生物膜,并利用PE 塑料作为碳源,对其表面产生了破坏。
3.5 PE 塑料的表面疏水性变化
PE 材料与水的接触角大小是其亲疏水性的体现。接触角越小,其亲水性越高,越有利于微生物的定植和附着。表面亲水性的增强是微生物附着在PE 塑料表面并形成生物膜的关键。图5 结果表明,经过28 d 的孵育,经LC-2 降解后PE 的水接触角为71.72°,对照组为93.54°。降解后的PE 水接触角变小,说明其表面疏水性降低,亲水性提高;也说明PE 塑料表面在LC-2 的作用下很有可能被氧化产生了亲水基团。亲水基团的产生有利于菌株大量附着在其表面,为菌株进一步降解PE 塑料提供了条件。

图1 基于16S rRNA 基因序列构建的菌株LC-2 系统发育树Fig.1 Neighbor-Joining tree of strain LC-2 constructed based on 16S rRNA gene sequence
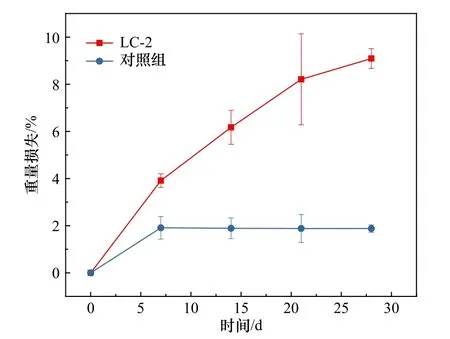
图2 PE 塑料的失重率曲线Fig.2 Weight loss curve of PE plastic

图3 培养基中游离的细菌数Fig.3 The number of free state bacteria in the medium

图4 PE 塑料的扫描电镜照片Fig.4 Scanning electron microscopy photographs of PE plastic

图5 PE 塑料的水接触角图片Fig.5 The photographs of water contact angles of PE plastic
3.6 LC-2 降解前后PE 塑料表面化学结构的变化
通常来说,羰基等基团的出现被认为是PE 氧化降解的直接证据。由降解前后PE 塑料的红外光谱图(图6)可以看出,对照组可以观察到波数在2 918 cm−1和2 851 cm−1的PE 的特征峰,分别归属于CH2-的不对称和对称伸缩振动;1 468 cm−1和725 cm−1的吸收峰则分别对应于C-H 键的伸缩振动和摇摆振动,与前人结果一致[22-24]。孵育28 d 后的PE 塑料,其红外光谱在1 712 cm−1处显示出羰基的伸缩振动峰是PE 氧化降解的标志[17]。
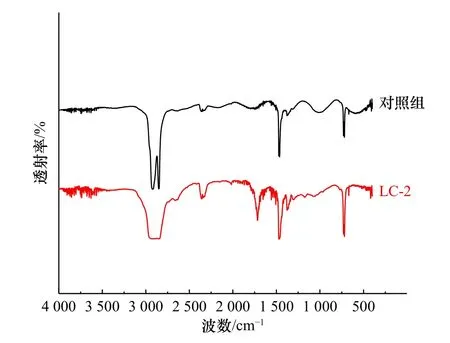
图6 PE 塑料降解前后的红外光谱图Fig.6 FTIR spectra of PE plastic before and after degradation
3.7 PE 塑料的分子量变化
聚合物主链长度的下降是其降解的一个重要指标。链长影响所有的降解类型,不论是物理、化学还是生物降解。链长越长,越难于降解。本文的结果表明,降解前PE 塑料黏均分子量的平均值是74 131±1 007,降解28 d 后的分子量平均值是60 255±775,降低了约(18.7±1.1)%。黏均分子量的降低表明LC-2 能够利用PE 塑料,并引起链的断裂,导致形成较短的片段。据报道[25-27],细菌释放到培养基中的胞外酶可以攻击聚合物的主链,导致的聚合物分子量的降低,是聚合物链降解的证据。
3.8 PE 塑料的热重分析

图7 PE 塑料的热重曲线Fig.7 Thermogravimetric curve of PE plastic
塑料材料的热稳定性主要取决于聚合物链的类型、结构和长度。图7 热重曲线表明,降解后的PE薄膜热稳定性有所提高,其失重起始温度(435.9℃)较对照组(424.7℃)拖后,总失重率(96.42%)较对照组(98.21%)略有降低,可能与聚合物的结晶度增大有关。结晶度增大是因为PE 作为半结晶的高聚物,其晶区的结构较为规整密实,在LC-2 降解PE 的过程中,可能引起分子链的断裂,破坏了缠结网络,产生的小分子链段具有较强的活动性,会沿着原有的晶粒外缘发生二次结晶,使结晶度提高[28]。因此热稳定性提高可能与较短聚合物链的形成有关,表明微生物可以利用PE 塑料,并形成低分子量的聚合物。
但是,显著性检验(p>0.05)结果表明,实验组和对照组并无显著性差异,可能是由于塑料降解的时间不长,降解程度不高(重量损失9% 左右,见3.2 节),热稳定性变化不显著。
4 结论
本研究从李村河口采集的塑料薄膜上分离出细菌LC-2,根据形态学特征、生理生化特征和分子生物学方法对其进行鉴定,鉴定为芽孢杆菌(Bacillus aquimaris)。LC-2 在实验室控制条件下可以加速PE塑料的降解,并且该细菌可以在以PE 塑料为唯一碳源的液体无碳培养基中生长良好。经过LC-2 降解后的PE 塑料,其表面水接触角变小,亲水性增加;表面形貌发生了变化,产生了孔洞、裂痕和凹坑;表面被氧化产生了羰基;降解后的PE 塑料的热重损失及黏均分子量下降。所有证据都表明了LC-2 可以降解PE 塑料。

