低氧胁迫对军曹鱼幼鱼生长、血清生化和非特异性免疫指标的影响
王维政,曾泽乾,黄建盛,2,3*,郭志雄,李洪娟,陈刚,2,3
(1.广东海洋大学 水产学院,广东 湛江 524088;2.南方海洋科学与工程广东省实验室(湛江),广东 湛江 524025;3.广东省水产经济动物病原生物学及流行病学重点实验室,广东 湛江 524088)
1 引言
鱼类的生长受到内源和外源两方面因素的调控,外源因素主要包括食物、水温、溶解氧、盐度、光照和pH 等,其中溶解氧对确保鱼类的正常生长至关重要[1]。然而,由于自然和人为因素的干扰(水环境污染、藻华和高密度的水产养殖),鱼类不可避免地会受到低氧的胁迫。在全球范围内,水体低氧是海洋和淡水生态系统面临的最紧迫和最普遍的问题之一,目前已经发现了大量“死区”是水生生物无法生存的[2],这对水生生物造成了不同程度的影响。研究表明,水体的溶氧量与鱼类的运动、摄食、代谢状态和激素水平等有密切的联系,水体的低氧不仅会造成鱼类存活率下降和生长缓慢,还会影响鱼体的免疫和生殖等机能,甚至造成鱼类的死亡[3-4]。而且,全球气候变化还可能会加剧水体低氧的问题[5],导致养殖成本增加和商业利润降低,严重制约水产养殖的发展[3]。因此,研究低氧对鱼类的影响,不仅对探究鱼类的低氧适应机制具有理论意义,还对指导水产养殖的实际生产具有参考价值。
军曹鱼(Rachycentron canadum),隶属于鲈形目,军曹鱼科,军曹鱼属,又称海鲡和海龙鱼,是热带和亚热带海域的肉食性洄游经济鱼类,主要分布在太平洋、大西洋和印度洋等沿岸海域和港湾[6]。军曹鱼肉质鲜美,营养丰富,并且生长速度极快,其海水网箱养殖在我国南方地区发展迅猛,养殖潜力巨大,已成为近海浮动式网箱和深海网箱养殖的重要品种[7]。近年来,军曹鱼的养殖海区由于天气、温度等的影响,经常会出现缺氧的现象,黄建盛等[8]在前期已研究了急性低氧胁迫对军曹鱼幼鱼血液生化指标的影响,血液生化指标可以作为鱼类应激时体内物质代谢和组织器官机能状态变化的一个重要指标,还能了解机体的氧化损伤[9],对施氏鲟(Acipenser schrenckii)[10]、虹鳟(Oncorhynchus mykiss)[11]、胡子鲶(Clarias batrachus)[12]和大西洋鲑(Salmo salar)[13]等鱼类也报道过低氧胁迫对血液指标影响的相关研究,但目前还未开展长期低氧胁迫对军曹鱼血液指标影响的研究。因此,本文以军曹鱼幼鱼为研究对象,对军曹鱼在长期低氧胁迫下不同时间的生长、血清糖脂代谢水平、肝功能、离子浓度和非特异性免疫等指标进行分析,旨在为军曹鱼的耐低氧新品种的选育提供基础资料。
2 材料与方法
2.1 实验用鱼与饲养管理
军曹鱼幼鱼由广东海洋大学湛江东海岛生物研究基地提供。实验在广东恒兴饲料实业股份有限公司863 基地进行,养殖设施为室内24 h 持续充气的流水养殖系统,水体500 L,挑选健康、有活力、规格均一、初始体质量为(50.44±2.78)g 的军曹鱼幼鱼250尾,暂养1 周后进行实验。暂养期间持续充气,溶解氧浓度在6 mg/L 以上,自然光周期(12 h∶12 h),海水为砂滤海水,温度为(29±1)℃,盐度为28~30,pH 为7.8~8.0,氨氮含量小于0.02 mg/L,每天08:00 和16:00各饱食投喂配合饲料(广东越群海洋生物研究开发有限公司)1 次,投喂1 h 后清理粪便和残饵。
2.2 低氧胁迫实验
暂养结束,把军曹鱼禁食24 h 后随机分为低氧胁迫和常氧对照两个处理组,每个处理组3 个重复,每个重复35 尾鱼。低氧胁迫组的水体溶氧浓度设计为3 mg/L,3 mg/L 的溶氧浓度通过覆盖薄膜和调整充气量以及流水量的大小来实现。首先把每一个养殖水槽覆盖上薄膜并且关掉流水以及停止充气,利用军曹鱼的呼吸作用使水体溶解氧自然降低至接近3 mg/L,随后通过大约3 h 的不断调整流水量及充气量的大小使水体溶氧稳定,稳定之后开始计时进行为期28 d 的低氧胁迫实验,其他条件与暂养期间一致。常氧对照组所有养殖条件均与暂养时相同。实验期间间隔1 h,使用化学滴定法(GB 7489−87)对水体溶氧进行测定,低氧胁迫组的溶氧浓度能够稳定在(3.15±0.21)mg/L的水平,常氧对照组溶氧浓度为(6.18±0.24)mg/L。
2.3 血清样品的制备及指标的测定
在低氧胁迫的第1 天、第7 天、第14 天、第28天,每次从各个水槽随机取8 尾鱼,使用MS-222 快速麻醉后进行称重,随后用1 mL 无菌注射器在尾鳍下方进行静脉抽血,血液在室温静置1 h 后置于4℃冰箱过夜,3 500 r/min 离心15 min,吸取上层血清到2 mL冻存管,放入−80℃超低温冰箱保存备用。
根据测得的体重分别计算低氧组和对照组在第1 天、第7 天、第14 天、第28 天的增重率(WGR)和特定生长率(SGR),计算公式为

式中,W1为实验开始前的体重(g);W2为各个时间点的体重(g);t为胁迫的时间(d);ln 为自然对数符号。
血清生化指标用深圳雷杜生命科学股份有限公司全自动生化分析仪(型号为Chemray 240)测定,所用试剂购自长春汇力生物技术有限公司。生化指标包括:总蛋白(TP)、白蛋白(ALB)、甘油三酯(TG)、总胆固醇(TC)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、血糖(GLU)、钠离子(Na+)、钾离子(K+)、钙离子(Ca2+)、氯离子(Cl−)。其中ALT 和AST 指标采用速率法,其他生化指标采用终点法进行测定。
血清非特异性免疫指标均采用南京建成生物科技有限公司生产的试剂盒测定。超氧化物歧化酶(SOD)活性用羟胺法测定,过氧化氢酶(CAT)活性用可见光法测定,丙二醛(MDA)含量采用TBA 法测定,溶菌酶(LZM)活性用比浊法测定。
2.4 数据分析
利用GraphPad Prism 5 软件对数据进行处理及作图,采用配对t检验方法分析低氧胁迫组与其对照组各指标数据差异显著性,以p<0.05 表示差异显著,p<0.01 表示差异极显著。
3 结果
3.1 低氧胁迫对军曹鱼幼鱼生长的影响
由图1 可知,在低氧胁迫过程中,军曹鱼幼鱼的生长速度与对照组相比较为缓慢,低氧组军曹鱼增重率和特定生长率在第7 天与对照组具有显著性差异(p<0.05),在第14 天和第28 天则具有极显著差异(p<0.01)。
3.2 低氧胁迫对军曹鱼幼鱼血清肝功能指标的影响
由图2 可知,在低氧胁迫过程中,军曹鱼幼鱼血清AST 和ALT 活性都呈不断升高的趋势,其中AST 活性在第7 天、第14 天和第28 天极显著高于对照水平(p<0.01),而ALT 活性则在第14 天和第28 天与对照组具有极显著差异(p<0.01);TP 和ALB 含量的变化趋势一致,均呈上升的趋势,并且都在第14 天和第28 天显著高于对照水平(p<0.05)。
3.3 低氧胁迫对军曹鱼幼鱼血清糖脂代谢水平的影响
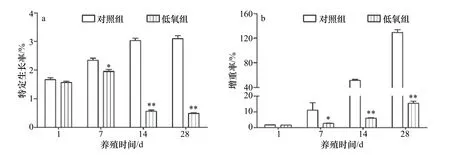
图1 低氧胁迫对军曹鱼幼鱼特定生长率(a)、增重率(b)的影响Fig.1 Effects of hypoxia on the specific growth rate (a) and weight gain rate (b) in the serum of juvenile cobia (Rachycentron canadum)

图3 低氧胁迫对军曹鱼幼鱼血清葡萄糖(a)、总胆固醇(b)和甘油三酯(c)含量的影响Fig.3 Effects of hypoxia on the contents of glucose (a),total cholesterol (b),and triglyceride (c) in the serum of juvenile cobia(Rachycentron canadum)
由图3 可见,在低氧胁迫过程中,军曹鱼幼鱼血清GLU 含量在第1 天显著升高(p<0.05)后在第7 天降低到对照水平,之后在第14 天极显著升高(p<0.01)后又呈下降的趋势,但在第28 天仍然与对照组具有显著性差异(p<0.05);TG 含量先保持对照水平后呈不断上升的趋势,在第14 天和第28 天极显著高于对照水平(p<0.01);TC 含量在第1 天显著下降(p<0.05),随后呈不断上升的趋势,并在第14 天和第28 天极显著高于对照组(p<0.01)。
3.4 低氧胁迫对军曹鱼幼鱼血清离子浓度的影响
由图4 可见,在低氧胁迫过程中,军曹鱼幼鱼血清Na+和Cl−含量变化趋势一致,在胁迫的第1 天和第7 天没有显著性变化,在第14 天和第28 天则极显著高于对照组(p<0.01);K+含量不断升高并在第7 天、第14 天和第28 天与对照组具有显著性差异(p<0.05);Ca2+含量则呈不断下降的变化趋势,在第14 天和第28 天显著低于对照水平(p<0.05)。
3.5 低氧胁迫对军曹鱼幼鱼血清非特异性免疫指标的影响
由图5 可见,在低氧胁迫过程中,军曹鱼幼鱼血清SOD 活性不断上升,且在第7 天、第14 天和第28 天与对照组相比具有极显著差异(p<0.01);CAT 活性在第1 天极显著下降(p<0.01),在第7 天又显著升高(p<0.05),之后呈不断下降的趋势,在第28 天极显著低于对照组(p<0.01);MDA 含量总体呈不断上升的趋势,在第14 天和第28 天极显著高于对照水平(p<0.01);LZM 活性在第1 天显著上升(p<0.05)后呈不断下降的变化趋势,并且在第28 天极显著低于对照组(p<0.01)。
4 讨论
4.1 低氧胁迫对军曹鱼幼鱼生长的影响
溶解氧作为鱼类养殖过程中最重要的环境因子之一,严重制约着鱼类的生长。在饱和的溶解氧水平下,鱼类新陈代谢旺盛,能够有效地将蛋白质和脂质等营养素转化为生长效能,使鱼类快速生长,而在低氧状态下,鱼类则会表现为摄食量减少、饲料转换率低下和生长缓慢,甚至还会出现死亡[14-16]。相关研究表明,在21 d 的低氧(3 mg/L)胁迫过程中,香鱼(Plecoglossus altivelis)游动减少,摄食不够积极,体重显著低于对照组,甚至出现了负增长的现象[4]。在草鱼(Ctenopharyngodon idella)[17]的研究中也发现,8 周的养殖过程中,草鱼的生长受到低氧(3.5 mg/L)的显著抑制。在本文的研究中也观察到类似的现象,与对照组相比,军曹鱼幼鱼在低氧环境中食欲下降,经常在水槽底部处于静止状态,生长速度显著降低,增重率和特定生长率在低氧胁迫第7 天显著低于对照组,在第14 天和第28 天则与对照水平具有极显著的差异,由此推测军曹鱼幼鱼可能在低氧胁迫过程中将蛋白质和脂质等营养素转变为生长能的效率低下,低氧严重抑制了军曹鱼的生长。因此在军曹鱼的养殖过程中要避免长时间的低氧,以防对其生长发育造成影响。

图4 低氧胁迫对军曹鱼幼鱼血清钠离子(a)、钾离子(b)、氯离子(c)和钙离子(d)含量的影响Fig.4 Effects of hypoxia on the contents of sodium ion (a),potassium ion (b),chloride ion (c) and calcium ion (d) in the serum of juvenile cobia (Rachycentron canadum)

图5 低氧胁迫对军曹鱼幼鱼血清超氧化物歧化酶(a)、过氧化氢酶(b)、溶菌酶(d)活性和丙二醛(c)含量的影响Fig.5 Effects of hypoxia on the activities of superoxide dismutase (a),catalase (b),lysozyme (d) and the contents of malondialdehyde (c)in the serum of juvenile cobia (Rachycentron canadum)
4.2 低氧胁迫对军曹鱼幼鱼肝功能的影响
肝脏作为鱼体内最大的腺体器官,具有代谢、排泄、解毒和营养吸收等众多生理功能,对肝功能指标的检测能够反映鱼类生理功能的健康状态[18]。AST和ALT 是动物体内重要的转氨酶,作为评价肝细胞损伤或坏死的最可靠指标,在非必需氨基酸的合成以及蛋白质的分解代谢中起着重要的中介作用[19]。在正常的情况下,由于细胞膜的屏障作用,血清AST 和ALT 活性很低,但是当肝脏受损时,细胞膜的通透性升高,转氨酶释放到血清中的速度加快,导致血清转氨酶活性升高[20]。在本研究中,与对照组相比,随着低氧胁迫时间的延长,血清AST 和ALT 活性持续升高,说明低氧胁迫对军曹鱼幼鱼的肝脏造成了损伤。值得注意的是,本研究中AST 和ALT 活性在低氧胁迫的第14 天和第28 天均极显著高于对照组,说明军曹鱼幼鱼可能在低氧胁迫的第14 天和第28 天,肝脏受损严重,影响鱼体的氨基酸和蛋白质代谢。血清TP 主要在肝脏和网状内皮系统的浆细胞内合成,由血清ALB 和血清球蛋白等组成,作为体内主要营养源,具有维持体内渗透压和修补组织的功能,其含量的高低能够反映机体生长发育情况以及生理健康状态[21]。ALB 在维持血液渗透压稳定过程中发挥重要作用,参与营养运输、凝血、抗凝血、肝细胞修复及再生等过程,以保持体内一个稳定的化学环境[22]。本文的研究结果表明,军曹鱼幼鱼血清TP 和ALB 含量在低氧胁迫后均呈现升高的趋势,而且在低氧胁迫的第14 天和第28 天显著高于对照组,原因可能是军曹鱼幼鱼受到低氧的刺激以及肝脏受到一定程度的损伤,使机体的蛋白质代谢受到影响,导致血清TP 和ALB 含量上升[23−24]。而花鲈(Lateolabrax maculatus)幼鱼在低氧胁迫后血清TP 和ALB 含量却出现了显著下降的现象[25],军曹鱼大规格幼鱼在低氧胁迫后血清TP 含量也显著低于胁迫前[8],原因可能是鱼的种类、胁迫的严重程度和时间等的不同都会对血清蛋白的含量造成不同程度的影响。
4.3 低氧胁迫对军曹鱼幼鱼血清糖脂代谢水平的影响
鱼类的GLU 主要来源于食物的消化吸收、肝糖原的分解以及糖异生作用,其含量与鱼体的运动、摄食、生物学特性和环境的变化有关,是机体能量的主要来源,在遭受环境胁迫后鱼体发生应激,会导致GLU 含量升高[26]。本研究中,军曹鱼幼鱼在低氧胁迫的第1 天、第14 天和第28 天,血清GLU 含量显著高于对照组,可能是军曹鱼幼鱼在经历低氧后,肝糖原大量分解为机体提供能量,以满足自身能量需求。该研究结果与罗非鱼(Oreochromis niloticus)[1]和大口黑鲈(Micropterus salmoides)[3]的低氧实验结果相类似。血清TG 和TC 含量能够反映机体对脂类代谢的状况,低氧胁迫1 d 后,军曹鱼幼鱼TC 含量显著下降,在花鲈的氧化应激实验中[25],花鲈血清中TG 和TC 含量在低氧12 h 后也显著下降,与本研究结果类似,这可能也是鱼类应对低氧的策略,加快脂类代谢,以满足鱼体在胁迫后对能量的需求。已有研究表明,鱼类血清中70%~80%的TC 源于肝细胞,一旦肝细胞受损则血清TC 含量升高,并且肝损伤也会导致血清TG 含量增加[27],血清TC 和TG 含量的升高也说明肝脏中脂肪堆积较多,脂质代谢出现紊乱[28]。本研究中,随着胁迫时间的延长,军曹鱼幼鱼血清TC 和TG 含量在低氧胁迫的第14 天和第28 天显著高于其对照组,推测长时间的低氧胁迫使军曹鱼幼鱼的脂质代谢出现异常。结合前文肝功能指标推测,肝脏组织的损伤很可能是导致军曹鱼幼鱼代谢异常的原因。另外,在低氧胁迫的第7 天,血清GLU、TG 和TC 含量均与对照组无显著性差异,表明在低氧胁迫的7 d内,军曹鱼幼鱼可能通过自身的调整,使机体代谢恢复到正常水平,但是更长时间的低氧胁迫则会导致代谢的失调,最终严重限制了军曹鱼的生长。
4.4 低氧胁迫对军曹鱼幼鱼血清离子浓度的影响
当外界的环境胁迫开始对代谢活动产生影响的时候,鱼体的调节机制就会试图将组织损伤所引起的免疫反应造成的损伤降到最低,调节机制功能的发挥必须保持细胞的最佳pH 和渗透压,这一般通过调节细胞内外离子的稳态来实现[11]。血清离子是维持细胞新陈代谢、酸碱平衡以及调整体液渗透压的重要因子[29]。本文军曹鱼幼鱼在低氧胁迫后Na+、Cl−、K+含量均呈现升高的趋势,推测原因是水体中较低的溶解氧使鱼体产生应激反应,为了使水中的氧气更容易扩散到血液中,鱼类可能通过改变鳃的形态,增大鳃的扩散容量,增加有效呼吸面积,使水体中的离子进入鱼体,导致血清中离子含量增加[30]。而在通常情况下,鱼类的鳃上皮对离子的通透性大小依次为H+、K+、Na+、Cl−、Ca2+[31],所以过多的Na+、Cl−、K+进入血液,使其含量增多。这与区又君等[30]对卵形鲳鲹的研究结果相类似。硬骨鱼的Na+含量与pH 相关,其含量的变化会改变鱼类体液的酸碱度[32],Cl−含量的变化大体上与Na+和K+一起进行[33],而K+的失衡则会导致细胞膜破裂,还可能引起细胞的死亡[32]。本研究中,军曹鱼幼鱼血清Na+和Cl−含量在胁迫的第14 天和第28 天显著上升,K+含量在胁迫的第7 天开始出现显著性升高,表明长时间的低氧胁迫对军曹鱼体幼鱼体液内环境造成了影响。Ca2+含量在胁迫过程中呈现不断下降的变化趋势,并且在第14 天和第28 天具有显著性差异,推测其原因可能是长时间的低氧胁迫导致军曹鱼机体代谢异常,肌肉的兴奋性降低,从而导致Ca2+含量下降。
4.5 低氧胁迫对军曹鱼幼鱼血清非特异性免疫因子的影响
氧化应激作为机体细胞水平上最常见的应激反映,是鱼类应激生物学研究领域当中的一个重要分支。脂质过氧化产物MDA 和酶抗氧化系统SOD、CAT 常作为衡量氧化应激水平的指标,并且抗氧化酶对增强吞噬细胞防御能力和机体免疫功能方面有重要的作用[34−35]。SOD 是生物抗氧化酶类的重要成员,能够将氧化应激过程中产生的超氧阴离子自由基(O2−)清除,将其转化为H2O2和O2,保护细胞免受损伤,被认为是机体最重要的抗氧化酶之一[36],而CAT则将SOD 产生的H2O2转化为H2O,保护机体细胞内环境的稳定[35]。MDA 作为脂质过氧化产物,反映机体的氧化损伤程度[37]。本研究表明,军曹鱼幼鱼在28 d 低氧胁迫过程中,血清MDA 含量和SOD 活性呈上升的趋势,并在第14 天和第28 天显著高于其对照组,说明随着低氧胁迫时间的延长,军曹鱼幼鱼机体氧化损伤程度持续加重。在低氧胁迫过程中产生的大量活性氧,不断激活自身的抗氧化系统,导致SOD活性升高,以清除产生的活性氧。血清CAT 活性在低氧胁迫的第1 天显著低于对照组,可能是在胁迫的第1 天,溶氧的变化导致产生的活性氧过多,抑制了CAT 的活性,而在胁迫的第7 天,随着SOD 活性的不断增强,产生的H2O2可能诱导CAT 活性显著升高。而随着低氧胁迫时间的延长,血清CAT 活性呈现下降的趋势,并在第28 天显著低于对照水平。结合MDA、AST 以及ALT 指标,表明,随着低氧应激的程度加剧,军曹鱼幼鱼机体受到一定程度的氧化损伤,抗氧化物质合成能力下降,氧化−抗氧化失衡[38],导致CAT的活性显著下降。另外,有研究认为,氧化应激产生的活性氧和过氧化物激活NF-KB 和NF-KB 介导的炎症通路[39],诱导多种炎症因子的产生,而这些因子反过来又会刺激NF-KB 介导的炎症通路,使得炎症反应呈现级联发达效应,从而导致严重的肝脏损伤,但具体的反应机制还需要进一步的研究证明。
LZM 是鱼类血液中非特异性免疫因子之一,是吞噬细胞杀灭吞噬病原菌的基础,能够水解细菌细胞壁中的乙酰氨基多糖,从而破坏和消除侵入体内的异物,其活性的高低能够反映溶菌活性的强弱,担负着机体的防御功能,能够反映机体的免疫状态[40−41]。Wang等[42]在研究中发现,鱼类在环境中溶氧下降之后会通过迅速改变机体的生化指标来提高免疫力,这是一种适应环境压力的调节机制。本文中军曹鱼幼鱼在低氧胁迫的第1 天,血清LZM 活性也显著升高,说明军曹鱼幼鱼通过调节机体的LZM 活性,提高自身的免疫力,以适应低氧的环境。这与武昌鱼(Megalobrama amblycephala)在低氧胁迫后LZM 活性上升的现象一致[43]。但是低氧胁迫的第7 天,LZM 的活力不断下降,并且在第14 天和第28 天显著低于对照组。刘淑兰和翟少伟[38]的研究表明,应激的时间持续延长时,过度分泌的激素会抑制机体的免疫能力,免疫因子和免疫细胞活性降低,表明长时间的低氧,不仅造成组织损伤,影响机体的代谢水平,还可能会对免疫系统造成影响,致使免疫力下降。
综上,低氧胁迫对军曹鱼幼鱼造成一定程度的氧化损伤,抑制其生长并使血清生化和非特异性免疫相关指标发生显著变化,表明军曹鱼机体物质代谢和免疫系统受到影响。因此在军曹鱼的养殖过程中要避免长时间的低氧胁迫,保持水体溶氧充足。

