小麦网腥黑穗病温室内人工接种方法的探索
秦丹丹 王俊 高海峰 李宁静 吴伟 刘太国 陈万权 高利

摘要 :小麦网腥黑穗病是由小麦网腥黑粉菌Tilletia caries引起,会导致小麦严重减产。为了获得小麦网腥黑穗病较高的发病率,本研究利用穗部接菌、土壤接菌、根部接菌3种方法进行温室内人工接种小麦。结果表明,利用穗部接菌及土壤接菌发病率分别为52.5%和10%,而根部接菌发病率仅有4%。利用穗部接菌可以获得更多的发病植株,为更好地研究寄主与病原的互作关系奠定了基础。
关键词 :小麦网腥黑粉菌; 人工接菌; 温室; 发病率
中图分类号: S 435.121.44
文献标识码: A
DOI: 10.16688/j.zwbh.2019563
Exploring of the artificial inoculation methods of Tilletia caries
QIN Dandan1, WANG Jun2, GAO Haifeng3, LI Ningjing2, WU Wei4,LIU Taiguo1, CHEN Wanquan1, GAO Li1*
(1. State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy
of Agricultural Sciences, Beijing 100193, China; 2. Plant Protection Station of Xinjiang
Uygur Autonomous Region,
Urumqi 830049, China; 3. Institute of Plant Protection, Xinjiang Academy of Agricultural Sciences, Urumqi 830091,
China; 4. Agricultural Technology Promotion Station of Xinyuan County, Xinjiang, Yili 835800, China)
Abstract :Tilletia caries can lead to common bunt of wheat and it can causes severe wheat yield reduction. In order to obtain the diseased plants of T.caries, three methods including tassel inoculation, soil inoculation and root inoculation were used to artificially inoculate in greenhouse. The results showed that disease incidence with tassel inoculation and soil inoculation was 52.5% and 10%, but the disease incidence with root inoculation was only 4%. More diseased plants can be obtained by using tassel inoculation, which lays a foundation for better research on the interaction between the host and the pathogen.
Key words :Tilletia caries; artificial inoculation; greenhouse; diseaseincidence
小麦腥黑穗病是世界性病害,在春小麦及冬小麦上都有发生,遍布世界小麦种植区[1]。在我國常见的是Tilletia caries (DC.) Tul. & C. Tul.引起的小麦网腥黑穗病和Tilletia foetida (Wall.) Liro引起的小麦光腥黑穗病。小麦网腥黑穗病主要发生在江苏、山西、山东、河南等地,被黑龙江、山东、河南、天津等多省市列为补充植物检疫性有害生物[2]。在小麦成熟期,病穗中几乎都是呈籽粒状的孢子团(菌瘿),成熟的孢子团全部由冬孢子组成并被薄且修饰过的子房壁包被形成典型的菌瘿,菌瘿比正常小麦的籽粒圆、大[3]。小麦成熟末期,干燥的菌瘿呈近球形,破碎后的冬孢子呈块状[46]。感染腥黑粉菌之后的小麦麦粒散发臭鱼腥味,并且释放出有毒的三甲胺类物质,严重影响小麦品质,给小麦生产带来巨大损失[79]。目前国内对于小麦网腥黑穗病的研究较少,探究温室条件下人工接种获得发病植株的方法,对于研究该病菌的致病性及与寄主的互作机理具有重要意义。
1 材料与方法
1.1 供试材料
小麦网腥黑粉菌及供试小麦品种‘东选3号由中国农业科学院植物保护研究所提供。
1.2 小麦网腥黑粉菌冬孢子的萌发培养
干燥的病穗于室温条件下保存。于病穗采集后20、30 d和40 d分别进行萌发试验。冬孢子的萌发率均超过90%,表明冬孢子活性良好。将4~6个小麦网腥黑粉菌菌瘿(视菌瘿大小而定)放入一个2 mL的离心管中,加入2 mL灭菌水并经150目纱布过滤掉杂质,制成冬孢子悬浮液。浸泡24 h后将冬孢子悬浮液10 000 r/min离心1 min去上清液,加入2 mL 0.25% NaClO溶液消毒5 min,不定时轻摇以保证处于混匀状态。离心后弃上清液并加入2 mL无菌水,重复洗涤3次获得最终的悬浮液。利用血球计数板在光学显微镜(Leica S6D,德国)下测定并计算冬孢子悬浮液的浓度,适当稀释后将冬孢子浓度调节至106个/mL的数量级备用[10]。
按1%的比例在冷却至40~50℃的水琼脂培养基(规格为2 000 mL的烧杯中加入16 g琼脂,加蒸馏水定容至1 L,分装后121℃高压蒸汽灭菌20 min)中混入青霉素、链霉素双抗并倒板,每个培养皿中加200 μL 106个/mL冬孢子悬浮液,用灭菌的涂布棒涂布均匀并封口。所有平板置于16℃、光照300 μmol/(m2·s)、相对湿度50%的人工培养箱(MLR352H, 日本)中培养。
1.3 供试小麦的春化处理
将小麦种子浸泡催芽24 h,用30%的NaClO溶液表面消毒1~5 min,以杀灭种子表面携带的病原菌,然后用灭菌水冲洗小麦种子直至无味。将过夜催芽的种子置于玻璃培养皿中,用湿润的纱布覆盖保湿,用锡纸包裹于4℃光照培养箱(HYC360, 海尔中国)中避光春化4周,直至胚芽鞘长至1~3 cm。
1.4 供试小麦的种植
将春化好的麦苗种于盛有灭菌土的直径20 cm的花盆中,深度约3 cm,每盆种10株,置于超低温植物生化培养箱(LT36VL, Percival, 美国)中24 h全光照培养,光照强度为300 μmol/(m2·s)。种苗初期,培养箱内的温度控制在10~12℃,7 d后,待幼苗稳定后温度可调整为15~17℃,当小麦苗生长至孕穗期时生化培养箱内的温度可调节为20~25℃,每天保持水分供应,防止低温和干旱对小麦穗部发育的影响,定时观察麦苗的长势。
1.5 小麦网腥黑粉菌室内人工接种方法研究
1.5.1 穗部接菌法
制备菌丝悬浮液:将培养7 d的T.caries平板置于全自动倒置研究级显微镜(IX83, OLYMPUS, 日本)下观察冬孢子萌发情况。挑取长出侵染菌丝的平板,每个培养皿加入5 mL灭菌水刮取菌丝,在600 nm波长下检测溶液OD值,用蒸馏水调整OD600为0.1~0.2,用于接菌[11]。
穗部接种:待小麦苗孕穗期开始时,即小麦旗叶叶片全部从倒二叶叶鞘内伸出时用注射器将1 mL菌丝悬浮液注射入小麦植株旗叶与幼穗之间的空腔内,连续接种5 d,共接菌40株小麦,待小麦成熟后统计发病率。
1.5.2 土壤接菌法
种植已春化的麦苗,种植3 d后用注射器吸取T.caries菌丝悬浮液(菌丝悬浮液的制备同穗部接菌法)注射到小麦苗根部土壤中,对40株小麦进行土壤接菌,每天注射2 mL,连续注射5 d,待小麦成熟后统计发病率,每株小麦无论主穗或分蘖穗发病均视为该株小麦成功发病,主穗及分蘖穗均未发病则视该植株未发病。
1.5.3 根部接菌法
用30%的NaClO溶液对浸泡催芽的小麦种子消毒后,于无菌操作台中将40粒小麦种子分4组置于有70% T.caries冬孢子萌发的平皿上,将胚芽鞘一面与菌丝充分接触,每个平皿放10粒种子,进行根部接菌,密封好后置于4℃条件下边侵染边春化。4周后将春化好的小麦苗种在灭过菌的土壤中,待小麦成熟后统计发病率(统计方法同土壤接菌法)。
2 结果与分析
2.1 小麦网腥黑粉菌的人工接种体系
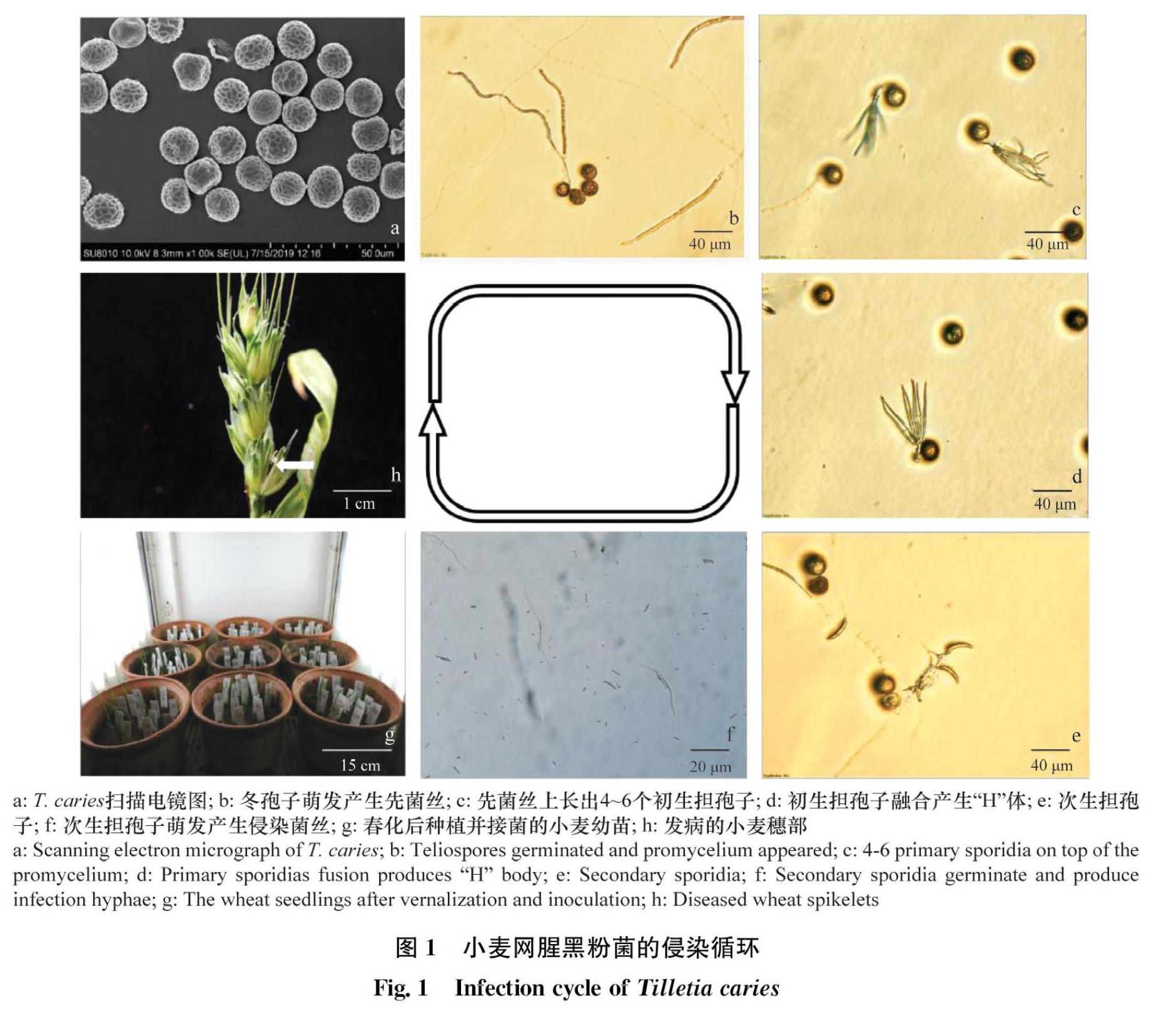
通过扫描电镜确认该菌为小麦网腥黑粉菌(图1a)。小麦网腥黑粉菌冬孢子在水琼脂培养基上进行培养,2 d后利用全自动倒置显微镜观察其萌发过程,发现培养3 d后冬孢子萌发产生先菌丝(图1b),然后在先菌丝顶部长出大量伞状的初生担孢子(图1c),形成密集的一束,随后相反交配型的初生担孢子融合形成“H”体(图1d),致病的双核期开始。“H”体产生大量的腊肠状次生担孢子(图1e),随后次生担孢子萌发产生大量侵染菌丝(图1f),此时的侵染菌丝致病力较强,收集该时期的菌丝用于接种小麦(图1g),小麦成熟后可观察到整个籽粒充满了黑色冬孢子(图1h)。
2.2 室内人工接种方法的研究
人工接种后发病的小麦植株高度同正常植株相比无明显变化,菌丝成功侵染后小麦子房呈现深绿色,而健康的子房呈浅绿色,发病植株颖壳外张,露出黑色的籽粒(图1h),小麦籽粒组织被黑粉取代形成菌瘿,菌瘿碾碎后散发出鱼腥味。不同的接種方法植株的发病率不同,利用穗部接菌法可以获得52.5%的发病植株,利用土壤接菌法和根部接菌法分别获得了10%和4%的发病植株(表1)。因此,通过穗部注射菌丝悬浮液可以获得更多的发病植株。
3 讨论
小麦网腥黑粉菌萌发的最佳温度范围为14~16℃,最适宜温度为16℃,在此条件下4 d就可以萌发,温度太高或太低、湿度太大或太小都会对冬孢子的萌发产生影响[12]。姚卓等通过室内接菌成功获得了小麦矮腥黑粉菌的发病植株,并研究出小麦矮腥黑粉菌萌发最适的冬孢子悬浮液浓度为1×106个/mL[10]。本试验以上述条件作为参考,在短时间内获得了T.caries的菌丝悬浮液,提高了试验效率。国内学者从土壤湿度[13]、温度敏感性[14]、无积雪条件下发病状况[15]等方面,研究并确定了影响小麦矮腥黑粉菌萌发和生长的环境条件。国外学者研究发现深播条件下普通腥黑穗病(由小麦光腥黑粉菌和小麦网腥黑粉菌引起的黑穗病统称普通腥黑穗病)发病率明显高于浅播;播种在温暖的土壤中,普通腥黑穗病的发病率会显著降低[1617]。试验中土壤接菌时选择在苗期进行,是因为在其生长前期根未扎深时菌丝与小麦根部能够充分接触。
本试验土壤接菌法仅获得了10%的侵染率,可能是由于土壤的pH、湿度等条件限制菌丝的活性,导致菌丝未能侵染到小麦的生长点;或者菌丝的侵染期与小麦的感病期不一致,导致菌丝无法成功侵染;有研究表明,在植株分蘖开始时或者仅有几个分蘖时对小麦矮腥黑粉菌最敏感[18],本试验土壤接菌法侵染率低的原因可能是随着小麦的生长,根深扎在土壤中,而用注射器接菌时菌液注入在土壤表层无法深入。根部接菌法侵染率较低的原因可能是菌丝与根的接触面积不够,根在平板上生长过程中会伸到琼脂下层,导致琼脂表面的菌丝无法与根接触,从而无法成功侵染。而穗部接菌法采用的是在孕穗期注射菌丝悬浮液,使得穗部组织与菌丝能充分接触,摆脱了土壤条件对菌丝侵染的限制,从而获得了较高的发病率。
传统的方法是将小麦种子与冬孢子粉混合,加入甲基纤维素溶液增加冬孢子黏性来接种;Gaudet等将冬孢子与土壤混合(4 g冬孢子/100 cm3土壤),每米行长施用4 cm3,然后在该土壤上种植小麥进行接种[19]。以上接菌方法易受土壤条件的限制,导致冬孢子萌发率低,从而降低了菌丝的侵染率。本试验的穗部接种法菌丝与穗部直接接触,摆脱了土壤环境对冬孢子萌发的限制,获得了更多的发病植株。因此,利用穗部接菌法可以提高接种的发病率,且操作简便易行,需要的菌量明显少于土壤接菌法,可减少工作量,缩短试验周期。本文结果为更好地研究寄主与病原的互作关系奠定基础,对揭示病原物致病性的遗传基础和深入了解致病基因的表达方式有十分重要的意义。
参考文献
[1] 郭同军, 邢巍婷, 石庆华, 等. 小麦网腥黑粉菌冬孢子总DNA提取方法比较[J]. 生物技术, 2007(5):3538.
[2] 刘刚. 全国部分省市发布新的补充农业植物检疫性有害生物名单[J]. 农药市场信息, 2010(4):50.
[3] HOFFMANN J A. Bunt of wheat [J]. Plant Disease, 1982, 66(11):979986.
[4] WILCOXSON R D, SAARI E E. Bunt and smut diseases of wheat: concepts and methods of disease management [R]. Centro Internacional de Mejoramiento de Maizy Trigo (CIMMYT), 1996.
[5] TYLER L J, JENSEN N F. Some factors that influence development of dwarf bunt in whiter wheat [J]. Phytopathology, 1958, 48:565571.
[6] MCNEIL M, ROBERTS A M I, COCKERELL V, et al. Realtime PCR assay for quantification of Tilletia caries contamination of UK wheat seed [J]. Plant Pathology, 2010, 53(6):741750.
[7] YOUNG P A. A new variety of Tilletia tritici in Montana [J]. Phytopathology, 1935, 25:40.
[8] TRIONE E J, HESS W M, STOCKWELL V O. Growth and sporulation of the dikaryons of the dwarf bunt fungus in wheat plants and in culture [J]. Canadian Journal of Botany, 1989, 67(6):16711680.
[9] MATHRE D E. Dwarf bunt: politics, identification, and biology [J]. Annual Review of Phytopathology, 1996, 34:6785.
[10]姚卓, 陈万权, 高利, 等. 小麦矮腥黑粉菌冬孢子萌发和室内人工接种方法的探索[J]. 植物保护, 2014, 40(3):122126.
[11]臧宪朋, 徐幼平, 蔡新忠. 一种基于菌丝悬浮液的核盘菌(Sclerotinia sclerotiorum)接种方法的建立[J]. 浙江大学学报(农业与生命科学版), 2010, 36(4):381386.
[12]GOATES B J, HOFFMANN J A. Nuclear behavior during teliospore germination and sporidial development in Tilletia caries, T.foetida, and T.controversa [J]. Canadian Journal of Botany, 1987, 65:512517.
[13]贾文明, 周益林, 段霞瑜, 等. 土壤湿度对小麦矮腥黑穗病菌(T. controversa)冬孢子萌发的影响[J]. 植物保护, 2006, 32(6): 4851.
[14]江辉, 周益林, 段霞瑜. 小麦矮腥黑穗病菌对温度的敏感性[J]. 植物保护, 2012, 38(2):120123.
[15]王圆, 俞晓霞. 小麦矮腥黑穗病在无积雪条件下发病的研究[J]. 植物检疫, 1996(3):1214.
[16]PURDY L H, KENDRICK E L, HOFFMANN J A, et al. Dwarf bunt of wheat [J]. Annual Reviews in Microbiology, 1963, 17(1):199222.
[17]GAUDET D A,PUCHALSKI B J. Influence of planting dates on the aggressiveness of common bunt races(Tilletia and T. laevis) to Canadian spring wheat cultivars [J]. Canadian Journal of Plant Pathology, 1990, 12(2):204208.
[18]HOFFMANN J A, PURDY L H. Effect of stage of development of winter wheat on infection by Tilletia controversa [J]. Phytopathology, 1967, 57(4):410413.
[19]GAUDET D A, PUCHALSKI B J, ENTZ T. Effect of environment on efficacy of seedtreatment fungicides for control of common bunt in spring and winter wheat [J]. Pesticide Science, 1989, 26(3): 241252.
(责任编辑:杨明丽)

