运动预处理对脑缺血再灌注大鼠VEGF、NeuN 蛋白表达的影响
裴 飞,王雪冬,李宝龙,唐 强,朱路文
1 黑龙江中医药大学附属第二医院,黑龙江 哈尔滨150001;
2 黑龙江中医药大学针灸推拿学院暨康复学院,黑龙江 哈尔滨150001
* 通信作者:朱路文,E-mail:zhuluwen1983@126.com
缺血性脑卒中是神经功能障碍的主要原因,给患者、护理人员,以及社会带来重大负担。 对于缺血性脑卒中主要采用药物以及针灸、推拿、运动等康复手段治疗,尤其是运动康复疗法在临床中对于缺血性脑卒中有很好的治疗效果。 朱路文等[1]研究表明脑缺血后神经功能恢复的加快可能通过针康法(头穴丛刺长留针结合现代康复方法)上调缺血脑组织血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达而实现;孙国剑等[2]也发现电针疗法与运动训练都能够提高缺血再灌注大鼠大脑皮层中VEGF mRNA 表达量,而且两者结合效果更好。 运动预处理目前也是研究的热点,动物研究表明,运动预处理对脑缺血有益的作用,包括提高存活率、减轻氧化损伤、改善脑血流量和维持神经血管完整性[3-5],但是没有研究证明运动预处理对于脑缺血再灌注大鼠VEGF、神经元核心抗原(neuronal nuclear antigen,NeuN)的影响。 因此,本实验欲探讨运动预处理对于脑缺血再灌注大鼠VEGF、NeuN 的影响,从而为脑卒中的预防机制提供动物实验依据。
1 材料与方法
1.1 动物及分组
1.1.1动物 健康清洁级Sprague-Dawley 雄性大鼠96 只,购自辽宁长生生物技术股份有限公司,实验动物许可证号为SCXK(辽)2015-0001,体质量(220±20) g,月龄3 个月。 饲养条件:SPF 级实验中心,安静环境、室温20~25 ℃,湿度为50%~60%,清洁级饲养,12 h 明暗光照交替,昼夜循环,通风良好,大鼠自由进食进水,每日固定点喂食。
1.1.2 分组 采用随机数字表法将大鼠随机分为假手术组、模型组、运假组(运动预处理与假手术组)和运模组(运动预处理与模型组),每组24 只。 每组按再灌注24 h、3 d 后又分为2 个亚组,每个亚组12 只。实验所有大鼠处置方法均符合小动物伦理。
1.2 主要器材和试剂
动物实验跑台(安徽正华生物仪器设备有限公司);CX41RF 显微镜(OLYMPUS 公司);HM525NX U冷冻切片机和Excelsior AS 自动组织脱水机(上海赛默飞世尔仪器有限公司);WB 系统(BIO-RAD 公司);VEGF(Affinity Biosciences,Ab-AF5131);NeuN(Affinity Biosciences,Ab-DF6145);二抗:山羊抗兔IgG(北京中杉金桥生物技术有限公司,ZB-2301);Actin(bioss,bs-0061R);4%多聚甲醛PBS 溶液(安徽雷根生物技术有限公司)。
1.3 方法
1.3.1模型制备 模型组和运模组大鼠术前12 h禁食不禁水,采用Longa 改良线栓法制备大鼠大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)模型,2 h 后将线栓缓慢拔出至颈总动脉主干分叉处。6 h 后采用改良的Bederson 标准进行神经功能初步评分,即:①0 分,无神经功能缺失体征;②1 分,提尾时损伤对侧前肢屈曲;③2 分,前肢屈曲及对侧抵抗力下降;④3 分,向对侧转圈;⑤4 分,向对侧转圈及意识障碍。 评分为1~3 分的大鼠纳入本次实验。 假手术组和运假组大鼠造模方法同上,但线栓仅从颈总动脉插入约10 mm 以后即拔出,不能阻塞大脑中动脉血流供应。
1.3.2处理方法 模型组与假手术组不给予任何治疗。 运模组和运假组给予跑台训练,先给予适应性跑台训练,速度10 m/min,每天训练20 min,持续3 d;正式性跑台训练:速度15 m/min,每天训练30 min,坡度为0,每周训练6 d,连续训练3 周。 运模组和运假组正式训练3 周以后,4 组大鼠同时进行造模处理,分别在再灌注24 h、3 d 后对指标进行观察及取材。
1.4 检测指标及取材
1.4.1改良神经功能评分(modified neurologic severity score,mNSS) 参照文献[6],分别在再灌注24 h、3 d 后进行检测,包括:①运动测试:包括提尾测试和行走测试;②感觉测试:包括放置测试和本体感觉测试;③平衡木测试;④反射消失和异常运动:包括耳廓反射,角膜反射,惊恐反射,癫痫、肌阵挛、肌张力异常4 个方面评估大鼠神经功能缺损程度,总分越高表明损伤程度越重。
1.4.2取材及标本处理 再灌注24 h、3 d 以后,每组取6 只大鼠,大鼠以10%水合氯醛腹腔注射麻醉,从心尖以4%多聚甲醛磷酸盐(PBS)缓冲液(pH=7.4,4 ℃)进行缓慢灌注后快速断头取脑。 分离缺血侧脑组织,然后放入4%多聚甲醛PBS 溶液中固定48 h 后,取视交叉和其后4 mm 处两点,切取脑冠状薄片,厚度约4 mm,脱水,常规石蜡包埋。
再灌注24 h、3 d 以后,对各组其余的6 只大鼠以10%水合氯醛腹腔注射麻醉,快速取缺血侧鲜脑皮层,置于液氮中快速降温,然后迅速放入-80 ℃冰箱中冻存备用。
1.4.3免疫组化染色检测VEGF 表达情况 将每组大鼠脑组织石蜡切片,切片厚度为3~5 μm 粘附在防脱玻片上,56~60 ℃烤片2 h。 脱蜡至水,高温抗原修复,PBS 冲洗3 min×3 次,滴加内源性过氧化物酶阻断剂,PBS 冲洗3 min×3 次,滴加山羊血清封闭液,37 ℃30 min。 加VEGF 一抗(1∶100),4 ℃过夜。恢复至室温后,PBS 冲洗3 min×3 次。滴加即用型山羊抗兔二抗,室温孵育20 min,PBS 冲洗3 min×3 次,DBA 显色5~10 s,水洗终止;苏木素复染20 s,梯度乙醇脱水,二甲苯透明,封片。显微镜在10×40倍下对视野中VEGF 阳性率表达观察,Image-Pro Plus 软件行图像分析,计算目的蛋白表达面积与组织总面积的比率,取平均值进行统计分析。
1.4.4Western blot 测定NeuN 蛋白表达水平 将脑组织从-80 ℃冰箱中取出,按每0.1 g 脑组织加1 mL 组织蛋白裂解液至玻璃匀浆器匀浆好的组织当中,充分混匀后,采用去垢剂兼容型考马斯亮蓝蛋白定量试剂盒定量检测各标本总蛋白浓度。 每组取20 μg 蛋白裂解液制样,①电泳:包括制备SDS聚丙烯酰胺凝胶,本次实验浓缩胶浓度5%,分离胶浓度12%,灌胶,上样。 ②蛋白电泳:将电泳仪调至恒压100 V 后开始电泳,待指示剂进入分离胶后,调整电压120 V 继续电泳,待蓝色指示条接近凝胶底部后停止电泳。 ③转膜:将凝胶按照阳极、海绵垫、滤纸、PVDF 膜、凝胶、滤纸、海绵垫、阴极的顺序夹入转膜夹中,然后将转膜夹按照正负极装配到转膜槽中,连接好正负极,将电泳仪调至恒流200 mA 转膜2 h,此时的蛋白已从凝胶转移至PVDF 膜上。④封闭:将有目的蛋白的PVDF 膜浸泡在TBST 配制的5%脱脂牛奶中,室温下在垂直脱色摇床上封闭1 h。相继加NeuN 一抗(1∶500)、二抗(1∶5 000)孵育进行免疫反应,取出PVDF 膜浸入PBST 中,摇床摇动10 min,重复3 次,加ECL 发光液,显色曝光。 结果采用Quantity One 图像分析软件进行定量分析等量的样品蛋白灰度值,以各组NeuN 与内参Actin 灰度比值即为相对灰度,再除以假手术组相对灰度作为统计指标。
1.5 统计学方法
采用SPSS 22.0 软件进行统计分析。 数据符合正态分布采用(±s)表示,多组的组间比较采用单因素方差分析,两两比较在方差齐性的情况下用LSD-t法进行后效检验,方差不齐的情况下用Tamhane'sT2 方法进行事后检验。P<0.05 为差异具有统计学意义。
2 结 果
2.1 神经功能缺损评估
假手术组和运假组均未出现神经功能缺损表现。 与模型组比较,运模组在再灌注24 h 后神经功能缺损评分降低(P<0.05);与模型组比较,运模组在再灌注3 d 后神经功能缺损评分降低(P<0.05)。评分越低,损伤程度越轻。 见表1。
表1 4 组大鼠不同时间mNSS 评分比较(±s) 分Table 1 Comparison of mNSS scores in four groups of rats at different times (±s)Scores
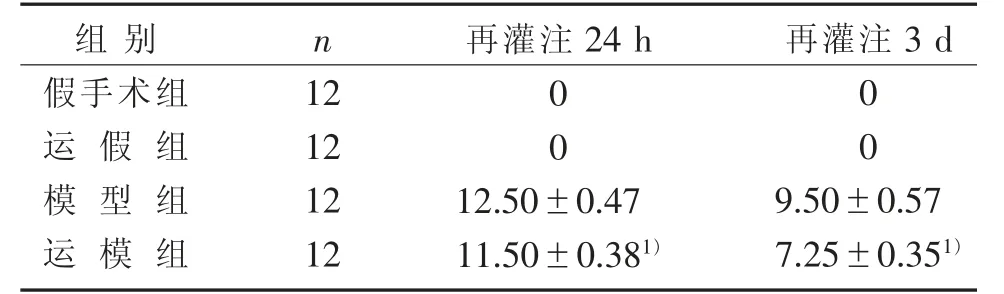
表1 4 组大鼠不同时间mNSS 评分比较(±s) 分Table 1 Comparison of mNSS scores in four groups of rats at different times (±s)Scores
注:与模型组比较,1) P<0.05。Note: Compared with the model group, 1) P<0.05.
组别假手术组运 假 组模 型 组运 模 组n 再灌注24 h 再灌注3 d 12 12 12 12 00 00 12.50±0.47 11.50±0.381)9.50±0.57 7.25±0.351)
2.2 免疫组化染色VEGF 表达
脑组织半暗带区,VEGF 免疫组织化学染色中的棕褐色或棕黄色颗粒沉着在细胞浆和包膜及细胞周边区,在脑组织的神经元、胶质细胞和内皮细胞均可表达。 再灌注24 h 后,假手术组可见少量的血管内皮生长因子VEGF 表达,阳性细胞胞体小,突起细,阳性率较低。 见表2、图1 和图2。
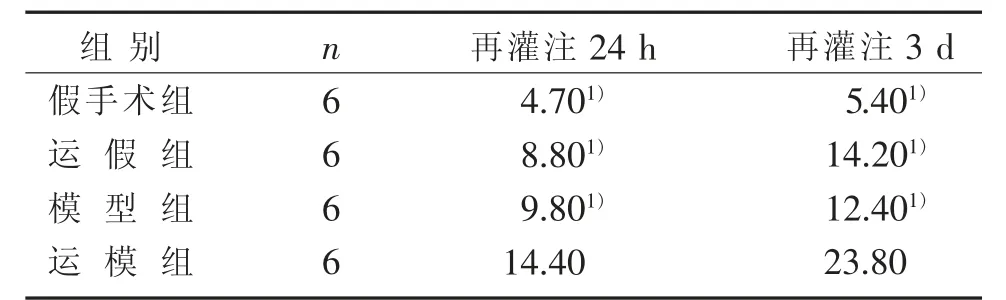
表2 4 组大鼠不同时间VEGF 表达比例%Table 2 The ratio of VEGF expression in four groups of rats at different times%

图1 4 组脑缺血再灌注24 h 后缺血侧VEGF 表达(×400)Figure 1 VEGF expression in four groups on ischemic side 24 hours after cerebral ischemia reperfusion (×400)

图2 4 组脑缺血再灌注3 d 后缺血侧VEGF 表达(×400)Figure 2 VEGF expression in four groups on ischemic side 3 days after cerebral ischemia reperfusion (×400)
2.3 NeuN 蛋白的表达水平
NeuN 蛋白的Western blot 结果显示,再灌注24 h后运模组与模型组都有下降,运模组下降程度相比模型组较少;再灌注3 d 后都有升高,运模组升高程度相比模型组较多。 再灌注24 h 和3 d 后,运模组分别与假手术组、模型组、运假组比较,差异有统计学意义(P<0.05)。 见图3 和图4。
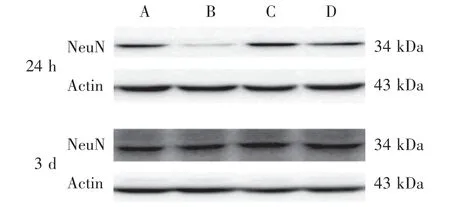
图3 4 组大鼠脑缺血周边区NeuN 蛋白表达Figure 3 NeuN protein expression in the peripheral area of cerebral ischemia in four groups of rats
3 讨 论
在“针康同步、动态治疗、整体康复”的脑卒中康复思想“针康法”指导下[7],本课题组前期研究做了大量关于动物实验以及临床研究[8],表明针康法促进缺血区周围皮质突触可塑,降低脑缺血后神经元的损伤,加速神 经功能 重建[9];抑制神 经元凋亡[10],保护神经元;促进血管新生[11-12];降低炎性损伤程度[13]等。 总之,针康法对微血管、神经元、胶质细胞的保护不是单一的,而是整体上调控,从而促进脑缺血后神经血管单元功能重塑[14]。 另外,针康法也强调脑卒中预防的重要性,研究表明运功预处理可改善脑缺血再灌注大鼠血脑屏障通透性,具有脑保护作用[15];电针预处理降低炎症反应,减少细胞凋亡[16],炎症反应在缺血性脑卒中的发生和发展中扮演着重要的角色,参与病理损伤的全过程[17]。
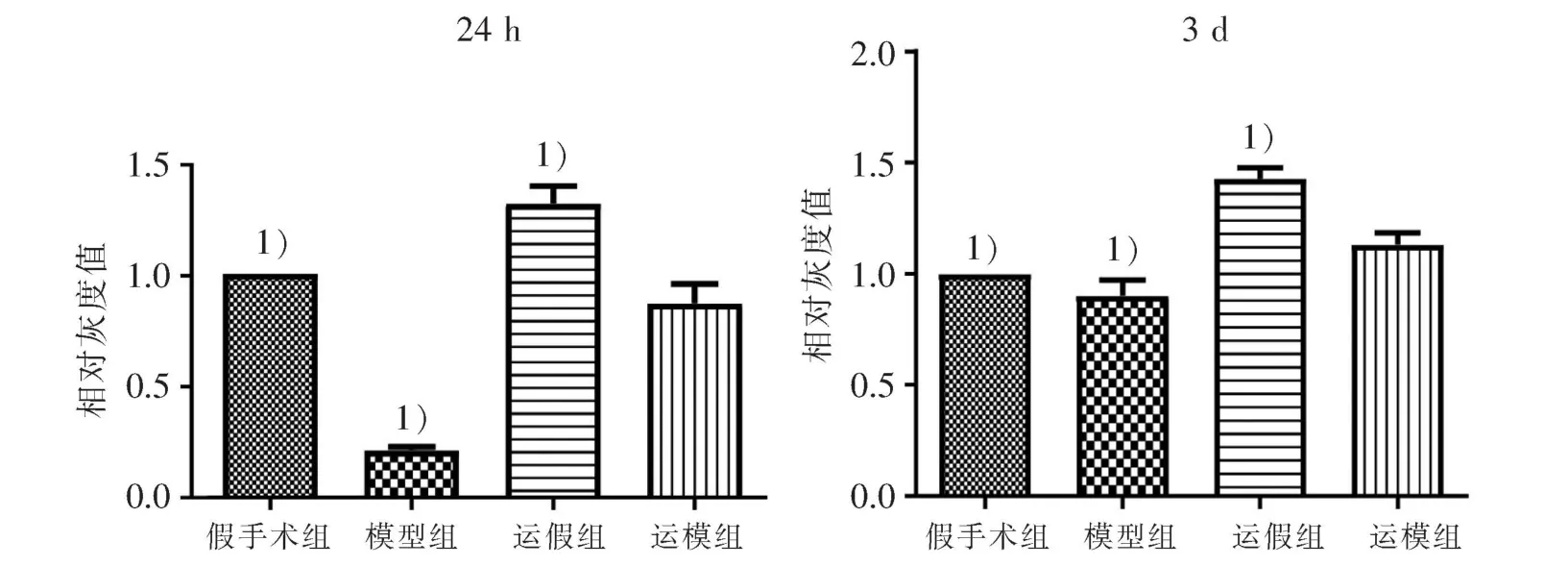
图4 4 组大鼠脑缺血周边区NeuN 蛋白灰度值比较Figure 4 Comparison of the gray value of NeuN protein in the cerebral ischemic peripheral area in four groups of rats
本研究结果发现,脑缺血再灌注3 d 后VEGF表达更多,3 d 时运模组在缺血周边区的表达明显高于模型组、运假组和假手术组,这一结果提示运动预处理促进了VEGF 表达,脑缺血再灌注以后也会促进VEGF 表达,而同样在脑缺血再灌注的条件下,运动预处理组的大鼠VEGF 表达更多,神经功能缺损表现更低;脑缺血再灌注3 d 以后NeuN 蛋白表达明显增多,神经功能缺损表现也更低。 在实验中也发现运假组在脑缺血再灌注3 d 后,VEGF、NeuN 蛋白表达都有增高,考虑主要是运动预处理促进了相关蛋白表达。
目前对于运动预处理的作用机制有很多研究,其主要在于在反复的运动中,出现短暂的、轻微的脑缺血可有效诱导缺血/缺氧耐受,导致具有调节神经环境、再生过程、神经细胞凋亡和氧化应激等作用,另外也有围绕血流动力学和血管内皮功能,诱导VEGF 信号[18]。 VEGF 为血管内皮细胞增殖和迁移以及血管通透性的关键调节因子[19]。 有文献报道,VEGF 及受体是血管生成中特异、有效的作用元素,在血管生成中具有重要的意义,而VEGF 表达的主要刺激因素为血流量增加、内皮剪应力增加、氧化代谢增强等[20],VEGF 在运动诱导血管生成和增加脑侧支循环中的作用需要反复进行中、高强度的运动训练[21]。另有研究报道,Fc-axatilin 通过调节下游信号通路减弱VEGF 诱导的内皮通透性,这可能有助于其对缺血性脑血管渗漏的保护作用[22]。 基质金属蛋白酶-9、VEGF 参与了脑梗死的发生、发展过程,在缺血性脑卒中其具有重要的临床意义[23-24]。
NeuN 是一种核蛋白,在成熟神经元胞核中表达,是一种特异的神经元标志物,神经元的成熟与NeuN 的表达量成正相关性,因此作为神经元的标记物[25]。金媛媛等[26]观察到脑缺血后,缺血区NeuN 阳性细胞减少。 因此,本研究采用中等强度跑步训练,观察运动预处理对于脑缺血再灌注后VEGF、NeuN的影响。
临床研究表明,运动训练可以提高老年人的脑血管反应性,增加健康老年人大脑中的小血管数目,并减少血液流变特性的异常[27-28]。 纠正心脑疾患危险因素的重要方法即为运动疗法,其在心脑血管疾病一级和二级预防中起着重要作用[29]。 缺血性脑卒中的危险因素有效管理对于降低脑卒中的复发率是很重要的[30],社会支持是患者应对疾病的有效资源之一[31],然而目前公众对健康生活方式的认识和对危险因素的控制仍然不是最理想的[32]。 本研究结果表明,脑缺血再灌注前给予运动预处理可减少脑缺血再灌注以后的脑损伤程度,通过增强VEGF、NeuN 蛋白的表达,从而改善感觉运动功能障碍和运动行为。 本实验进一步证明临床中运动预处理对于脑卒中的预防机制,从而提供具有脑卒中风险人群预防的依据。

