片仔癀通过抑制TLR4/MAPK 信号通路减轻LPS诱导的BV2 小胶质细胞神经炎症损伤研究
黄贞伟,张 庆,黄莉莉,张小琴,黄鸣清
福建中医药大学药学院,福建 福州350122
* 通信作者:张小琴,E-mail:2012030@fitcm.edu.cn;黄鸣清,E-mail:hmq1115@126.com
缺血性脑卒中是一种急性脑血管疾病,可导致偏瘫,甚至死亡,影响人们生活质量,加重社会负担[1]。小胶质细胞是中枢神经系统中一种固有的免疫细胞,在缺血性脑卒中发生、发展过程中过度活化的小胶质细胞引发神经炎症反应,进而损伤脑组织[2]。Toll 受体4(TLR4)是Toll 样受体家族中的一员,是脂多糖(lipopolysaccharide,LPS)的关键受体之一,其在脑内主要分布于小胶质细胞,可参与炎症相关信号通路的转导[3]。 丝裂原活化蛋白激酶(MAPKs)是一种丝氨酸-苏氨酸蛋白激酶,主要包括细胞外信号调节蛋白激酶(ERK1/2)、c-Jun 氨基末端激酶(JNK)和p38 丝裂原活化蛋白激酶(p38 MAPK),可参与调节多种生理活动,与细胞炎症反应密切相关[4]。 既往研究表明,TLR4/MAPK 信号通路在缺血性脑卒中引发以及LPS 诱导的小胶质细胞神经炎症反应中均发挥重要作用[5-6]。
片仔癀(Pien Tze Huang,PZH)是我国一种名贵中成药,由麝香、牛黄、三七、蛇胆等名贵药材精制而成,具有清热解毒、凉血化瘀、消肿止痛等功效。现代药理研究也发现PZH 具有抗肿瘤、解热抗炎和脑保护作用[7-8]。刘丽星等[9]发现PZH 可降低大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)大鼠脑内IL-6 等促炎因子的表达水平,减轻脑卒中后神经炎症损伤。 本课题组前期研究也表明PZH可以抑制神经炎症反应,减轻脑缺血再灌注损伤[10]。以上提示PZH 具有抑制神经炎症反应的作用,但是PZH 是否通过TLR4/MAPK 信号通路改善小胶质细胞神经炎症损伤未见报道,因此本实验通过LPS建立BV2 小胶质细胞神经炎症损伤模型对此进行深入研究。
1 材料与方法
1.1 药品和主要试剂
PZH(漳州片仔癀药业有限公司);LPS、MTT(美国Sigma 公司);BCA 蛋白浓度检测试剂盒、ELISA试剂盒(武汉博士德生物工程有限公司);RPMI-1640 完全培 养 基(美国Gibco 公司);SDS-PAGE凝胶配制试剂盒(上海碧云天生物技术有限公司);ChamTM SYBR®qPCR Master Mix (南京Vazyme 公司)、逆转录试剂盒(美国Thermo公司);TLR4(美国SANTA CRUZ 公司);iNOS(美国abcam 公司);βactin、ERK1/2、p-ERK1/2、p38、p-p38、JNK、p-JNK、COX-2 和兔二抗(美国CST 公司)。
1.2 主要仪器
电子天平(瑞士梅特勒-托利多公司);光学显微镜、细胞培养箱(美国Thermo Fisher 公司);4 ℃离心机(德国Eppendorf 公司);酶标仪(瑞士TECAN公司);BIO-RAD 电泳仪、化学发光成像仪(美国BIO-RAD 公司);7900H 荧光定量PCR 仪(美国Applied Biosystems 公司)。
1.3 药物制备
将PZH 研磨至粉末状,称取一定量粉末,溶于含20% DMSO 的磷酸缓冲盐中,配制成浓度为25 mg/mL 的母液备用。
1.4 细胞培养
复苏BV2 小胶质细胞(中国典型培养物保存中心),培养于RPMI-1640 完全培养基(含10% 胎牛血清和1%青霉素-链霉素)中,置于37 ℃、5% CO2饱和湿度培养箱中培养,每天换液,隔天传代,供后续实验使用。
1.5 模型建立和分组
将处于对数生长期、状态良好的BV2 小胶质细胞接种于96 孔板,然后置于37 ℃、5% CO2的饱和湿度培养箱中继续培养12 h,再用LPS 刺激BV2小胶质细胞12 h,LPS 终浓度为100 ng/mL。实验分组:正常对照组,LPS 模型组(100 ng/mL),PZH 低剂量组(0.05 mg/mL PZH+100 ng/mL LPS),PZH中剂量组(0.10 mg/mL PZH+100 ng/mL LPS),PZH高剂量组(0.15 mg/mL PZH+100 ng/mL LPS)。
1.6 MTT 法检测BV2 小胶质细胞存活率
将BV2 小胶质细胞种于96 孔板,种板密度为5×104个/mL,每孔100 μL,设置6 个复孔,置于37 ℃、5% CO2饱和湿度培养箱培养。 MTT 实验分组:正常对照组,LPS 模型组(100 ng/mL),单独PZH组(0.05 mg/mL、0.10 mg/mL、0.15 mg/mL),PZH 低剂量组(0.05 mg/mL PZH+100 ng/mL LPS),PZH中剂量组(0.10 mg/mL PZH+100 ng/mL LPS),PZH高剂量组(0.15 mg/mL PZH+100 ng/mL LPS)。 培养12 h 细胞后更换新的培养基,按照组别加入对应的PZH 和LPS,再将孔板放入37 ℃、5% CO2饱和湿度培养箱继续培养12 h,然后取出96 孔板更换新的培养基,再加入MTT(5 mg/mL)10 μL,继续培养4 h 后吸弃培养基,加入150 μL DMSO,置于摇床振荡10 min,然后使用酶标仪测定490 nm 处吸光度(A 值),最后根据A 值计算细胞存活率。

1.7 显微镜下观察BV2 小胶质细胞形态变化
将BV2 小胶质细胞接种于24 孔板,种板密度为5×104个/mL,每孔500 μL,设置3 个复孔,置于37 ℃、5% CO2饱和湿度培养箱培育12 h 后更换新培养基,按照组别加入对应的PZH 和LPS,继续培养12 h 后取出,置于显微镜下观察各组细胞的形态并拍片。
1.8 ELISA 法检测细胞上清中促炎因子IL-6 的水平
细胞种板、造模和给药方法同“1.7”,然后收集细胞上清液,于4 ℃离心机离心(12 000 r/min)5 min,然后取上清。 按照ELISA 法测定说明书,依次加入样品/标准品、生物素化抗体、亲和素-过氧物酶复合物以及显色液,最后加入终止液后于450 nm 处测定吸光度,根据标准曲线计算各样品中IL-6 的含量。
1.9 RT-qPCR 法检测BV2 小胶质细胞中促炎因子IL-1β、IL-6 和TNF-α 转录水平
将BV2 小胶质细胞接种于6 孔板,种板密度为1.6×105个/mL,每孔2 mL,设置3 个复孔,置于37 ℃、5% CO2饱和湿度培养箱培育12 h 后更换新培养基,按照组别加入对应的PZH 和LPS,置于培养箱中继续培养12 h 后弃上清,用预冷的PBS 洗涤3 遍后加入TRIzol 提取总RNA,使用逆转录试剂盒制备cDNA,然后以该cDNA 为模板,使用扩增试剂盒进行扩增。 采用引物设计软件Primer 5 设计促炎因子IL-1β、IL-6、TNF-α 以及内参GAPDH 的引物序列。 PCR 扩增反应条件为:95 ℃预变性30 s,95 ℃变性10 s,退火60 ℃30 s,40 个循环。 相应引物序列见表1。
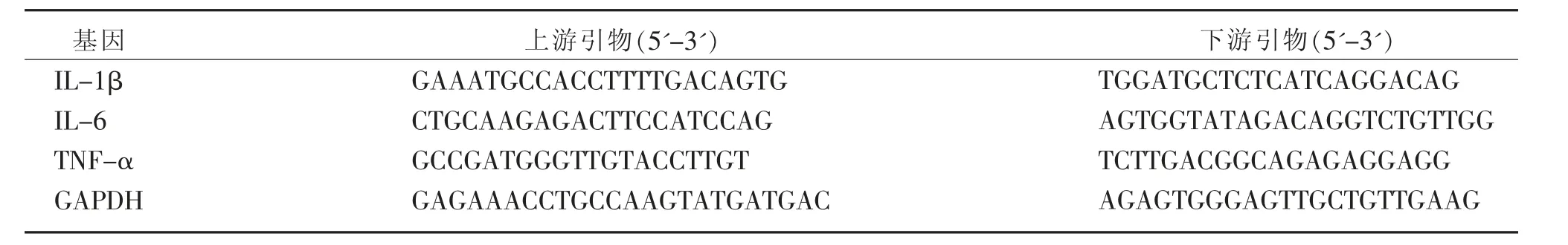
表1 IL-1β、IL-6、TNF-α 和GAPDH 基因引物序列Table 1 Primer sequences of IL-1β,IL-6,TNF-α and GAPDH genes
1.10 Western blot 法检测BV2 小胶质细胞中炎性蛋白酶COX-2 和iNOS 的水平
细胞种板、造模和给药同“1.9”,然后弃上清液,用预冷的PBS 洗涤3 遍后加入细胞裂解液提取总蛋白,用BCA 法测定蛋白浓度,再加入5%加样缓冲液,于100 ℃中煮10 min 制备蛋白样品。 每组取40 μg 蛋白样品,使用十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)分离蛋白,再将蛋白转至PVDF膜,然后置于脱脂奶粉(或BSA)中封闭1.5 h。 接着孵育一抗(COX-2、iNOS、β-actin)和相应二抗,再置于凝胶成像系统中显影,最后使用Image Lab 软件分析图像。
1.11 Western blot 法检测BV2 小胶质细胞中TLR4/MPAK 通路相关蛋白表达水平
蛋白样品制备方法同“1.10”。 每组取40 μg 蛋白样品,使用十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)分离蛋白,再将蛋白转至PVDF 膜,然后置于脱脂奶粉(或BSA)中封闭1.5 h。 然后依次孵育一抗(TLR4、ERK1/2、p-ERK1/2、p38、p-p38、JNK、p-JNK、β-actin)和相应二抗,然后置于凝胶成像系统中显影,最后使用Image Lab 软件分析图像。
1.12 统计学方法
采用SPSS 21.0 软件进行统计处理。 计量资料用(±s)表示,当数据满足正态分布时,组间比较采用单因素方差分析,如果方差齐则采用LSD-t法,如果方差不齐则采用Games-Howell 法;当数据不满足正态分布时,组间比较则采用非参数检验。P<0.05 为差异有统计学意义。
2 结 果
2.1 PZH 和LPS 对BV2 小胶质细胞活力的影响
采用MTT 法检测LPS 和PZH 干预后BV2小胶质细胞的存活率。 与正常对照组比较,LPS(100 ng/mL)刺激BV2 小胶质细胞12 h 后,细胞存活率没有发生明显变化;当PZH(0.05、0.10、0.15 mg/mL)单独作用或PZH 和LPS 同时刺激BV2 小胶质细胞12 h 时,细胞存活率仍然没有明显变化。 综上表明,在本实验条件下,LPS 和PZH 对BV2 小胶质细胞无明显毒性作用。 见表2。
表2 PZH 和LPS 对BV2 小胶质细胞活力的影响(±s)Table 2 Effect of PZH and LPS on the viability of BV2 microglial cells (±s)

表2 PZH 和LPS 对BV2 小胶质细胞活力的影响(±s)Table 2 Effect of PZH and LPS on the viability of BV2 microglial cells (±s)
组别正常对照组LPS 模型组0.05 mg/mL PZH 组0.10 mg/mL PZH 组0.15 mg/mL PZH 组PZH 低剂量组(0.05 mg/mL PZH+100 ng/mL LPS)PZH 中剂量组(0.10 mg/mL PZH+100 ng/mL LPS)PZH 高剂量组(0.15 mg/mL PZH+100 ng/mL LPS)n66666666存活率/%100.00±4.40 102.97±9.89 95.52±15.71 101.07±8.73 107.47±7.55 106.47±4.74 100.24±4.20 103.94±8.38
2.2 PZH 对LPS 诱导后BV2 小胶质细胞形态的影响
显微镜下观察发现,与正常对照组比较,BV2小胶质细胞在LPS 刺激12 h 后,细胞胞体变大,细胞突起增多变长,表明细胞被激活;而加入不同浓度PZH 干预后,BV2 小胶质细胞突起明显减少,表明PZH 可抑制BV2 小胶质细胞的活化,见图1。
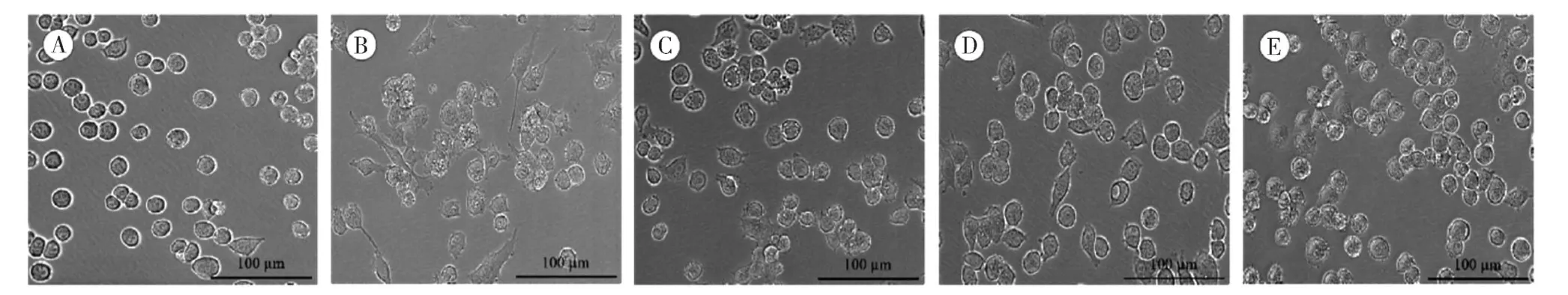
图1 PZH 对LPS 诱导的BV2 小胶质细胞形态的影响(×200)Figure 1 Effect of PZH on the morphology of LPS-induced BV2 microglial cells (×200)
2.3 PZH 对LPS 诱导后BV2 小胶质细胞促炎因子IL-6 表达的影响
采用ELISA 法检测细胞上清中IL-6 的水平。与正常对照组比较,BV2 小胶质细胞在LPS 刺激12 h后,IL-6 表达水平明显上升(P<0.001);与LPS 模型组比较,在给予不同浓度的PZH(0.05、0.10、0.15 mg/mL)共同干预12 h 后,IL-6 表达水平明显下降(P<0.05,P<0.05,P<0.01)。 见表3。
2.4 PZH 对LPS 诱导后BV2 小胶质细胞中促炎因子IL-1β、IL-6 和TNF-α mRNA 水平的影响
RT-qPCR 法检测BV2 小胶质细胞中IL-1β、IL-6 和TNF-α 转录水平。 与正常对照组比较,LPS 刺激12 h 后,BV2 小胶质细胞中IL-1β(P<0.001)、IL-6(P<0.001)和TNF-α(P<0.01)的mRNA 水平明显上升;与LPS 模型组比较,不同浓度的PZH 可明显降低细胞中IL-1β(P<0.05,P<0.01,P<0.001)、IL-6(P>0.05,P<0.01,P<0.001)和TNF-α(P<0.01,P<0.01,P<0.001)的mRNA 水平。 见表4。
表3 PZH 对BV2 小胶质细胞分泌IL-6 的影响(±s)Table 3 Effect of PZH on the IL-6 secretion of BV2 microglial cells (±s)

表3 PZH 对BV2 小胶质细胞分泌IL-6 的影响(±s)Table 3 Effect of PZH on the IL-6 secretion of BV2 microglial cells (±s)
注:与正常对照组比较,1) P<0.001;与LPS 模型组比较,2) P<0.05,3) P<0.01;与PZH 低剂量组比较,4) P<0.05。Note: Compared with the normal control group, 1) P<0.001;Compared with the LPS model group, 2) P<0.05, 3)P<0.01; Compared with the low-dose PZH group, 4)P<0.05.
IL-6/(pg/mL)56.80±1.79 1 240.39±15.831)843.50±51.332)597.30±69.442)394.97±59.403)4)组别正常对照组LPS 模型组PZH 低剂量组PZH 中剂量组PZH 高剂量组n33333
表4 PZH 对LPS 诱导后BV2 小胶质细胞中IL-1β、IL-6 和TNF-α mRNA 水平的影响(±s)Table 4 Effect of PZH on the mRNA levels of IL-1β,IL-6 and TNF-α in LPS-induced BV2 microglial cells (±s)

表4 PZH 对LPS 诱导后BV2 小胶质细胞中IL-1β、IL-6 和TNF-α mRNA 水平的影响(±s)Table 4 Effect of PZH on the mRNA levels of IL-1β,IL-6 and TNF-α in LPS-induced BV2 microglial cells (±s)
注:与正常对照组比较,1) P<0.001,2) P<0.01;与LPS 模型组比较,3) P<0.05,4) P<0.01,5) P<0.001;与PZH 低剂量组比较,6) P<0.001。Note: Compared with the normal control group, 1) P<0.001, 2) P<0.01; Compared with the LPS model group, 3) P<0.05, 4) P<0.01, 5) P<0.001; Compared with the low-dose PZH group, 6) P<0.001.
TNF-α mRNA 1.00±0.20 7.61±1.592)2.71±0.474)2.39±0.994)0.88±0.095)组别正常对照组LPS 模 型 组PZH 低剂量组PZH 中剂量组PZH 高剂量组n33333 IL-1β mRNA 1.00±0.06 749.24±77.731)589.43±89.813)469.66±73.094)188.41±20.965)IL-6 mRNA 1.00±0.07 223.77±19.401)208.15±12.11 162.79±23.274)73.31±10.045)6)
2.5 PZH 对LPS 诱导后BV2 小胶质细胞中炎性蛋白酶COX-2 和iNOS 表达的影响
Western blot 法检测BV2 小胶质细胞质中COX-2 和iNOS 蛋白表达水平。 与正常对照组比较,LPS刺激12 h 后,BV2 小胶质细胞中COX-2 和iNOS 蛋白水平均明显增加(P<0.001,P<0.001);与LPS 模型组比较,不同浓度PZH(0.05、0.10 和0.15 mg/mL)共同干预12 h 时,PZH 可明显降低细胞中COX-2蛋白表达水平(P<0.01,P<0.01,P<0.001)以及iNOS 蛋白表达水平(P<0.01,P<0.01,P<0.01),见表5 和图2。
表5 PZH 对LPS 诱导的BV2 小胶质细胞中COX-2 和iNOS 蛋白表达的影响(±s)Table 5 Effect of PZH on the protein expression of COX-2 and iNOS in LPS-induced BV2 microglial cells (±s)
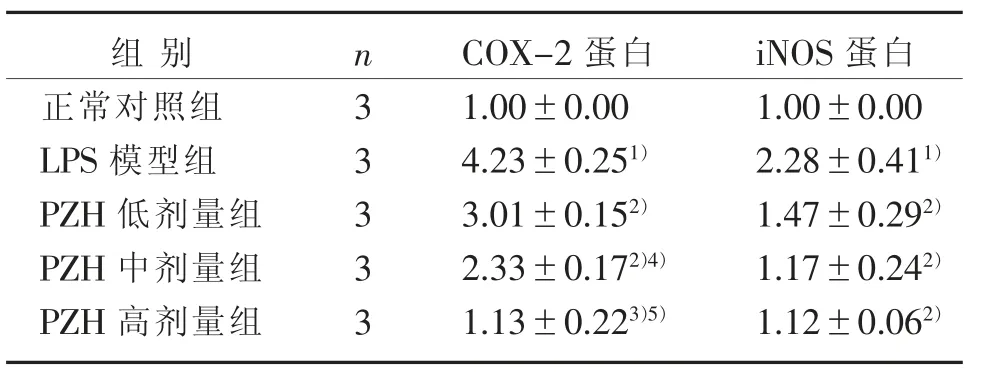
表5 PZH 对LPS 诱导的BV2 小胶质细胞中COX-2 和iNOS 蛋白表达的影响(±s)Table 5 Effect of PZH on the protein expression of COX-2 and iNOS in LPS-induced BV2 microglial cells (±s)
注:与正常对照组比较,1) P<0.001;与LPS 模型组比较,2)P<0.01,3)P<0.001;与PZH 低剂量组比较,4) P<0.05,5) P<0.01。Note: Compared with the normal control group, 1) P<0.001;Compared with the LPS model group, 2) P<0.01, 3)P<0.001; Compared with the low-dose PZH group, 4)P<0.05, 5) P<0.01.
iNOS 蛋白1.00±0.00 2.28±0.411)1.47±0.292)1.17±0.242)1.12±0.062)组别正常对照组LPS 模型组PZH 低剂量组PZH 中剂量组PZH 高剂量组n33333 COX-2 蛋白1.00±0.00 4.23±0.251)3.01±0.152)2.33±0.172)4)1.13±0.223)5)
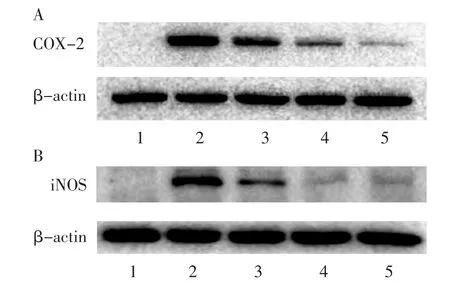
图2 PZH 对LPS 诱导的BV2 小胶质细胞中COX-2和iNOS 蛋白表达的影响Figure 2 Effect of PZH on the protein expression of COX-2 and iNOS in LPS-induced BV2 microglial cells
2.6 PZH 对LPS 诱导后BV2 小胶质细胞TLR4/MAPK 信号通路的影响
Western blot 法检测BV2 小胶质细胞中TLR4/MAPK 信号通路相关蛋白的表达水平。 与正常对照组比较,LPS 刺激12 h 后,BV2 小胶质细胞中TLR4(P<0.05)、p-ERK1/2(P<0.01)、p-p38(P<0.01)表达水平明显上升;与LPS 模型组比较,不同浓度的PZH 可抑制TLR4(P>0.05,P<0.05,P<0.05)、p-ERK1/2(P>0.05,P<0.05,P<0.01)、p-p38(P<0.05,P<0.01,P<0.01)蛋白表达。 LPS 刺激后BV2小胶质细胞中p-JNK 有一定上升,但差异无统计学意义(P>0.05),PZH 对p-JNK 蛋白表达则无明显影响。 见表6 和图3。
表6 PZH 对LPS 诱导的BV2 小胶质细胞中TLR4/MAPK 信号通路相关蛋白表达的影响(±s)Table 6 Effect of PZH on the protein expression of TLR4/MAPK signal pathway-related proteins in LPS-induced BV2 microglial cells (±s)
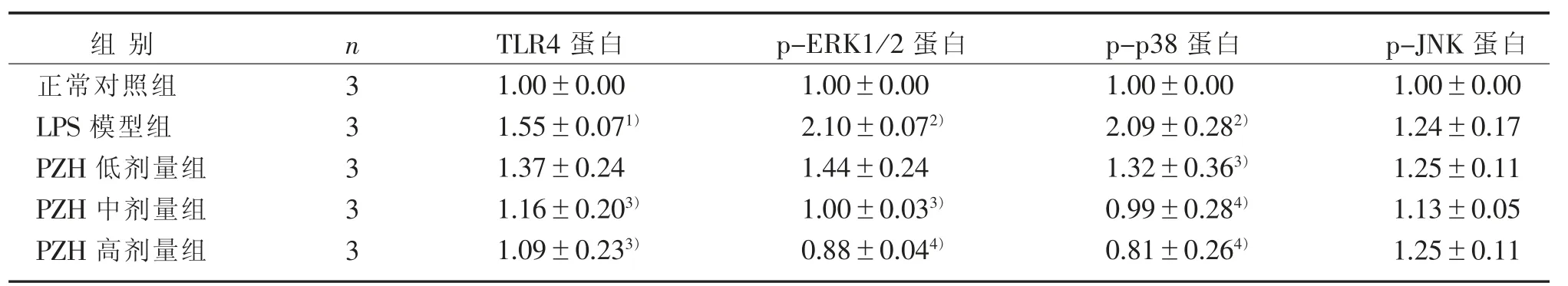
表6 PZH 对LPS 诱导的BV2 小胶质细胞中TLR4/MAPK 信号通路相关蛋白表达的影响(±s)Table 6 Effect of PZH on the protein expression of TLR4/MAPK signal pathway-related proteins in LPS-induced BV2 microglial cells (±s)
注:与正常对照组比较,1) P<0.05,2) P<0.01;与LPS 模型组比较,3) P<0.05,4) P<0.01。Note:Compared with the normal control group,1)P<0.05,2)P<0.01;Compared with the LPS model group,3)P<0.05,4)P<0.01.
p-p38 蛋白1.00±0.00 2.09±0.282)1.32±0.363)0.99±0.284)0.81±0.264)组别正常对照组LPS 模型组PZH 低剂量组PZH 中剂量组PZH 高剂量组n33333 TLR4 蛋白1.00±0.00 1.55±0.071)1.37±0.24 1.16±0.203)1.09±0.233)p-ERK1/2 蛋白1.00±0.00 2.10±0.072)1.44±0.24 1.00±0.033)0.88±0.044)p-JNK 蛋白1.00±0.00 1.24±0.17 1.25±0.11 1.13±0.05 1.25±0.11
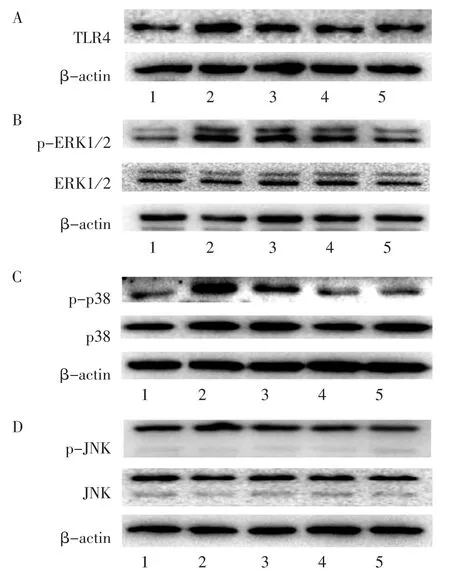
图3 PZH 对LPS 诱导的BV2 小胶质细胞中TLR4/MAPK 信号通路相关蛋白表达的影响Figure 3 Effect of PZH on the protein expression of TLR4/MAPK signaling pathway-related proteins in LPS-induced BV2 microglial cells
3 讨 论
神经炎症反应是缺血性脑卒中发生、发展过程中一个非常重要的分子机制,参与脑缺血再灌注损伤,造成脑内组织坏死、水肿,最终导致机体多重功能损伤。 小胶质细胞是脑内的巨噬细胞,约占大脑胶质细胞的10%~20%,正常情况下激活的小胶质细胞具有维持脑内稳态和促进神经系统损伤修复的重要生理作用,但是在缺血性脑卒中发生后过度活化的小胶质细胞会释放促炎因子和炎性蛋白酶,如IL-6、COX-2 和iNOS 等,参与神经炎症反应并损伤周围神经元。 而且,损伤的神经元细胞会释放出毒性物质再次刺激小胶质细胞,进一步加重神经炎症反应[11-12]。因此,抑制小胶质细胞引发的神经炎症反应,可减轻神经炎症造成的损伤,且有益于神经系统损伤的修复,这在缺血性脑卒中的治疗及康复过程中具有重要的意义。
IL-1β、IL-6 和TNF-α 是小胶质细胞神经炎症损伤过程中重要的炎症因子,参与炎症信号网络的启动和放大以及炎症反应损伤,其表达水平代表神经炎症反应损伤的程度[13]。 本实验结果显示,经过LPS 刺 激 后,BV2 小 胶 质 细 胞 中IL-1β、IL-6 和TNF-α mRNA 水平明显上升,促炎因子IL-6 分泌大量增加;PZH 干预后,BV2 小胶质细胞中IL-1β、IL-6 和TNF-α mRNA 水平明显下降,抑制LPS 诱导的BV2 小胶质细胞分泌IL-6。 COX-2 是将花生四烯酸转化成前列腺素的一种限速酶,后者在参与调控慢性和急性炎症中扮演重要角色[14]。 iNOS 是NO 合成的关键酶,炎症反应发生后iNOS 高表达,进而促进合成大量的NO 以参与炎症反应,可导致自由基形成、血脑屏障通透性增加,进而加重脑损伤[15]。本实验结果显示,在LPS 刺激后,BV2 小胶质细胞高表达COX-2 和iNOS 蛋白,PZH 干预可以显著抑制LPS 诱导的BV2 小胶质细胞表达COX-2 和iN OS。 总之,结果表明PZH 可抑制LPS 诱导的BV2小胶质细胞神经炎症反应。
为了阐明PZH 抑制LPS 诱导的BV2 小胶质细胞中IL-6、COX-2 和iNOS 表达的机制,本研究进一步探究了PZH 对信号通路TLR4/MAPK 的影响。研究发现,LPS 与小胶质细胞膜上的TLR4 受体相结合后可促进TLR4 高表达,并且在髓样分化因子(MyD88)的作用下激活MAPKs(ERK1/2、JNK 和p38 MAPK)信号通路,而MAPKs 信号通路在调节免疫反应和炎症应答中扮演重要角色,与IL-6、iNOS 和COX-2 等一系列促炎因子和炎性蛋白酶的大量合成释放密切相关[16]。本实验结果显示,在LPS刺激BV2 小胶质细胞后,TLR4 表达增加,且磷酸化MAPKs 水平升高,即TLR4/MAPK 信号通路被激活。 PZH 的干预则可明显降低LPS 诱导的BV2 小胶质细胞TLR4 的表达,并且抑制MAPKs 磷酸化,即降低了p-ERK1/2 和p-p38 蛋白的表达水平,但是PZH 对p-JNK 蛋白的表达无明显影响,结果提示PZH 可抑制LPS 诱导的TLR4/MAPK 信号通路的激活。
综上所述,PZH 可能是通过抑制TLR4/MAPK信号通路,进而抑制炎症因子IL-1β、IL-6 和TNFα 转录,降低促炎因子IL-6 以及促炎性蛋白酶COX-2、iNOS 的表达,发挥其改善LPS 诱导BV2 小胶质细胞神经炎症损伤的作用。 本实验为进一步研究PZH 治疗脑卒中的机制以及其临床应用提供依据和实验基础。

