太行菊属植物根际土壤微生物多样性初步研究
景晓雅, 孙柳清, 李尚彧, 高亚楠, 吴云锋, 王祎玲, 陈伟*
(1.山西师范大学生命科学学院, 山西 临汾041000;2.西北农林科技大学干旱区作物胁迫生物学国家重点实验室, 陕西 杨凌712100)
太行菊属(OpisthopappusShih)属于菊科(Asteraceae)菊亚族,属下有2个种,分别为太行菊[Opisthopappustaihangensis(Ling)Shih]和长裂太行菊(OpisthopappuslongilobusShih),具有较高的观赏价值和药用价值[1]。太行菊属植物主要分布在我国的山西、河北、河南等省,为我国太行山脉的特有属[2],大多生长在海拔1 000 m左右的悬崖峭壁石缝中以及峭壁下疏林内的岩石缝隙和土层瘠薄处,抗逆性较好,被广泛用于菊花种质改良[3]。目前,由于其分布范围持续缩小,已处于濒危状态,被河南省和河北省列为濒危保护植物[4]。太行菊属植物作为我国的特色种质资源, 在特殊生境中发挥着重要的生态功能,对环境改善、生态平衡等具有重要应用价值。
植物作为生态系统中的生产者,根际土壤微生物是其有机质的分解者,两者形成了稳定的微生态环境。植物将光合产物以根系分泌物和植物残体的形式释放到土壤,供给土壤微生物以碳源和能源;而微生物则将有机养分转化为无机养分,以利于植物吸收利用[5-6]。这种植物-微生物-土壤的相互作用维系或主宰了生态系统的生态功能,为系统内所有生物适应逆境提供了重要保障[7-8]。目前对拟南芥[9]、大豆[10]、大麦[11]、玉米[12]、水稻[13]、野燕麦[14]等植物的根际土壤微生物多样性进行了大量研究,其中最常见的细菌类群有芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)等。根际放线菌的种类相对于细菌而言较少,主要是链霉菌属(Streptomyces)、小单孢菌属(Micromonospora)等。而最常见的镰刀菌属(Fusarium)、粘帚霉属(Gliocladium)、青霉属(Penicillium)等真菌,也是根际微生物的重要组成部分。植物根际聚集的这些大量微生物,参与土壤有机物质的分解、腐殖质的形成及氨化作用,并拮抗土壤中的病原菌等过程,可加快根际土壤养分的转化与储存,刺激植物根系对养分的吸收[15]。根际微生物还对磷有活化作用,同时可促进钾、锰、铁、锌等元素的释放,为植物生长提供必要的营养元素[14,16]。此外,微生物也可通过影响植物根系生长、形态发育等生理特性,而间接影响根系吸收营养物质的范围和潜力,进而影响植物的生态适应性[17]。总之,在植物-微生物-土壤三者形成的稳定根际生态系统中,根际丰富的微生物在一定程度上增强了生态系统内植物的演化和适生。从根际微生物角度探讨植物演化和生态适生机制是世界范围的研究热点,是众多交叉学科研究的重点领域之一[15]。
本研究分析了太行菊属两个物种的根际土壤理化性质,并对其根际土壤微生物多样性进行检测和分析,系统研究了太行菊属植物根际微生物的遗传多样性,解析其生态适应机制,为太行菊属植物的合理开发和科学保护提供重要的理论和技术指导。
1 材料与方法
1.1 试验材料及样品采集
于2017年8—10月,对太行菊属植物太行菊(O.taihangensis)和长裂太行菊(O.longilobus)的自然分布区进行野外调查和样本采集,选取长裂太行菊的两个样地:山西红豆峡(Hongdouxia,HDX)和河南高家台(Gaojiatai,GJT),太行菊的两个样地:河南关山(Guanshan,GS)和河南青龙峡(Qinglongxia,QLX),共4个样地,样地详细信息见表1。

表1 样品采集的样地信息
除去土壤表层未分解的凋落物层,用已灭菌的铲去除表层5 cm土壤,再用土壤取样器取样10~25 g,装于无菌塑料封口袋内,用冰袋运送回实验室。除去动植物残体、石砾等杂质,将大块样品捣碎,过2 mm筛后,分装至2 mL的冻存管中,-80 ℃中保存备用。
1.2 土壤理化性质测定
称取两个太行菊属植物GS、QLX、HDX、GJT 4个样地的风干土样1 g,放入试管,加无菌水2.5 mL,加塞后充分摇动试管,待溶液澄清后,用BPH-7100A pH测量仪(贝尔分析仪器有限公司)测量土壤浸出液pH,每个样品重复3次。
依据林业行业标准[18-20]测量土壤碱解氮、速效磷和速效钾含量。每个样品重复3次。
1.3 土壤微生物多样性测定
1.3.1土壤总DNA提取与分析 取GS、QLX、HDX、GJT 4个样地的土样,采用CTAB法提取土壤总DNA,利用1%琼脂糖凝胶电泳检测DNA质量,用Nanodrop ND-2000超微量核酸蛋白测定仪(Nanodrop,美国)分析抽提DNA浓度和纯度。选取完整且质量较好的材料用于后续研究。
1.3.2土壤细菌和真菌的DNA测定 以制备好的DNA为模板,细菌以细菌通用引物(V3-V4)338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)为引物,真菌用真菌通用引物ITS1F(5’-CTTGGTCATTTAGAGGAAGTAA-3’)和ITS2R(5’-GCTGCGTTCTTCATCGATGC-3’)为引物,用扩增试剂盒KT121221(TianGen,中国)进行PCR反应。反应程序为:94 ℃预变性1 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃补充延伸10 min。取5 μL PCR扩增产物用2%琼脂糖凝胶电泳检测PCR扩增效果,选取条带单一、亮度较好的样品使用DNA凝胶回收试剂盒DP208(TianGen,中国)进行回收。回收产物送上海美吉生物公司进行高通量测序分析。
1.3.3序列处理与分析 测序后获得原始序列,经修剪、去除嵌合体序列及非特异性扩增序列等优化处理后,提取非重复序列,采用RDP classifier贝叶斯算法[21],按照97%相似性对非重复序列(不含单序列)进行物种分类学分析、Pan/Core 物种分析和Alpha多样性分析。根据有效序列数量进行物种相对丰度、物种Chao1指数、Shannon-Wiener指数、Simpson指数和盖度的计算和分析。通过与EggNOG数据库中的COG功能分类(Non-supervised Orthologous Groups,http://eggn og.embl.de/)和KEGG(Kyoto Encyclopedia of Genes and Genomes,http://www.genome.jp/kegg/)数据库进行比对,对太行菊和长裂太行菊根际土壤的细菌和真菌功能进行预测。
1.4 相关性分析
用SPSS 22.0软件对太行菊和长裂太行菊的根际土壤微生物丰富度与土壤pH、碱解氮、速效磷、速效钾含量进行相关性分析。
1.5 数据统计与分析
采用SPSS 22.0 软件进行数据处理与分析,用R 3.6.0绘图。
2 结果与分析
2.1 太行菊和长裂太行菊不同样地的根际土壤理化性质
对太行菊和长裂太行菊共4个样地的根际土壤理化性质进行初步分析, 结果(表2)表明,GS、QLX、HDX、GJT样地的碱解氮含量分别为50.3、56.6、43.8、42.4 mg·kg-1,速效磷含量分别为17.8、16.9、15.6、13.7 mg·kg-1,速效钾含量分别为80.7、81.8、57.7、61.7 mg·kg-1。可见,太行菊两个样地的根际土壤有效养分整体高于长裂太行菊的两个样地,但两地土壤的碱解氮、速效磷、速效钾含量明显偏低,土壤较贫瘠。4个样地的土壤pH均为7左右,近中性。

表2 太行菊属植物根际土壤理化性质
2.2 长裂太行菊和太行菊不同样地的土壤微生物多样性
2.2.1土壤微生物种类统计 为从微生物的角度探讨太行菊属植物的生存适应机制,排除环境因素的干扰,分别将太行菊与长裂太行菊的各个样本,进行综合分析。基于长裂太行菊的两个样地之间的土壤理化性质较相似,对长裂太行菊的HDX和GJT样地,太行菊的GS和QLX样地统一进行土壤微生物多样性分析。高通量测序结果(表3)显示,太行菊根际共获得63 266条有效细菌DNA序列,获得了942个OTU,鉴定出细菌19 门43 纲87 目176 科297 属503 种;共获得63 789条有效真菌DNA序列,获得了548个OTU,共鉴定出真菌5 门20 纲58 目103 科185 属261 种。
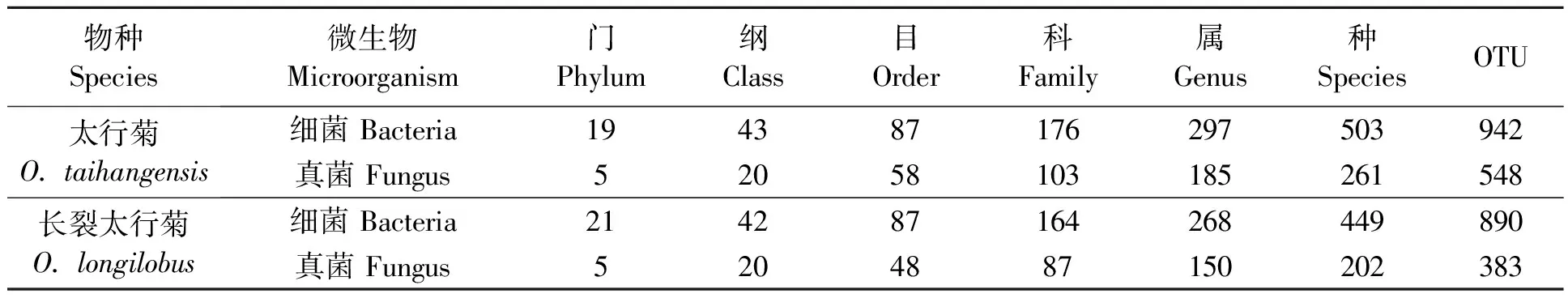
表3 太行菊属植物根际土壤微生物种类统计
长裂太行菊根际共获得53 069条有效细菌DNA序列,以相似度97%为阈值,获得了890个OTU(97%相似性的非重复序列),鉴定出细菌21 门42 纲87 目164 科268 属449 种;共获得53 478条有效真菌DNA序列,获得了383个OTU,共鉴定出真菌5 门20 纲48 目87 科150 属202 种。
2.2.2土壤微生物门水平的分析 太行菊和长裂太行菊的根际土壤细菌在门水平的丰度分析(表4)显示,太行菊的细菌门中,放线菌门(Actinobacteria)占比最高,为42.50%,其次是变形菌门(Proteobacteria,24.78%)、酸杆菌门(Acidobacteria,14.11%)、绿弯菌门(Chloroflexi,8.54%),其余15个细菌门占比10.07%;真菌门中,子囊菌门(Ascomycota)占比86.83%,其次是担子菌门(Basidiomycota,6.44%),未知菌门(unclassified)占比5.35%,接合菌门(Zygomycota)占比1.21%,球囊菌门(Glomeromycota)占比0.17%。可见,放线菌门、变形菌门、酸杆菌门和绿弯菌门细菌是太行菊植物的根际优势细菌门,子囊菌门是太行菊的根际优势真菌门。Unclassified-Ascomycoat、Norank-Chaetthyriales、Norank-Ascomycota、Norank-Pleosporales、Unclassified-Fungi的丰度分别占36.09%、11.01%、9.09%、5.42%、5.35%,为优势真菌科。
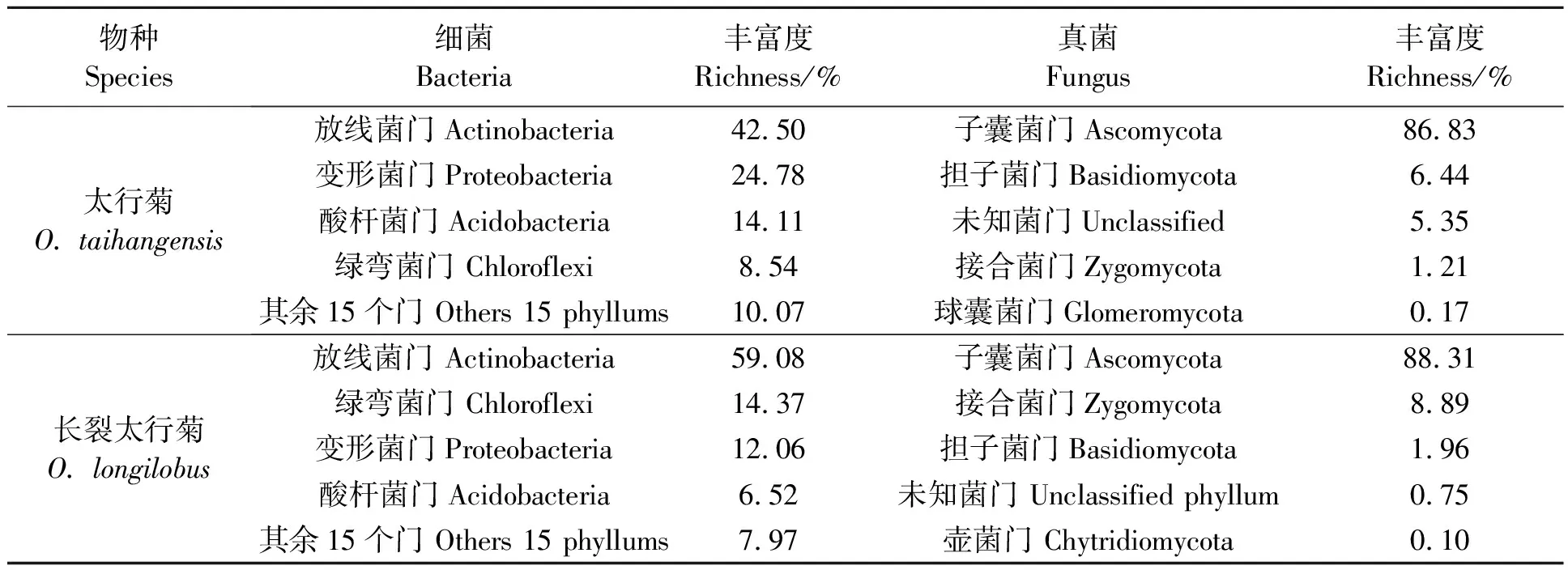
表4 太行菊属植物根际土壤的优势微生物门及其丰富度
长裂太行菊中,放线菌门(Actinobacteria)在根际细菌种类占比最高,为59.08%,其次是绿弯菌门(Chloroflexi,14.37%)、变形菌门(Proteobacteria,12.06%)、酸杆菌门(Acidobacteria,6.52%),其他15个细菌门占比7.97%;真菌门中,子囊菌门(Ascomycota)占比88.31%,其次是接合菌门(Zygomycota,8.89%)和担子菌门(Basidiomycota,1.96%)、未知菌门(unclassified,0.75%)、壶菌门(Chytridiomycota,0.10%)。可见,放线菌门、绿弯菌门、变形菌门、酸杆菌门是长裂太行菊根际土壤的优势细菌门,子囊菌门是长裂太行菊的根际优势真菌门。瓶口衣科(Verrucariaceae)、Unclassified-Ascomycoat、丛赤壳科(Nectriaceae)、Unclassified-Chaetothyriales、和norank-Ascomycota的丰度分别占15.64%、14.31%、12.17%、11.01%和9.55%,为长裂太行菊的根际优势真菌科。
2.2.3土壤微生物的种水平分析 太行菊和长裂太行菊根际土壤中鉴定出402种共有根际细菌,其中太行菊有101个特有种,长裂太行菊有47个特有种(图1)。太行菊和长裂太行菊根际土壤中鉴定出128种共有根际真菌,太行菊有133个特有种,长裂太行菊有74个特有种(图1)。
对两个太行菊属植物根际土壤的细菌和真菌丰富度进行显著性差异分析,结果(图2)显示,太行菊和长裂太行菊根际土壤中,有281种细菌在丰富度方面存在极显著差异,其中功能细菌有66种,功能涉及抗逆、固氮、碳循环等。太行菊和长裂太行菊的根际土壤中,有15种真菌存在丰富度的显著差异,包含石果衣(Endocarponpusillum)、Acremoniumblochii、Podosporacommunis、白色侧齿霉菌(Engyodontiumalbum)等多种功能真菌。
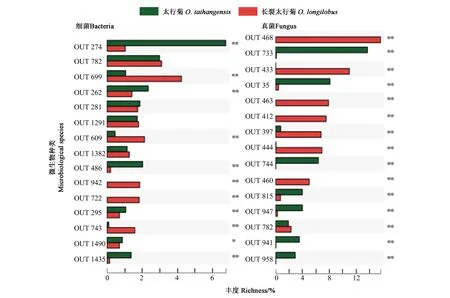
注:* 表示该OTU在两个物种间的差异在P<0.05水平具有显著性,**表示该OTU在两个物种间的差异在P<0.01水平具有显著性。
Alpha多样性分析显示,太行菊根际细菌的Chao指数、Shannon-Wiener指数、Simpson指数分别为497.01、4.78和0.04;根际真菌Chao指数、Shannon-Wiener 指数、Simpson 指数分别为205.23、2.81和0.08。长裂太行菊根际细菌的Chao指数、Shannon-Wiener指数、Simpson指数分别为488.37、4.56和0.03;根际真菌Chao指数、Shannon-Wiener 指数、Simpson 指数分别为207.83、3.10和0.08。可见,太行菊根际细菌多样性指数均大于长裂太行菊,而其根际真菌多样性指数均小于长裂太行菊。表明根际微生物多样性的差异也反映了太行菊和长裂太行菊两个物种间的差异,在一定程度上支持太行菊与长裂太行菊为两个种的适生演化结论。
2.2.4土壤微生物的功能分析 太行菊和长裂太行菊根际土壤的细菌和真菌功能分析结果(表5)显示,太行菊属根际存在大量功能微生物参与DNA修复、跨膜运输、碳水化合物代谢等过程。详细分析发现,太行菊和长裂太行菊的根际微生物中,有15种参与氮循环、9种参与光合功能、8种参与抗逆相关功能等过程。这些具有丰富功能的微生物为太行菊属植物在特殊生境生存提供了重要保障。其中,长裂太行菊的氮循环、碳循环和光合功能微生物的丰富度均高于太行菊,而太行菊的抗逆功能微生物的丰富度高于长裂太行菊,化能功能微生物在太行菊和长裂太行菊之间几乎没有差异。
2.4 相关性分析
为探究土壤理化性质与根际微生物多样性之间的关系,对太行菊和长裂太行菊的根际细菌和真菌多样性指数与其相应根际土壤的pH、碱解氮、速效磷、速效钾含量进行相关性分析。结果(表6)表明,太行菊和长裂太行菊的根际细菌多样性与碱解氮、速效磷、速效钾含量均存在极显著负相关关系,两个物种的根际细菌多样性与土壤pH均表现为显著负相关关系。太行菊和长裂太行菊的根际真菌多样性与土壤pH、碱解氮、速效磷、速效钾含量均存在极显著负相关关系。可见,土壤理化性质对太行菊属植物的根际微生物多样性具有显著影响,且土壤养分的影响更大。
3 讨论
太行菊属植物生长在悬崖峭壁,生长环境恶劣。本研究发现,其根际土壤中可直接利用的N、P、K营养元素含量较低。根际微生物种类分析发现,其根际土壤中存在大量具有固氮、解磷、解钾功能的微生物。这些功能微生物可能通过自身代谢参与矿物质的分解、氨化作用等[22],将矿物质转化为植物可以吸收利用的无机养分,提高太行菊属植物根际土壤中可吸收利用的养分,而太行菊属植物通过根的分泌物,将光合作用产物通过根和残体供给微生物碳源和能源,这样两者形成了较为稳定的互利共生微环境[23-24],利于太行菊属植物在较贫瘠的土壤环境生存。
本研究发现,太行菊和长裂太行菊的根际微生物在种类、数量、丰富度、优势菌群等方面都存在一定差异;有281种细菌在丰富度方面存在极显著差异,15种真菌存在显著差异,太行菊根际细菌多样性指数均大于长裂太行菊,而其根际真菌多样性指数均小于长裂太行菊。导致这种物种间差异的原因可能是:首先,两个物种的生长环境不同。长裂太行菊采自山西省红豆峡和河南省高家台,太行菊采自河南省关山和青龙峡,采集地在降水、温度、光照等环境因素间存在一定差异,从而影响土壤微生物的种类和多样性。其次,长裂太行菊与太行菊为了适应不同生态环境,开始适生进化,逐渐演化形成两个种[25],并通过其根及分泌物进一步作用于土壤微生物,从而引起土壤微生物种类、丰富度等方面出现差异。此外,土壤理化性质的差异也是根际微生物差异的重要原因,对比两个物种根际土壤理化性质,发现太行菊与长裂太行菊的土壤pH、碱解氮、速效磷和速效钾含量均存在差异,这种差异可以直接或间接地作用于土壤微生物[25-26],从而影响土壤微生物种类、数量和分布。相关性分析显示,太行菊属植物的根际微生物多样性与土壤养分成显著负相关性(表5),说明土壤养分的差异是造成太行菊和长裂太行菊根际微生物差异的重要原因。本研究为进一步解析太行菊属植物的特殊生境适应机制奠定了基础,也为太行菊属属下分类提供了借鉴意义。

