黑蒜的活性成分和生理功能研究进展
◎ 王 燕,何贵山,王赛元
(甘肃天然源生物科技有限公司,甘肃 兰州 730300)
黑蒜是近几年兴起的一种大蒜深加工产品,是通过控制温度、湿度,由新鲜大蒜发酵一段时间后制成的食品[1]。黑蒜蒜瓣为黑褐色,口感略甜,无大蒜的刺激性气味和辛辣味,食后不会产生难闻的口气,减轻了大蒜的一些不良反应,如胃肠不适、接触性皮炎等,大大拓宽了大蒜产业的市场空间。黑蒜在国内的流传时间较短,虽然黑蒜的确切起源尚不清楚,但普遍认为2003年起源于日本三重县,随后被引入中国,2008年国内黑蒜首次出口,在不到20年的时间里黑蒜产业不断发展,成为大蒜深加工领域的一个重点方向。本文对黑蒜的活性成分和生理功能进行综述,旨在为黑蒜健康食品的进一步开发提供参考。
1 黑蒜的活性成分
黑蒜是大蒜发生酶促褐变和美拉德反应的产物,黑色主要由美拉德反应的产物——类黑素产生。与大蒜相比,黑蒜的化学成分发生了较大变化,在保留一部分大蒜成分的基础上,还生成了新的活性成分。黑蒜中糖、维生素、蛋白质的含量是大蒜的2倍以上,多酚含量大增,为大蒜的11倍。周广勇等比较鲜大蒜与黑蒜中化学成分的差异,结果显示黑蒜的水分和易挥发有机硫化物含量下降,而糖类和自由基清除能力升高[2]。王卫东等测定大蒜美拉德反应期间各种成分的变化,黑蒜中水分含量降至56.5%,多酚含量升至5.4 mg·g-1,还原糖含量升至214.9 mg·g-1,5-羟甲基糠醛(5-HMF)含量升为2 729.12 μg·g-1,同时,抗氧化能力大大提高,黑蒜的还原能力、对羟基自由基的清除率分别是大蒜的10倍和3倍[3]。卢小明实验表明,大蒜加工成黑蒜后还原糖含量由开始的0.46 g/100 g升高到39.49 g/100 g,升高了近百倍[4]。Kimura等总结黑蒜与鲜大蒜中几种氨基酸、多酚及黄酮类等成分的变化情况(表1)[1],其中半胱氨酸、酪氨酸发酵后含量下降,亮氨酸、异亮氨酸及苯丙氨酸含量升高,黑蒜中的Amadori&Heyns甚至是大蒜的40~100倍。
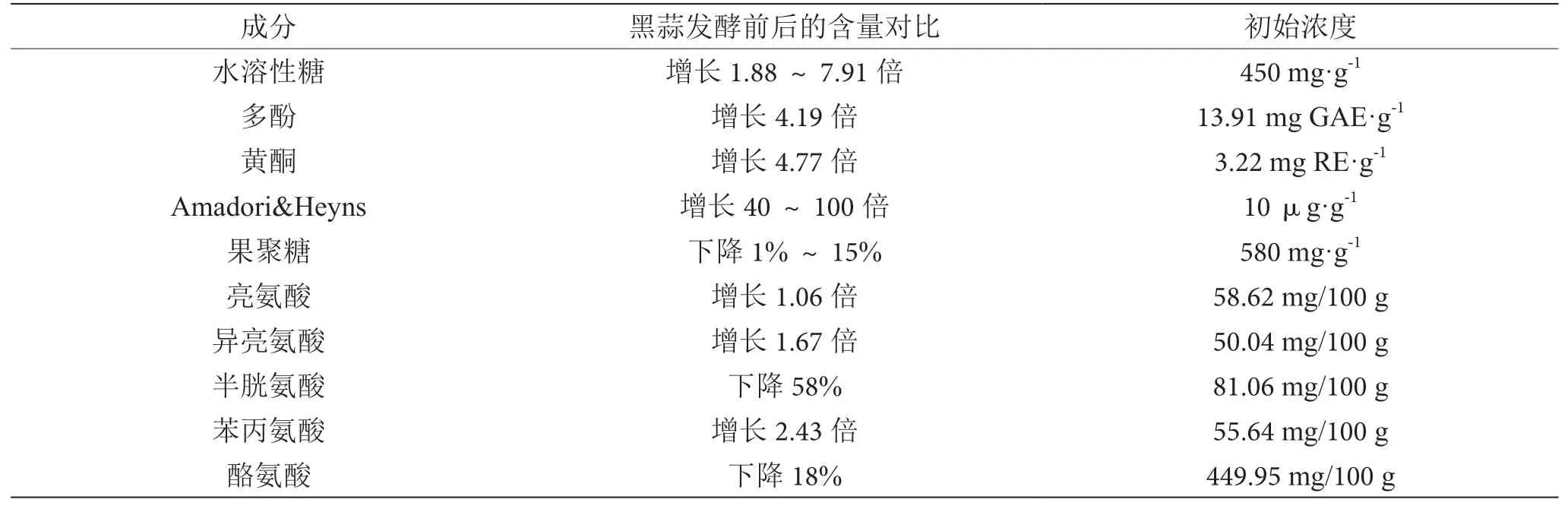
表1 黑蒜与鲜大蒜的成分比较表[1]
2 黑蒜的生理功能
作为大蒜的深加工产品,黑蒜在体内、体外功能性实验中均被证实具有很强的生理功能。这与其中含有的多种活性成分有关,如有机硫化物、多糖、多酚和类黑精等,这些成分共同赋予黑蒜抗氧化、保护肝脏、抗肿瘤等作用。
2.1 抗氧化
Choi等研究黑蒜加工过程中抗氧化物质及抗氧化活性变化情况,结果显示黄酮类和多酚类物质在70 ℃、90%湿度的加工条件下显著增加,至21 d,黄酮类物质含量由鲜大蒜中3.22 mg RE·g-1(RE为视黄醇当量)提升至16.26 mg RE·g-1,多酚类物质从鲜大蒜中12.91 mg GAE·g-1(GAE为没食子酸当量)增长至58.33 mg GAE·g-1。抗氧化成分的增加引起抗氧化能力的提高。黑蒜对DPPH自由基的清除率最高可达到74.48%,远高于鲜大蒜,而对ABTS自由基的清除率是鲜大蒜的2倍多[5]。
杜瑞雪等测定鲜大蒜及黑蒜中多糖含量及抗氧化能力,结果显示黑蒜中多糖含量为98.67 mg·g-1,远高于大蒜中多糖含量50.33 mg·g-1。黑蒜多糖的羟自由基清除率、DPPH自由基清除率、超氧阴离子自由基清除率均高于大蒜,表明黑蒜多糖具有更高的体外抗氧化能力[6]。
郑岚等研究黑蒜多糖的斑马鱼体内抗氧化活性,结果显示黑蒜多糖低剂量干预组抗氧化率为40.18%,而黑蒜多糖高剂量干预组抗氧化率为50.6%,显示出明显的量效关系,且高于维生素C阳性对照组抗氧化率(11.38%)[7]。
WANG Weidong等研究黑蒜多酚的体内外抗氧化活性,体外实验结果表明,黑蒜多酚可明显降低DPPH自由基、羟基自由基的活性,一定浓度的黑蒜多酚其体外抗氧化活性高于维生素C;体外实验结果显示黑蒜多酚能显著降低氧化损伤小鼠的血清MDA含量,提高血清SOD、GSH-Px活性,表现出明显的体内抗氧化活性[8]。
ZOU Ying等研究黑蒜提取物对氧化损伤的红细胞的保护作用,实验结果显示黑蒜提取物可显著降低受损红细胞(AAPH诱导红细胞溶血)的溶血率,具有较强的细胞内抗氧化活性[9]。
黑蒜的抗氧化机制尚不完全清楚,Ha等认为黑蒜的抗氧化活性与Nrf2相关基因的mRNA表达有关。实验测定血浆中硫代巴比妥酸反应性物质(tbar)和8-异前列腺素F2(8-iso-PGF)浓度,测定血浆总抗氧化能力(TAC)以及血浆和肝脏中抗氧化酶的活性。检测抗氧化相关蛋白Nrf2、NAD(P)H:醌-氧化还原酶-1(NQO1)、血红素氧合酶-1(HO-1)、谷胱甘肽还原酶(GR)以及谷胱甘肽S-转移酶-2(GSTA2)的mRNA表达水平,结果显示黑蒜组血浆tbar浓度和TAC均显著降低,过氧化氢酶和谷胱甘肽过氧化物酶活性显著升高,肝脏Nrf2、NQO1、HO-1和GSTA2的mRNA表达水平明显增加[10]。
2.2 抗肿瘤作用
DONG Menghua等发现黑蒜提取物可抑制HT29大肠癌细胞的生长,并进一步研究其抗癌机制。黑蒜提取物通过上调PTEN、下调Akt和p-Akt的表达,以及在mRNA和蛋白水平上抑制其下游靶点70 kDa核糖体蛋白S6激酶1来调节PI3K/Akt通路的功能,通过抑制PI3K/Akt通路抑制HT29细胞生长并诱导细胞凋亡,达到抑制癌细胞生长的效果[11]。
李颖等通过构建4组宫颈癌Hela细胞移植瘤模型,研究黑蒜提取液对宫颈癌Hela细胞移植瘤的影响。小鼠随机分为4组,用生理盐水灌胃为空白对照组,γ射线照射为γ照射组,黑蒜提取液灌胃为黑蒜组,黑蒜提取液灌胃联合γ射线照射处理为黑蒜+γ照射组,测定各组小鼠移植瘤生长速度、胸腺及脾脏指数、淋巴细胞刺激指数、SOD活力值、CAT活力值以及白细胞数,结果表明,黑蒜提取液可增强小鼠免疫功能,提高其机体抗氧化能力及外周血白细胞计数,以发挥对Hela细胞移植瘤的辐射增敏作用[12]。
宫晓静等以荷瘤小鼠Panc-1细胞为研究对象,探讨黑蒜提取液对其生长及转移能力的影响,并研究其分子机制。分别建立胰腺癌Panc-1小鼠转移瘤模型和移植瘤模型,将小鼠随机分为黑蒜低剂量组、黑蒜高剂量组、空白对照组和阳性对照组4组,其中空白对照组给予0.9%氯化钠溶液,阳性对照组给予环磷酰胺。2周后处死小鼠,将其瘤体剥离称重,并计算瘤体的生长抑制率和转移抑制率,检测Smad4及TGF-β1的表达水平。结果显示,黑蒜低、高剂量组可显著抑制Panc-1细胞移植瘤的生长和转移,生长抑制率高达63.6%,肺部转移抑制率高达63.5%,且黑蒜高剂量组的转移抑制率高于阳性对照组;与空白对照组相比,黑蒜低、高剂量组Panc-1细胞质中的TGF-β1褐黄色颗粒减少,Smad4胞浆着黄色增多。由此可知黑蒜提取液可显著降低小鼠Panc-1细胞移植瘤生长率及其肺部转移率,其机制可能与TGF-β1/Smad4信号通路有关,通过上调Panc-1小鼠移植瘤Smad4的表达,下调TGF-β1的表达抑制肿瘤的生长与转移[13]。
2.3 保护肝脏
Lee等使用叔丁基过氧化氢(tBHP)诱导大鼠克隆-9肝细胞损伤并研究黑蒜对受损伤肝细胞的保护作用,结果表明,黑蒜提取物可显著抑制GSH的消耗、MDA的积累、IL-6/IL-8 mRNA表达过程,阻断脂质过氧化及氧化应激过程,明显减少tBHP诱导的大鼠克隆-9肝细胞的死亡[14]。
Ahmed等研究黑蒜对环磷酰胺诱导的肝毒性和细胞凋亡的保护作用,结果显示,黑蒜组的大鼠肝脏组织有明显改善,肝细胞重新排列成放射束状,细胞核正常,细胞质中未见空泡和脂肪滴,ALT、AST、胆红素含量显著降低,表明黑蒜对肝细胞凋亡和肝组织病变具有明显的保护作用[15]。
张远等通过50%酒精灌胃诱导建立小鼠急性肝损伤模型,研究黑蒜对小鼠急性酒精性肝损伤的作用,结果显示高浓度黑蒜可显著降低小鼠血清ALT,减轻肝切片组织损伤程度,提高SOD活性,表明高浓度黑蒜对小鼠急性酒精性肝损伤具有保护作用[16]。
2.4 调节血糖、血脂水平
宁月宝等研究发酵固态黑蒜降血糖功能,结果表明,黑蒜中的一些硫醚物质可降低小鼠血糖[17]。Ao等研究黑蒜对胆固醇的代谢作用,实验结果显示,膳食补充黑蒜粉显著抑制体内胆固醇的合成[18]。Kim等研究黑蒜提取物的抗氧化作用及对血脂影响,实验结果显示,高脂肪饲喂小白鼠灌胃黑蒜提取物后血浆中甘油三酯和肝脏总胆固醇含量明显降低,从而改善血脂[19]。Nam等探究黑蒜调节脂质代谢的作用机制,表明黑蒜可通过降低成熟3T3-L1脂肪细胞增殖因子活化受体(PPAR)和周髂素的蛋白表达,抑制3T3-L1脂肪细胞的生成,促进脂肪的分解来调节脂质代谢[20]。
2.5 免疫调节
黑蒜对免疫系统有无生理活性尚存在争议,其中LI Min等比较大蒜多糖与黑蒜多糖的免疫调节作用,包括对RAW264.7巨噬细胞的促进吞噬作用、NO的释放、免疫细胞因子(IL-6、IL-10、肿瘤坏死因子α和干扰素γ)的表达,结果显示,大蒜多糖具有更强的免疫调节作用,黑蒜多糖基本无免疫调节活性[21]。而杨明等以BALB/c小鼠为研究对象,环磷酰胺建立动物模型,发现高、中、低浓度的黑蒜粉对小鼠均有免疫增强作用。其中,黑蒜粉高、中、低3个剂量组小鼠的抗体生成能力、胸腺指数、脾淋巴细胞增殖能力、脾细胞IL-8和IL-12的mRNA表达量均显著提高;黑蒜粉中、高剂量组小鼠的迟发性变态反应能力和脾脏指数显著提高;黑蒜粉高剂量组小鼠的单核-巨噬细胞吞噬活性及血清溶血素水平也显著增强[22]。
2.6 抗炎作用
Jeong等对黑蒜提取物与鲜大蒜提取物的抗氧化、抗炎作用进行了鉴别和比较。过氧化氢和脂多糖(LPS)分别作为促氧化剂和促炎应激源。与鲜大蒜提取物相比,黑蒜提取物在RAW264.7细胞中具有较高的ABTS和DPPH自由基清除活性,生成ROS更少。但鲜大蒜提取物对环氧合酶2和5脂合酶活性的抑制作用强于黑蒜提取物。在LPS激活的RAW264.7细胞中,鲜大蒜提取物比黑蒜提取物更能减少PGE、NO、IL-6、IL-1、LTD和LTE的产生。鲜大蒜发酵成黑蒜后,半乳糖、葡萄糖、果糖或蔗糖等与鲜大蒜提取物结合,降低了抗炎活性,但也抑制了NF-κB的激活和促炎症基因的表达。黑大蒜提取物的抗炎活性低于鲜大蒜提取物可能是由于糖的存在,黑蒜提取物可能更有助于治疗主要由ROS介导的疾病[23]。
Kim等使用脂多糖诱导炎症反应模型研究黑蒜功能活性化合物的抗炎作用,实验结果表明一定浓度的黑蒜提取物具有显著的抗炎作用。实验测量了细胞活力、一氧化氮、前列腺素E2和促炎细胞因子(IL-6、TNF-α和IL-1β)水平并通过逆转录聚合酶链式反应和免疫印迹试验(Western Blotting)检测诱导型一氧化氮合酶和环氧合酶-2的mRNA和蛋白表达水平。结果表明,一氧化氮和前列腺素E2水平随黑蒜提取物的浓度增加而显著降低,IL-6、TNF-α和IL-1β的分泌也受到抑制,诱导型一氧化氮合酶和环氧合酶-2的mRNA以及蛋白表达降低。此外,黑蒜提取物也减弱了脂多糖诱导的RAW264.7细胞中细胞外信号调节激酶p38和c-Jun末端激酶的磷酸化[24]。
2.7 其他
2.7.1 润肠通便
卢小明等通过对便秘模型小鼠灌胃黑蒜后发现其对小肠内容物推进率明显增加,首次排黑便时间缩短,6 h内排黑便粒数增加,粪便含水量提高,表明黑蒜具有一定的润肠通便作用[25]。
2.7.2 抗疲劳作用
杜鹃等建立小鼠运动性疲劳模型,并将其分为游泳训练组,安静对照组以及黑蒜低、中、高剂量组,实验结果表明,黑蒜组血清生化检测尿素氮降低,表明黑蒜可调节代谢状态,促进代谢产物排出;血糖浓度升高,肝糖原、肌糖原含量恢复,乳酸脱氢酶减少,表明黑蒜可促进血糖、糖原恢复;还原型谷胱甘肽含量增加,总超氧化物歧化酶含量增高,表明黑蒜可缓解过氧化损伤,提高运动耐力,抵抗运动所致疲劳[26]。
2.7.3 改善记忆
孙艳发现黑蒜提取液明显降低小鼠逃避潜伏期(定位航行实验),显著增加小鼠经过平台次数及经过平台象限时间比率(空间搜索实验),大大提高亚硝酸钠和氯化铝致老年痴呆小鼠的学习记忆能力[27]。
2.7.4 治疗哮喘
李洋等将小鼠随机分为空白对照组、阴性组、药物治疗组、大蒜组和黑蒜组,除空白组外,其他4组用氢氧化铝和鸡卵蛋白致敏,用鸡卵蛋白诱发,建立小鼠过敏性哮喘模型。各治疗组分别注射富马酸替酚溶液、大蒜提取物、黑蒜提取物,空白组、阴性组注射同体积PBS。ELISA法检测小鼠血清中的IL-4、IL-33、IgE和IFN-γ水平,显微镜下计数全血嗜酸粒细胞数量。结果显示,各治疗组均可有效降低嗜酸粒细胞数量及IL-4、IL-33、IgE水平,升高IFN-γ水平,其中黑蒜组各项检测指标(除IL-33外)与大蒜组均有统计学差异。表明黑蒜提取物对过敏性哮喘具有一定的治疗作用,其机制主要是通过调整Th1/Th2型应答平衡,或通过抑制IL-33-ST2信号途径发挥作用[28]。
2.7.5 抗过敏
Yoo等发现黑蒜能明显抑制RBL-2H3细胞和体内被动皮肤过敏反应(PCA)中免疫球蛋白介导的过敏反应。体外实验发现,黑蒜的乙酸乙酯提取物(EBG)明显抑制了对乙酰氨基己糖酶和TNF-小鼠血清的释放。此外,作为EBG的活性成分,BG10显著抑制了酪氨酸-己糖氨基酶和TNF-甲流蛋白的释放,同时在25 μg·mL-1时完全阻断前列腺素E和白三烯B的形成,降低了细胞质的磷酸脂酶A(cPLA)和5-脂氧合酶(5-LO)的磷酸化以及环氧合酶-2(COX-2)的表达[29]。
3 结语
黑蒜作为一种采用现代技术加工而成的新兴产品,不但没有蒜臭味和辣味,而且生理功能大大提高,这使得黑蒜更符合保健养生需求,市场潜力巨大。国内学者从2008年开始对黑蒜的研究,2012年起相关研究逐渐增多,侧面体现了黑蒜在中国的发展势头[30]。但目前黑蒜的生产尚无统一的质量标准,生产企业规模较小,大众对黑蒜的认知程度不高,致使黑蒜的市场占有率很低。这些问题严重影响黑蒜产业的进一步发展,因此,应提高黑蒜产品工艺水平和技术含量,开发黑蒜技术共享大数据平台,打造高附加值的黑蒜新产品,相信随着大众对黑蒜营养价值及生理功能的逐渐认可,黑蒜将成为拥有巨大市场需求的新兴保健食品。

