分泌卷曲相关蛋白4肝脏高表达转基因小鼠的制作及鉴定分析
关 华,郑慧媛,刘恩岐,徐礼鲜,余 琦
(1. 西安医学院基础与转化医学研究所 陕西省缺血性心血管疾病重点实验室,陕西西安 710021;2. 空军军医大学口腔医院麻醉科,陕西西安 710032;3. 西安医学院组织学与胚胎学教研室,陕西西安 710021;4. 西安交通大学心血管研究中心脂代谢与动脉粥样硬化研究室,陕西西安 710061)
分泌卷曲相关蛋白4(secreted frizzled-related protein 4, SFRP4)是SFRPs家族成员之一,包含一个半胱氨酸富集的区域,这一序列与Wnt结合的Frizzled蛋白结合位点同源[1]。SFRPs作为Wnt信号通路可溶性调节因子,主要通过两种途径调节Wnt下游信号转导,竞争性地与膜受体Frizzled蛋白结合,或者直接与Wnt蛋白结合。已有报道指出,SFRPs家族蛋白SFRP4通过调控经典的Wnt/β-catenin信号通路促进人前体脂肪细胞向成熟脂肪细胞分化[2]。此外,肥胖个体内脏脂肪组织SFRP4表达水平显著上调,并且其在内脏脂肪组织中的分泌与胰岛素抵抗相关[3]。血清中SFRP4的表达水平与葡萄糖刺激的胰岛素分泌和葡萄糖耐量呈负相关,这一研究结果与此前报道的结果一致,即SFRP4在2型糖尿病患者胰岛细胞中过表达,并且抑制葡萄糖耐受性和胰岛素分泌[4]。
本研究拟制备SFRP4肝脏组织特异性高表达转基因小鼠。首先,社会经济水平的提高导致人类的饮食结构发生改变,促使世界范围内肥胖症的发生率明显升高[5]。世界各国的科学家针对如何治疗肥胖以及如何缓解肥胖症的发生进行了大量研究和探索,而SFRP4是最新发现的脂肪细胞因子[6],可能在治疗肥胖症的过程中发挥重要作用[7]。其次,SFRP4广泛表达于人和小鼠的各个脏器及组织,脂肪、肌肉和肝脏作为胰岛素作用的靶器官,表达水平较高[8],因此,SFRP4表达水平的增高或降低对胰岛素的敏感性以及葡萄糖转运和消耗密切相关[9]。最后,有研究发现,将人SFRP4基因编码序列转入小鼠体内,并不能导致小鼠血糖升高[10]。因此,我们推测,人和小鼠SFRP4基因配体-受体结合存在差异,不能很好地相互结合而发挥作用,对于小鼠模型来说有很多局限性。因此,建立SFRP4过表达转基因小鼠模型,探索在动物水平过表达SFRP4蛋白是否能够调控小鼠不同部位脂肪组织的蓄积及能量代谢,对于研究由SFRP4引起的肥胖症、2型糖尿病及胰岛素抵抗至关重要。
1 材料与方法
1.1 动物本研究中用到的雄性和雌性C57BL/6J小鼠各40只,6周龄,购自北京维通利华实验动物技术有限公司〔北京 SYXK(京)2017-0033〕。动物3只1笼,饲养环境为清洁级,室内温度保持在(22±2) ℃,光照(12 h明/12 h暗)、噪声等均符合国际要求(GB14925-2010),自由饮水和采食。研究方法和伦理审查通过西安医学院实验动物管理委员会批准,遵循美国国立卫生研究院出版的《实验动物护理和使用指南》(2011年第8版)规定执行。
1.2 主要试剂RT-PCR Mix、逆转录和SYBR Green(TaKaRa,日本),质粒小提试剂盒(Omega,美国),鼠尾直接PCR试剂盒(Bimake,美国),RNA提取试剂盒(TaKaRa,日本),蛋白提取试剂盒(Omega,中国),SFRP4抗体(Abcam,美国),MluⅠ和ClaⅠ内切酶(Fermentas,立陶宛)。
1.3 转基因动物的构建采用显微注射方法制作SFRP4转基因小鼠。显微注射、核移植及孕鼠的待产均在西安交通大学医学部实验动物中心进行〔SYXK(陕)2012-005〕。
1.3.1基因载体的构建 小鼠SFRP4基因的cDNA序列全长1 056 bp,通过连接酶与骨架载体质粒pJC13连接,pJC13载体携带ApoE启动子。由于ApoE启动子在肝脏中特异性高表达,故调控携带的SFRP4基因在肝脏高表达,载体连接成功后,酶切鉴定后用于显微注射。
1.3.2显微注射 根据高守翠等[11]建立的实验方法,首先将鉴定构建正确的质粒载体内切酶酶切线性化,随后利用显微注射技术将其注入小鼠受精卵。20 d左右仔鼠出生,剪少量鼠尾并提取组织DNA,PCR鉴定转基因阳性小鼠,用于SFRP4基因表达及功能的研究。
1.3.3模型鉴定 剪取仔鼠少量鼠尾组织,按照鼠尾直接PCR试剂盒说明书提取基因组DNA,PCR鉴定鼠尾基因型。引物序列:Forward 5′-ACCTGAATTCACAGTTGTCTGTGTG-3′,Reverse 5′-CAGATGCGTGAAACTTGGTGAATCT-3′。反应体系为2×M-PCR OPTITMMix(10 μL),引物(正向/反向)各1 μL(10 mmol),DNA模板1 μL,双蒸水7 μL。反应程序:94 ℃ 20 s,60 ℃ 30 s,72 ℃ 1 min,40个循环,RT-PCR产物进行琼脂糖凝胶电泳(20 g/L)。
1.4 目的基因表达分析PCR鉴定得到的SFRP4转基因阳性小鼠以及同窝对照经安乐处死后,分离肝脏并提取总RNA和总蛋白备用。qRT-PCR检测SFRP4在肝脏中的mRNA表达。引物序列:SFRP4(97 bp),Forward 5′-AAGCCGACCCTGGCAACATA-3′,Reverse 5′-TTGTGACCTCATTGCAACCACTC-3′;β-actin(171 bp),Forward 5′-GCGGCATCCACGAAACTAC-3′,Reverse 5′-TGATCTCCTTCTGCATCCTGTC-3′。反应体系为SYBR Green 10 μL,引物(正向/反向)各1 μL(10 mmol),cDNA模板1 μL,ddH2O 7 μL。反应程序:95 ℃ 30 s,95 ℃ 5 s,55 ℃ 40 s,40个循环。Western blotting检测肝脏组织中SFRP4蛋白相对表达水平。
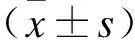
2 结 果
2.1 基因构建分别提取pJC13-ApoE(携带ApoE启动子的质粒载体)和pUC57-SFRP4(携带SFRP4基因cDNA序列的质粒载体)质粒DNA,用ClaⅠ和MluⅠ分别双酶切DNA片段,将酶切后的产物用10 g/L的琼脂糖凝胶电泳分离20 min,分别切胶回收ApoE载体和 SFRP4 cDNA片段(图1),Nano Drop检测回收DNA片段的浓度,以备下一步ApoE载体和SFRP4片段进行连接反应。

图1 双酶切pJC13-ApoE和pUC57-SFRP4质粒Fig.1 Double enzymed digestion of pJC13-apoE and pUC57-SFRP4 plasmids
按照说明书操作程序,将连接后的质粒DNA转化至DH5α感受态细胞中,挑取菌株接种至液体培养基中扩增菌液,用引物扩增SFRP4片段检测菌液是否为阳性克隆。结果显示,在Marker为1 000 bp左右的位置得到SFRP4的片段,片段大小为1 056 bp(图2)。

图2 菌液PCR扩增SFRP4 CDs区(1 056 bp)Fig.2 SFRP4 CDs region amplified by bacterial PCR (1 056 bp)
扩增菌液PCR鉴定的阳性克隆,提取质粒后通过10 g/L的琼脂糖凝胶电泳检测质粒片段的长度,pJC13-ApoE-SFRP4阳性质粒长度大于10 000 bp(图3),筛选阳性质粒进行测序鉴定。由此证明pJC13-ApoE-SFRP4质粒载体构建成功,可进行下一步显微注射操作,制作SFRP4转基因小鼠。

图3 10 g/L的琼脂糖凝胶电泳鉴定质粒的大小Fig.3 Plasmid size determined by 10 g/L agarose gel electrophoresis
2.2 基因型鉴定代孕母鼠胚胎移植20 d左右,乳鼠出生,约3周后剪少量鼠尾组织,提取组织DNA后,PCR鉴定SFRP4转基因阳性小鼠,表示为Tg小鼠。PCR产物经10 g/L的琼脂糖凝胶电泳,根据PCR结果判断SFRP4转基因阳性小鼠,其中阳性小鼠PCR得到约300 bp的PCR产物(图4)。

图4 20 g/L的琼脂糖凝胶电泳鉴定野生型(wild type,WT)和apoE-SFRP4转基因(Tg)小鼠基因型Fig.4 Wild type and apoE-SFRP4 transgenic mice genotypes identified by 20 g/L agarose gel electrophoresis
2.3 转基因效率鉴定分别检测转基因小鼠以及同窝对照肝脏组织中SFRP4基因表达,结果显示,转基因小鼠SFRP4基因和蛋白表达水平明显高于同窝对照,说明成功构建并获得SFRP4转基因小鼠,并且SFRP4的表达水平明显高于野生型小鼠(图5、图6)。

图5 WT和Tg小鼠肝脏中SFRP4 mRNA表达Fig.5 SFRP4 mRNA expression determined in the liver of WT and SFRP4 transgenic mice数据均以均数±标准差表示,n=6。与WT比较,**P<0.01。

图6 WT和Tg小鼠肝脏中SFRP4蛋白表达Fig.6 The protein expression level of SFRP4 determined by Western blotting数据均以均数±标准差表示,n=6。与WT比较,**P<0.01。
3 讨 论
将外源DNA通过生命科学手段导入小鼠生殖系是当代科学技术发展强有力的工具。为了确定特定组织表达某种遗传因素以及其在发育个体中的生物学功能和特性,或者探索某个未知基因在个体发育过程中不恰当高表达的后果,都可以利用转基因动物模型进行阶段性研究。因此,转基因动物的制作是传统且有效的技术方法,为生命科学的发展带来了巨大变化[12-13]。受精卵原核显微注射法制备的转基因动物,1个或多个携带的外源DNA拷贝的质粒序列整合到受精卵染色体上,最常见的情况是,注入的DNA以多个头-尾相连的拷贝整合到小鼠基因组中,随着细胞的分裂而扩增,能够稳定遗传给子代,因此转基因动物在生长发育过程中表现某种特殊的形态或者获得某种特殊的功能[14]。基因组分析结果显示,人和小鼠基因组高度同源,基因相似率达到95%,发育和生活过程相似,生理和生化反应基本相同,环境和药物代谢的变化非常相似。因此,人类疾病相关的动物模型大多选择小鼠进行科学研究[15]。目前国内外已建立了成熟的转基因小鼠的制备方法,主要应用于基因功能研究、动物遗传改良、动物疾病模型及器官移植的研究[16]。
转基因小鼠为研究转化医学潜在的机制提供了非常有用的模型,主要有以下4个方面:第一,转基因小鼠可以为研究脂肪细胞功能提供相关的组织环境[17];第二,在次级突变发生之前,转基因小鼠提供分析基因对增殖及分化的主要影响[18];第三,携带不同基因的转基因小鼠之间的杂交揭示了其在转化过程的协同作用能力[19];第四,转基因小鼠特定的基因可以用于寻找新的或反向基因的相互协同作用[20]。本研究利用肝脏高表达基因ApoE作为SFRP4的启动子,确保SFRP4基因高丰度表达于小鼠肝脏组织。
本研究利用转基因技术构建SFRP4转基因小鼠,作为分泌型糖蛋白,SFRP4蛋白在细胞质中合成后,经修饰信号肽断裂穿过细胞膜分泌到细胞外[21],肝脏是重要的造血、储血器官,在肝脏中合成SFRP4蛋白后经血液输送到达全身,上调小鼠周身SFRP4蛋白表达。此外,我们注意到,转基因小鼠肝脏组织中SFRP4基因和蛋白表达与同窝对照小鼠相比明显升高,证明SFRP4肝脏特异性高表达转基因小鼠构建成功。
——一道江苏高考题的奥秘解读和拓展

