初情期母牛下丘脑-垂体-卵巢转录组分析
孙 鏖,何 芳,浣 成,李昊帮,伍佰鑫,胡雄贵,易康乐
(湖南畜牧兽医研究所,湖南 长沙 410130)
下丘脑-垂体-卵巢(hypothalamic-pituitary-ovary,HPO)轴在雌性动物发情周期和生殖中起重要作用[1-3]。HPO轴主要通过周期性产生促性腺激素和类固醇激素来调控动物的繁殖生理活动[4-5]。下丘脑主要是促性腺激素释放激素(GnRH)向垂体的搏动释放。而垂体受下丘脑释放的激素影响,调控卵泡刺激素(FSH)和促黄体激素(LH)释放至外周血[6-7]。卵巢受各类激素的调控影响,周期性的出现卵泡发育、排卵、黄体形成等一系列的活动[8-9]。
初情期是动物首次表现发情和排卵的年齡,也是初具繁殖受孕能力的标志。初情期在繁殖力较低的单胎动物显得格外重要。初情期出现时间早晚直接影响动物的繁殖能力和种用价值,是衡量动物个体育种价值和经济性状的重要指标之一。研究表明,动物的初情期直接受到HPO轴的调控,但其具体的作用机制仍未明了。
目前,利用基于高通量测序 RNA-Seq 技术的转录组学在动物学研究领域的运用越来越广泛[10-11],而肉牛基因组的基因注释大部分是通过生物信息学预测和比对得出,肉牛独有的相关特异基因的挖掘和注释可能还不全面或存在遗漏。因此,本试验拟对处于初情期(18月龄左右)的安格斯母牛下丘脑、垂体和卵巢组织进行采集后,进行mRNA水平转录组分析。通过应用RNA-Seq 技术对其进行高通量转录组测序分析,筛查相关表达基因,筛选出与性腺轴调控繁殖过程相关的基因与信号通路,为进一步了解肉牛的环境适应性、分子育种及探析繁殖性能等诸多方面提供依据。
1 材料与方法
1.1 样品采集在湖南涟源国家安格斯牛核心育种场选取3头半同胞(同父异母)、体型发育基本一致、健康的18月龄的安格斯母牛(编号为181、182和183)。于2018年4月9日进行屠宰。屠宰后立即采集卵巢组织样本,置于液氮中速冻,并于-70℃保存备用,用于提取组织总RNA。本试验不涉及动物伦理及福利问题,所有样本均采集自政府审查批准的相关屠宰场。
1.2 RNA定量和鉴定测试RNA样品的纯度、浓度和完整性,以确保将合格的样品用于转录组测序。每个样品总共1 μg RNA用作RNA样品制备的输入材料。使用用于Illumina的NEBNext UltraTMRNA库制备试剂盒(美国NEB)生成测序库,并将索引代码添加到每个样品的属性序列中。使用附有poly-T寡核苷酸的磁珠从总RNA中纯化mRNA。在高温下,使用二价阳离子在NEBNext第一链合成反应缓冲液(5×)中进行裂解。使用随机六聚体引物和M-MuLV逆转录酶合成第一链cDNA。随后使用DNA PolymeraseⅠ和RNase H进行第二链cDNA合成。剩余的突出端通过核酸外切酶/聚合酶活性转化为平末端。 DNA片段3′末端进行腺苷酸化后,将具有发夹环结构的NEBNext衔接子连接起来,以进行杂交。为了优选长度为240 bp的cDNA片段,用AMPure XP系统(Beckman Coulter,Beverly,USA)纯化文库片段。然后将3 μL USER酶(NEB,美国)与大小选择的衔接子连接的cDNA在37℃下作用15 min,然后在95℃下5 min 再进行PCR。然后用Phusion高保真DNA聚合酶,Universal PCR引物和Index(X)Primer进行PCR。最后,纯化PCR产物(AMPure XP系统),并在Agilent Bioanalyzer2100系统上评估文库质量。
1.3 聚类和排序使用BMK Cloud(www.biocloud.net)进行RNA-Seq分析。根据制造商的说明,使用TruSeq PE Cluster Kit v4-cBot-HS(Illumia)在cBot簇生成系统上对索引编码的样品进行聚类。在产生聚类簇之后,将文库制备物在Illumina平台上测序并产生配对末端的读数。
1.4 质量控制Fastq格式的原始数据(原始读取)首先通过内部perl脚本进行处理。在此步骤中,通过从原始数据中删除包含适配器的读取,包含ploy-N的读取和低质量的读取来获得Clean Data。同时计算Clean Data的Q20、Q30和GC含量和序列重复水平。所有下游分析均基于高质量的Clean Data。
1.5 比较分析低质量序列读数将从数据集中删除。原始序列在数据处理后被转换为Clean Reads。然后将这些Clean Reads进行参考基因组定位,进一步分析和注释仅具有完全匹配或一个错配的读数。使用Hisat2工具软件绘制参考基因组图[10-11]。
1.6 基因表达水平的定量基因表达水平的定量通过每百万个作图片段的转录本的每千碱基片段来估算基因表达水平。
1.7 基因功能注释基因功能的注释基于以下数据库:Nr(NCBI非冗余蛋白质序列数据库); Nt(NCBI非冗余核苷酸序列数据库); Pfam(蛋白质家族数据库);KOG/COG(蛋白质直系同源簇数据库);Swiss- Prot(人工注释和审查的蛋白质序列数据库);KO(KEGG Ortholog数据库);GO(Gene Ontology 数据库)[12-15]。
2 结果
2.1 总RNA及文库质量检测提取3头牛下丘脑、垂体和卵巢组织的总RNA,经核酸蛋白测定仪测定,各卵巢组织样本的总RNA质量浓度均≥10 mg/L,纯度(D260/D280)均在2.0以上,说明RNA 完整性较好未被降解,可用于下一步试验。通过qPCR方法对文库的有效浓度进行精确定量(文库有效浓度>4 nmol/L),结果表明获得了高质量的cDNA文库,文库构建成功。
2.2 转录组测序质量评估完成9个样品的转录组分析,共获得61.92 Gb Clean Data,各样品Clean Data均达到6.88 Gb,Q30碱基百分比在92.42%及以上(表1)。分别将各样品的Clean Reads与指定的参考基因组进行序列比对,比对效率从94.53%到95.59%不等(表2)。统计Mapped Reads在指定的参考基因组不同区域(外显子、内含子和基因间区)的数目,绘制了基因组不同区域上各样品Mapped Reads的分布图(图1)。
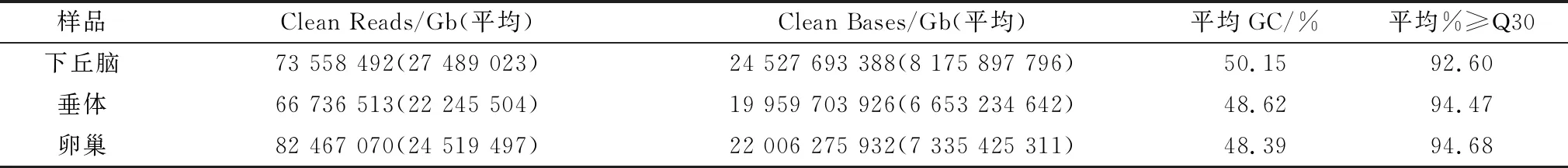
表1 测序数据统计表

表2 样品测序数据与所选参考基因组的序列比对结果统计表 %

图1 不同样本测序序列与参考基因组序列各位置比对百分比
2.3 表达基因分析
2.3.1表达基因筛选 9个样品数据,采用并集的方法,对表达阈值≥0.1 的基因进行筛选,并按将相同的样品进行混池后进行比较后,进行维恩图绘制(图2)。结果显示,下丘脑共有20 517个基因表达,垂体组织共有20 627个基因表达,卵巢共有19 687个基因表达。有15 154个基因在所有组织中都有表达,有4 780个基因只在2种组织器官中共同表达,有5 809个基因只在其中的1个组织器官中表达。

图2 不同组织表达基因维恩图
2.3.2表达基因功能注释和富集分析 对表达基因进行数据库的功能注释结果显示,下丘脑组织共有2 168个基因在GO数据库中得到注释,12 477个基因在KEGG数据库中得到注释(图3);垂体组织共有2 101个基因在GO数据库中得到注释,12 446个基因在KEGG数据库中得到注释(图4);卵巢组织共有13 777个基因在GO数据库中得到注释,12 176个基因在KEGG数据库中得到注释(图5)。

图3 下丘脑GO分类图

图4 垂体GO分类图
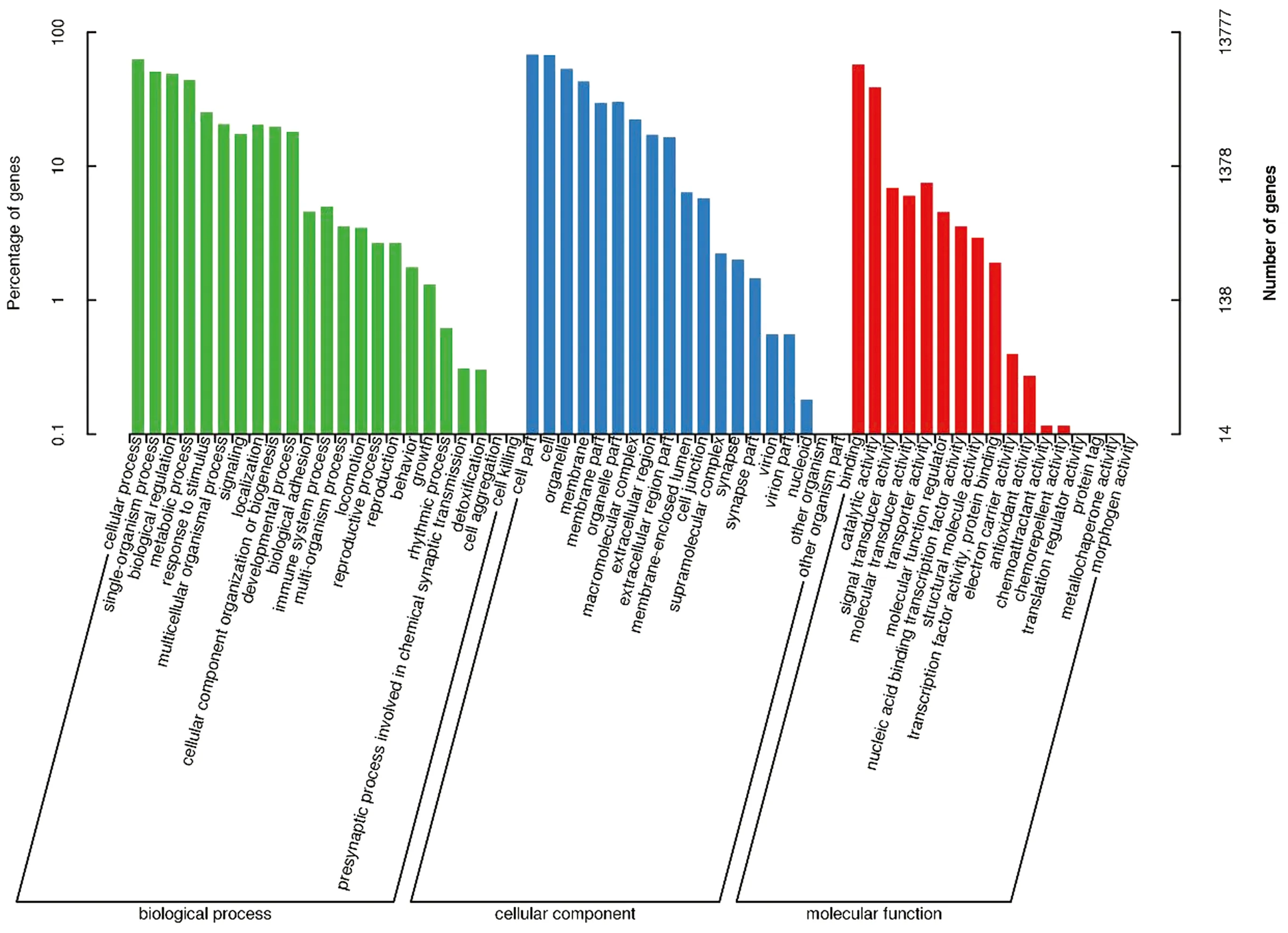
图5 卵巢GO分类图
2.3.3表达基因细胞功能与代谢通路分析 将所有表达基因标注到GO数据库中,共找到受精、单个组织繁殖过程和子宫内胚胎发育等8类与卵巢发育、受精活动和胚胎发育相关的GO数据库二级分类进行对比注释(表3)。将所有表达基因标注到KEGG数据库中。下丘脑组共富集到104个信号通路。挑选了富集最显著的20条通路在图形中进行展示(图6)。垂体组共富集到104个信号通路,挑选了富集最显著的20条通路在图形中进行展示(图7)。卵巢组共富集到104个信号通路,挑选了富集最显著的20条通路在图形中进行展示(图8)。
在各组织器官中,筛选与繁殖相关的信号通路进行归类整理。结果显示,所有组织器官中都存在钙离子信号通路、雌激素信号通路和GnRH信号通路等16个与繁殖相关的信号通路(表4)。

表3 卵巢发育、受精活动和胚胎发育相关表达基因GO分类表
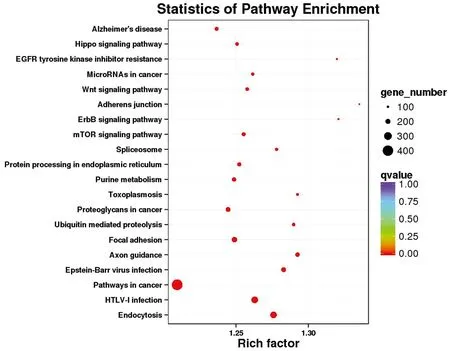
图6 下丘脑KEGG通路前20富集图
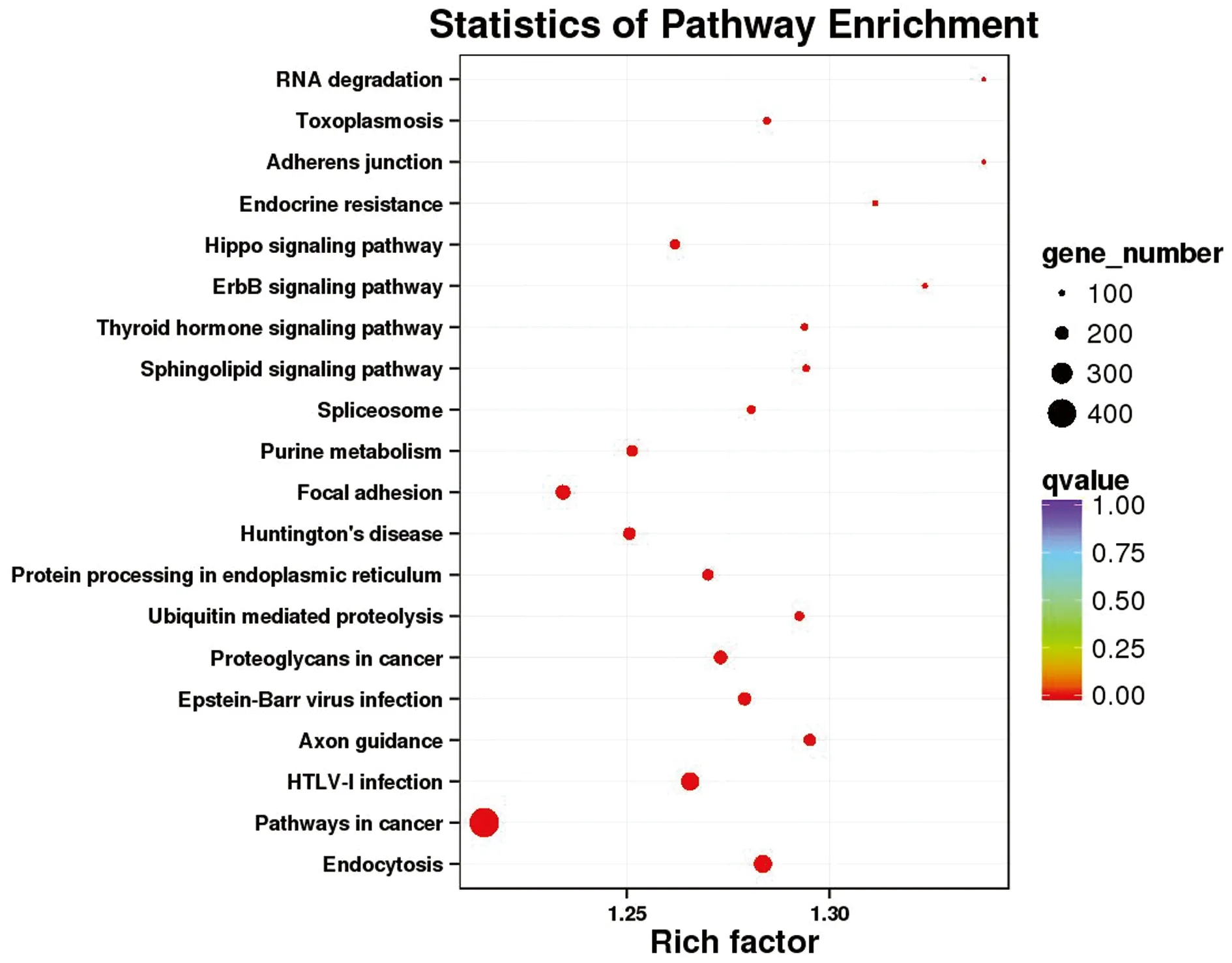
图7 垂体KEGG通路前20富集图

图8 卵巢KEGG通路前20富集图
3 讨论
与动物繁殖相关的卵巢组织转录组测序技术在猪、山羊和牦牛中均有报道[16-18]。但对肉牛进行性腺轴转录组测序的相关报道较少。本试验以安格斯牛为研究对象,通过选取初情期左右的安格斯牛母牛下丘脑、垂体和卵巢组织进行RNA-Seq和生物信息学分析,希望深度挖掘与肉牛生殖激素调控和繁殖性能相关的分子标记信息。
挖掘肉牛性腺轴表达基因是本研究的重点。本试验同时对3头18月龄半同胞母牛的下丘脑、垂体和卵巢组织,按组织器官类别进行混池建库测序。

表4 与繁殖相关KEGG信号通路统计表
结果显示,下丘脑共有20 517个基因表达,垂体组织共有20 627个基因表达,卵巢共有19 687个基因表达。有15 154个基因在所有组织中都有表达,分别占到下丘脑、垂体和卵巢基因表达总数的73.86%,73.47%,76.97%。
为揭示各组织表达基因相关功能,对筛选得到的差异表达基因进行了GO分析。在下丘脑组中富集到的GO条目为55个,在GO的分子功能中富集最多的是细胞过程、细胞组成和分子结合绑定;在垂体组中富集到的GO条目为53个,在GO的分子功能中富集最多的是细胞过程、细胞组成和细胞;在卵巢组中富集到的GO条目为59个,在GO的分子功能中富集最多的是细胞组成、细胞(cell)和细胞过程。
一般来说,生物体内重要生理过程的完成往往需要多个基因的共同参与,各自行使相关的功能,发生一系列调控。在对生物体内某一现象的产生进行研究时,阐明重要生理功能涉及的信号通路至关重要。因此,本研究在GO分析的基础上又进行了KEGG信号通路分析,其中富集最多的是癌症通路,出现这一结果的原因可能是在所有基因组功能注释的功能基因中,与癌症和疾病相关的基因数量和信号通路相对较多;其次参与到癌症通路的大部分基因可能同时涉及和参与了细胞的分化、增殖和器官组织的发育。但癌症通路在性腺轴生理活动中的确切功能及作用尚不明确,有待进一步的研究和验证[19]。
另外,在性腺轴3种组织器官都有表达的并与动物繁殖性状相关的分别有17条。其中GnRH 信号通路是性腺轴主导的调控动物生殖活动的经典传导通路[20-21]。同时本研究注意到,Notch信号通路、神经营养因子信号通路和血管内皮生长因子信号通路的参与基因在性腺轴中检出频率最高,说明这些信号通路可能也通过性腺轴对雌性动物生殖活动产生影响。
Notch 信号通路在多种生物体内广泛存在,通过与邻近细胞间的相互作用调控组织器官的发育和分化[22]。目前,已发现4种同源受体(Notch1-Notch4)和5 种同源配体(Delta1,3,4 和Jagged1、Jagged2)[23]。Notch 通路广泛参与多种成体干细胞不对称分裂的过程,并与细胞衰老密切相关[24]。研究证明,Notch 信号通路在卵巢生殖干细胞增殖分化及卵巢衰老过程中起到关键调控作用[25]。神经营养因子家族(NTFS)是一类与神经细胞生长相关的具有神经营养活性的一类蛋白质分子[26]。研究证明,其家族的主要成员神经生长因子(NGF)、脑源性神经生长因子(BDNF)及其受体TrkA、TrkB和TrkC在动物早期性腺发育、配子发生、性别决定和妊娠等过程中的起到重要作用[27-29]。血管内皮生长因子(VEGF)家族及其受体在血管生成的过程中形成重要的信号通路。VEGF家族共有7个家族成员,分别是VEGF-A~-E和胎盘生长因子(PIGF)-l和-2VEGF 及其受体FLT1(Fms-related tyrosine kinase 1)和KDR(Kinase insert domain receptor)[30]。现有研究证实,VEGF家族成员在雌性哺乳动物的卵泡发育、卵母细胞的成熟、黄体的形成与功能的维持、子宫的周期性变化等生理过程中都起着十分重要的作用[31-33]。
本试验利用Illumina二代高通量测序技术对初情期母牛下丘脑-垂体-卵巢轴组织进行转录组测序,经过分析后得出初步结论:Notch信号通路、神经营养因子信号通路和血管内皮生长因子信号通路可能通过HPO轴参与了肉牛繁殖的相关调控活动。

