外泌体介导PCV2通过Toll7/8/9-MyD88-NF-κB信号通路诱导淋巴细胞分泌IL-10
段滇宁,李 凤,方婷婷,林毓婷,朱艳妍,杨小燕 ,2*,陈洪博,2*
(1.龙岩学院 生命科学学院,福建 龙岩 364012;2.福建省预防兽医学与兽医生物技术重点实验室,福建 龙岩 364012)
猪圆环病毒2型(PCV2)是断奶仔猪多系统衰竭综合征(PMWS)的主要病因,受PMWS影响的仔猪更容易与其他疾病出现混合感染,如猪繁殖与呼吸综合征、猪伪狂犬病和猪瘟等[1-3],对我国养猪业造成巨大威胁。越来越多的研究表明,PCV2是一种免疫抑制病毒,可抑制淋巴细胞的转化能力,并导致淋巴小结内的淋巴细胞凋亡,造成淋巴结内淋巴细胞严重缺失[4-5],使机体呈现免疫抑制状态。研究表明,PCV2感染可提高IL-10的表达量,IL-10是一种Th2型细胞因子,由活化的淋巴细胞、单核细胞等分泌,能够抑制Th1细胞的IL-2和IFN-γ的合成,诱导机体出现免疫抑制[6-7]。机体内IL-10表达量升高具有有效的抗炎活性,能降低机体对病毒清除能力[8]。
对PCV2感染的仔猪血清检测发现,IL-10水平显著升高,IL-10表达升高主要与T细胞有关,但与B细胞或巨噬细胞关系不大。在淋巴组织中IL-10的表达主要集中在T细胞区域,而在B细胞区域较少表达,如下颌淋巴结、脾脏和扁桃体,在PCV2感染的细胞中表达量低[9]。PCV2的靶细胞主要是巨噬细胞、上皮样细胞等,那么PCV2是如何诱导淋巴细胞产生IL-10呢,其中的调控机制尚不清楚。本试验拟以感染PCV2的PK-15细胞所产生的外泌体为研究对象,研究其对体外培养的仔猪淋巴细胞分泌IL-10的影响及其调控的信号通路,探讨PCV2引起仔猪免疫抑制的机制,为PCV2发病机制研究提供新的思路,并为PCV2防控寻找新的途径。
1 材料与方法
1.1 细胞和病毒PK-15 细胞系(无PCV污染)和PCV2-SH(AY686763,病毒滴度为1×10-5.5TCID50/mL),由本实验室保存。
1.2 主要试剂兔抗PCV2 Cap多克隆抗体、兔抗NF-кB /p65多克隆抗体、兔抗CD81多克隆抗体和兔抗β-actin多克隆抗体购自北京博奥森生物技术有限公司;兔抗TSG101多克隆抗体购自Sigma公司;兔抗磷酸化抑制性核因子кBα(p-IкBα)多克隆抗体购自美国Enzo Life Sciences公司;兔抗MyD88单克隆抗体购自美国Abcam公司;山羊抗兔 IgG-HRP、山羊抗兔IgG-FITC、TRIzol、反转录试剂盒和荧光定量PCR试剂盒、兔抗组蛋白3(Histone H3)多克隆抗体、细胞核蛋白提取试剂盒、BCA 蛋白检测试剂盒和化学发光底物检测试剂盒均购自上海碧云天生物公司;猪特异性IL-10 ELISA 试剂盒购自上海西唐生物科技股份有限公司;猪淋巴细胞分离液购自北京达科为生物技术有限公司。
1.3 淋巴细胞的分离培养3头经检测PCV2抗原阴性的35日龄断奶仔猪,颈静脉放血致死,无菌采集新鲜脾脏,去除表面血污及纤维组织,机械法剥离脾脏淋巴细胞,经200目不锈钢网筛过滤分离细胞,1 500 r/min 离心5 min,收集细胞沉淀。将细胞沉淀与淋巴细胞分离液=1∶1混匀,室温水平转子800 r/min离心30 min,小心吸取血浆层与分离液层中间的细胞层转移至新离心管中,加入10% 1640培养基,室温水平转子250 r/min离心10 min,弃上清,重复洗涤2次,用10%的1640培养基重悬细胞。将细胞在37℃二氧化碳培养箱中培养2 h除去单核巨噬细胞,收集上清液即为淋巴细胞,将细胞密度调整为1×106/mL备用。
1.4 外泌体(Exo)的提取当生长良好的PK-15细胞融合度达到80%时,将PCV2-SH按MOI=1.0接种PK-15细胞,在二氧化碳培养箱中感染2 h后,换为用无外泌体血清配置的2%维持液,48 h后收集细胞上清液,提取外泌体,即为P-Exo。按照试剂盒说明书操作如下:4℃、2 000 r/min离心30 min去除死细胞,10 000 r/min离心30 min去除细胞碎片,上清液用0.22 μm滤器过滤去除微囊泡;将上清液转移至新的离心管中,按照体积比Exosomes Concentration Solution试剂∶细胞上清液=1∶4加入,旋涡振荡充分混匀,于4℃静置2 h;将混合液10 000 r/min离心60 min,收集沉淀,用PBS充分混匀;将混悬液12 000 r/min离心30 min,上清液即富含外泌体颗粒;外泌体颗粒粗品转入Exosomes Purification Filter中,3 000 r/min离心10 min,收集管底滤液即为P-Exo,纯化后的P-Exo -80℃冰箱保存备用。提取未接毒PK-15细胞外泌体,标记为N-Exo。将外泌体样本与RIPA裂解液按体积比1∶1混匀,置于冰上裂解10 min,12 000 r/min离心5 min,取上清即为外泌体裂解组;BCA法测定外泌体浓度。
1.5 透射电镜观察将外泌体滴在2 mm铜网片上,用滤纸沿铜网片边缘轻轻擦拭,吸收多余水分。样品在室温下用醋酸双氧铀溶液染色5 min,干燥10 min,在80 kV下用透射电镜观察样品形态。
1.6 试验设计将淋巴细胞随机分为6组,分别是空白对照组、外泌体组(N-Exo)、PCV2组、PCV2外泌体组(P-Exo)、P-Exo裂解组(P-Exo lysis)和P-Exo 抑制剂组(P-Exo-BAY)。空白对照组为正常分离的淋巴细胞;N-Exo组接种N-Exo质量浓度为5.0 mg/L;PCV2组接种PCV2病毒MOI=1.0;P-Exo 组接种P-Exo质量浓度为5.0 mg/L;P-Exo lysis组将P-Exo超声波破碎后再孵育淋巴细胞;P-Exo-BAY组细胞铺板2 h后加入NF-κB抑制剂BAY 11-7082(终浓度50 mmol/L),孵育2 h后换成新的细胞培养液,再接种P-Exo质量浓度为5.0 mg/L;培养24 h后收获淋巴细胞和细胞上清液用于后续试验。
1.7 间接免疫荧光检测PCV2感染淋巴细胞取空白对照组、PCV2组和P-Exo组淋巴细胞置于黏附剂载玻片上,4%多聚甲醛固定,PBS洗涤3次,0.5% TritonX-100室温20 min;PBS洗涤3次,5% BSA在37℃恒温恒湿培养箱中1 h;PBS洗涤3次,加入PCV2 Cap多克隆抗体(1∶100稀释),37℃孵育 2 h;PBS洗涤3次,加入IgG-FITC荧光二抗(1∶200稀释),37℃孵育1 h;DAPI 室温染蓝30 min,甘油封片,荧光显微镜下观察并照相。
1.8 qPCR检测淋巴细胞TLRs mRNA变化 使用TRIzol方法提取淋巴细胞总RNA,根据说明书使用反转录试剂盒将RNA反转录成cDNA。qPCR反应体系由2 μL cDNA、10 μL SYBR Green、0.6 μL 上游引物、0.6 μL下游引物和6.8 μL双蒸馏水组成。以β-actin为内参,检测TLRs mRNA变化,引物序列见表1。

表1 TLRs和内参基因的引物序列及产物片段大小
1.9 ELISA检测IL-10表达量将淋巴细胞分4组,分别加入终质量浓度为0,2.5,5.0,10.0 mg/L的P-Exo,于24,48 h后收集细胞上清液,按照 ELISA 试剂盒说明书检测细胞培养上清液中IL-10含量。通过试验确定外泌体的质量浓度为5.0 mg/L,检测时间点为24 h。
1.10 Western blot检测NF-κB/p65、p-IκB和My-D88蛋白含量用细胞核蛋白提取试剂盒提取淋巴细胞胞浆和胞核蛋白,具体步骤参考文献[10]。将细胞浆和细胞核蛋白分别与5× SDS变性缓冲液混合煮沸5 min,10%聚丙烯酰胺凝胶电泳分离,转印到PVDF膜,在37℃温箱中5%脱脂乳封闭2 h后,在4℃冰箱孵育一抗(NF-кB /p65、p-IкBα、MyD88、Histone H3和β-actin,1∶1 000稀释)过夜,室温孵育二抗2 h,用ECL显影液检测,化学发光凝胶成像系统观察结果。

2 结果
2.1 外泌体的鉴定透射电镜观察外泌体的形态和太小,结果如图1A所示,提取的外泌体为杯状小囊泡,双层膜结构明显,直径为50~150 nm,大小不一。为进一步鉴定提取的外泌体,采用Western blot法检测外泌体的标志蛋白CD81和TSG101,结果如图1B所示,在不同来源外泌体中检测到目的条带,表明试验中成功提取外泌体。

A.透射电镜观察外泌体的形态;B.Western blot检测外泌体标志蛋白
2.2 PCV2感染PK-15细胞的外泌体鉴定将提取的外泌体进行Western blot检测,结果如图2所示,在P-Exo和PCV2感染的PK-15细胞中可以检测到PCV2 Cap蛋白,正常PK-15细胞及其分泌的外泌体中不含Cap蛋白,表明P-Exo中含有病毒粒子成分。

图2 Western blot鉴定外泌体
2.3 P-Exo对淋巴细胞的感染率间接免疫荧光法检测P-Exo对淋巴细胞的感染率结果如图3所示,PCV2 Cap蛋白染成绿色,细胞核染成蓝色;在对照组中无阳性信号出现,在PCV2组和P-Exo组中检测到阳性信号,主要位于细胞浆内,P-Exo组淋巴细胞阳性信号明显多于PCV2组,表明外泌体在PCV2感染淋巴细胞中起重要作用。

图3 P-Exo感染仔猪淋巴细胞(100×)
2.4 P-Exo对淋巴细胞分泌IL-10的影响将淋巴细胞分4组,分别加入终质量浓度为0.0,2.5,5.0,10.0 mg/L 的P-Exo,于24,48 h后收集细胞上清液,按照 ELISA 试剂盒说明书检测细胞培养上清液中IL-10含量。结果如图4所示,与对照组相比,5.0,10.0 mg/L的P-Exo孵育淋巴细胞24 h后IL-10的含量极显著升高(P<0.01),5.0,10.0 mg/L的P-Exo之间无显著性差异,确定后续P-Exo的质量浓度为5.0 mg/L,检测时间点为24 h。将PCV2或不同类型外泌体孵育淋巴细胞后,上清液中IL-10的浓度变化如图5所示,与对照组相比,PCV2感染淋巴细胞后IL-10表达量显著升高(P<0.05),P-Exo接种淋巴细胞后IL-10表达量极显著升高(P<0.01),而正常PK-15细胞分泌的外泌体或P-Exo lysis对IL-10表达无明显作用;淋巴细胞先孵育BAY 11-7082再接种P-Exo时,IL-10表达量显著升高(P<0.05);与PCV2组和抑制剂相比,P-Exo组IL-10表达量显著升高(P<0.05);结果表明P-Exo能够促进淋巴细胞分泌IL-10。

图4 不同质量浓度P-Exo对淋巴细胞分泌IL-10的影响
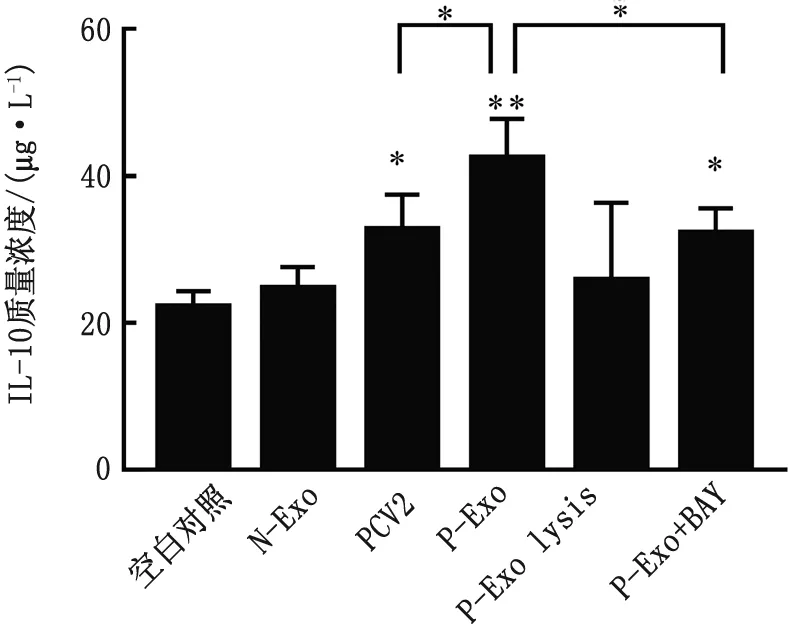
图5 不同刺激物对淋巴细胞IL-10分泌作用
2.5 P-Exo对淋巴细胞TLRs mRNA转录的影响P-Exo感染淋巴细胞后,淋巴细胞TLRs mRNA 转录水平的变化如图6所示。与对照组相比,P-Exo inhibitor组TLR2 mRNA转录水平显著升高(P<0.05),其他组与对照组相比无显著变化;与对照组相比,P-Exo组和P-Exo inhibitor组TLR3 mRNA转录水平显著升高(P<0.05),其他组与对照组相比无显著变化;与对照组相比,PCV2组TLR4 mRNA转录水平显著升高(P<0.05),其他组与对照组相比无显著变化;与对照组相比,P-Exo组和P-Exo inhibitor组TLR7 mRNA转录水平显著升高(P<0.05),其他组与对照组相比无显著变化,与PCV2组相比P-Exo组和P-Exo inhibitor组表达量显著升高(P<0.05);与对照组相比,Exo组、P-Exo组和P-Exo inhibitor组TLR8 mRNA转录水平显著升高(P<0.01),其他组与对照组相比无显著变化,与PCV2组相比P-Exo组和P-Exo inhibitor组表达量极显著升高(P<0.01);与对照组相比,P-Exo组和P-Exo inhibitor组TLR9 mRNA转录水平显著升高(P<0.01),其他组与对照组相比无显著变化,与PCV2组相比P-Exo组和P-Exo inhibitor组表达量显著升高(P<0.05)。试验结果表明, P-Exo主要改变Toll7/8/9 mRNA的表达。
2.6 P-Exo对淋巴细胞胞浆MyD88、p-IκBα和NF-κB/p65蛋白的影响P-Exo对淋巴细胞胞浆中MyD88、p-IκBα和NF-κB /p65蛋白的影响如图7所示。MyD88蛋白水平与对照组相比,Exo组无显著变化,PCV2组、P-Exo组、P-Exo lysis组和P-Exo inhibitor组显著升高,以P-Exo组升高最显著;p-IκBα蛋白水平与对照组相比,Exo组和PCV2组无显著变化,P-Exo组显著升高,P-Exo lysis组和P-Exo inhibitor组表达有降低趋势,NF-κB /p65抑制剂能够降低p-IκBα蛋白表达;NF-κB /p65蛋白水平与对照组相比,Exo组无显著变化,PCV2组、P-Exo组、P-Exo lysis组和P-Exo inhibitor组呈降低趋势,以P-Exo组降低最显著。试验结果表明,P-Exo能提高胞浆中MyD88表达,而NF-κB抑制剂对此无影响;P-Exo能促进IκBα的磷酸化过程,而NF-κB抑制剂能阻断P-Exo对IκBα的磷酸化;P-Exo降低胞浆中NF-κB /p65含量,促进其入核。
2.7 P-Exo对淋巴细胞胞核NF-κB/p65蛋白的影响P-Exo对淋巴细胞胞核NF-κB /p65蛋白的影响如图8所示。与对照组相比,Exo组、PCV2组、P-Exo lysis组和P-Exo inhibitor组无显著变化,P-Exo组显著升高。试验结果表明,P-Exo能促进NF-κB/p65入核,p-IκBα磷酸化过程被抑制后,NF-κB/p65入核减少。

图6 P-Exo对仔猪淋巴细胞中TLRs mRNA表达量的影响

图7 不同刺激物对淋巴细胞浆蛋白的影响

图8 不同刺激物对淋巴细胞核蛋白的影响
3 讨论
外泌体(exosomes,Exo)是由活细胞分泌而来的微小囊泡,直径为30~200 nm,浮密度为1.13~1.21 g/mL,具有脂质双层膜结构,内容物比较复杂,包含了mRNA、miRNA、lncRNA和蛋白质,甚至细胞器;外泌体可通过细胞膜受体直接激活受体细胞,也可运输内容物进入受体细胞,参与细胞间通讯。此外,许多病毒感染的细胞分泌的外泌体与正常细胞分泌的外体含量不同,它们也可能包含各种病毒蛋白、RNAs,甚至病毒粒子,因此病毒有可能利用外泌体进行传播并感染靶细胞[11-12]。近年来的研究表明,外泌体在HIV-1、HCV、HAV和DENV等几种病毒的传输中起重要作用,从HCV或HAV感染细胞中分离的外泌体被证明含有完整的病毒颗粒,并且能够将感染传播给其他细胞[13]。研究显示,PRRSV感染细胞分泌的外泌体中含有M、N和GP5等结构蛋白,不含GP4蛋白[14]。在本研究中,我们成功提取了PK-15细胞分泌的外泌体,其形态、大小及其标志蛋白质CD81、TSG101都符合外泌体的特征。更重要的是P-Exo中包含PCV2的主要结构蛋白Cap蛋白,在正常PK-15细胞外泌体中不含有Cap蛋白,而PCV2 Cap 蛋白是上调猪肺泡巨噬细胞中 IL-10 表达的关键组分[15]。进一步用P-Exo感染淋巴细胞,IFA结果显示在淋巴细胞内出现明显的阳性信号,且与PCV2组相比,阳性信号增多,表明外泌体在PCV2感染淋巴细胞中起重要作用。
PCV2特征是病毒粒子无囊膜,基因组为环状、闭合、单股的DNA,直径17~20 nm,呈20面体对称结构,PCV2粒子在CsCL中的浮密度为1.37 g/mL。PCV2基因组含有11个潜在开放阅读框(ORF)即ORF 1~11,其中ORF1编码病毒复制相关蛋白(Rep和Rep′),ORF2编码病毒的主要结构蛋白Cap蛋白;PCV2感染可引起机体免疫抑制,导致机体免疫平衡紊乱,易于感染其他疾病[16]。IL-10是一种由Th2细胞分泌,作为重要的免疫抑制性细胞因子能够抑制Th1细胞合成IL-2和IFN-γ细胞因子,调节细胞的生长与分化,参与炎性反应和免疫反应,是公认的炎症与免疫抑制因子。前期研究表明,IL-10通过抑制机体免疫反应促进病毒复制[17]。仔猪感染PCV2后组织中IL-10的表达量显著上调[9,18],而我们前期研究发现在体外试验中,PCV2诱导淋巴细胞表达IL-10作用不显著,这与KEKARAINEN等[19]研究报告相一致,表明PCV2可能不直接影响淋巴细胞。本试验结果表明,P-Exo能够促进淋巴细胞分泌IL-10,与单独PCV2感染淋巴细胞相比,IL-10表达量显著升高(P<0.05);而将P-Exo裂解后再孵育淋巴细胞,则IL-10的表达量显著降低,抑制剂BAY 11-7082降低 NF-κB /p65含量后IL-10的表达量显著降低,表明P-Exo可通过NF-κB通路影响IL-10的表达。
Toll样受体(Toll-like receptors,TLRs)是参与天然免疫的一类重要蛋白质分子,也是连接天然免疫和获得性免疫的桥梁。TLRs的主要信号途径包括MyD88依赖途径和MyD88非依赖途径,除TLR3外大多数TLRs介导的通路属于MyD88依赖途径。TLRs能够促使IκB磷酸化而降解,IκB与NF-κB解离,游离的NF-κB入核启动相应的基因转录[20]。Toll3/7/8/9定位于细胞内膜上,包括内质网、溶酶体和内含体等,可以识别在细胞内的病毒核酸物质,如双链RNA、单链RNA和一些DNA病毒的双链RNA中间产物;Toll2/4位于细胞膜上,主要识别一些病毒的包被蛋白。有研究发现,PCV2可改变巨噬细胞、淋巴细胞和PK-15细胞中TLRs的表达[21-23]。本试验结果表明,P-Exo感染淋巴细胞后,可显著提高淋巴细胞Toll7/8/9 mRNA的表达(P<0.01),提高淋巴细胞Toll3 mRNA的表达(P<0.05),而对Toll2/4 mRNA的表达无显著作用。PCV2直接感染则主要影响Toll2/4/9 mRNA的表达;P-Exo破膜后再感染淋巴细胞则对淋巴细胞中Toll3/7/8/9 mRNA的表达无显著性影响;抑制剂BAY 11-7082孵育淋巴细胞后,用P-Exo感染淋巴细胞对其Toll3/7/8/9 mRNA的表达也无显著性影响。
IL-10表达过程中NF-κB信号转导途径起重要作用[24]。DU等[15]研究表明PCV2感染猪肺泡巨噬细胞能诱导IκB磷酸化,促进且NF-κB/p50入核,而p65则无明显变化。Western blot结果显示,P-Exo能够显著升高淋巴细胞胞浆MyD88和p-IκBα蛋白含量,降低胞浆NF-κB /p65的含量,升高细胞核NF-κB/p65的含量;NF-κB /p65抑制剂BAY 11-7 082能够显著下调胞浆中IκB的磷酸化,抑制NF-κB入核,降低IL-10的表达。
PCV2感染PK-15细胞分泌的外泌体包含PCV2 Cap蛋白,外泌体可提高PCV2对淋巴细胞的感染率,通过Toll7/8/9-MyD88-NF-κB信号通路促进淋巴细胞分泌IL-10。

