西藏那曲牦牛源产气荚膜梭菌的分离鉴定及生物学特性
罗润波,贡 嘎,高家登,扎西次仁,白玛桑珠,索朗斯珠*
(1.西藏农牧学院 动物科学学院,西藏 林芝 860000;2.西藏那曲市畜牧兽医技术推广总站,西藏 那曲 852000;3.西藏那曲市班戈县农牧科学技术服务站,西藏 班戈 852500)
产气荚膜梭菌(Clostridiumperfringens)又称为魏氏梭菌(Clostridiumwelchii),是一类革兰阳性杆菌,芽孢杆菌属。产气荚膜梭菌在临床上属于条件性致病菌,在自然界和动物的胃肠道中均有广泛分布[1],最初在野生动物,包括野猪和山羊等体内分离鉴定到魏氏梭菌,随后逐渐传播到家畜当中,为世界各地的畜牧业带来了困扰。当动物肠道内菌群失调或紊乱时,产气荚膜梭菌会在体内迅速且大量增殖,并分泌外毒素导致宿主肠道疾病的发生,并伴随着毒血症或是猝死。根据分泌的4种毒素:α(CPA)、β(CPB)、ε(ETX)、ι(ITTXA和ITTXB)的不同,产气荚膜梭菌可被分为A、B、C、D、E 共5个毒素亚型[6]。
牦牛猝死综合征在临床上主要是由A型产气荚膜梭菌所引起,对我国牦牛饲养业造成了很大的经济损失。发病的牦牛会表现为急性出血性肠炎,实质性器官的出血,腹部肿胀,皱胃鼓气,并最终导致患畜突然死亡[7]。由于该病发病急,病程短,且引起该病的病原特征和发病机制并不清楚,因此值得进一步研究和深入探讨。
1 材料与方法
1.1 试验材料2018年5―7月份西藏那曲市多地牦牛发生猝死现象,死亡牦牛出现牛舌脱出口外,肛门外翻,腹部膨胀;剖检结果显示肠黏膜严重出血,各实质性器官有出血点和出血斑,肉质无明显异常(图1)。无菌采集猝死和发病牦牛的病料,包括肝脏、肺脏、心脏、肾脏、肠内容物和粪便。
1.2 主要仪器及耗材离心机、移液器由德国Eppendorf公司生产;PCR仪、电泳仪、凝胶成像系统均由美国BIO-RAD生产;厌氧罐由三菱化工提供。各类培养基及生化试剂均购自于青岛高科技工业园海博生物技术有限公司;PCR引物合成及测序由北京擎科生物科技有限公司武汉分公司完成;Taq DNA聚合酶、PCR试剂、核酸染料、克隆载体pMD18-T购自北京全式金生物技术有限公司;感受态细胞Trans 5α由TaKaRa公司制做并保存;胶回收试剂盒、质粒提取试剂盒由天根生化科技(北京)有限公司生产;革兰染色液、琼脂糖由北京陆桥技术责任有限公司生产;厌氧产气袋由日本三菱生产;药敏片由杭州微生物试剂公司生产。
1.3 细菌的分离病料送往实验室以后,进行触片,革兰染色镜检。同时,将病料接种于厌氧肉肝汤培养基中,37℃厌氧培养18~24 h后,选取产气组,用接种环蘸取少量菌液涂布于绵羊血琼脂平板,随后置于厌氧罐,37℃厌氧培养18~24 h。平板上形成有明显溶血环的单菌落挑入梭菌增菌培养基中厌氧培养24 h,获得分离菌株,并进一步进行鉴定。
1.4 生化试验生化试验参考伯杰细菌鉴定手册(第8版,表15.12)。将增菌后的菌液接种于不同的生化鉴定管中,生化试剂均购于青岛海博生物,包括酪蛋白(HB0252)、卵磷脂酶(HB0262)、吲哚(GS001)、脂酶(GB096)、葡萄糖(SN016)、甘露糖(GB069)、麦芽糖(SN017)、乳糖(GB004)和水杨苷(GB174)。
1.5 分离菌株的PCR鉴定严格按照试剂盒说明书要求进行分离菌株的基因组提取。采用16S rRNA扩增引物63F(5′-CAGGCCTAACACATGCAAGTC-3′),1387R(5′-GGGCGGWGTGTACA-AGGC-3′)对目的基因进行扩增[8]。扩增体系:上下游引物(10 μmol/L) 各1 μL, 10× TransTaq-T Buffer 5 μL,2.5 mmol/L dNTPs 4 μL,TransTaq-T DNA Polymerase 1 μL,模板2 μL,ddH2O 36 μL,总体系为50 μL。PCR反应程序:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 1 min (30个循环);最后72℃ 延伸 10 min。将PCR产物进行1%琼脂糖凝胶电泳后回收目的条带,并连入pMD18-T载体,最后转入Trans 5α中,挑取阳性克隆菌进行增殖并送测序。
1.6 多重PCR分型鉴定对分离菌株进行多重PCR毒素分型鉴定,产气荚膜梭菌的毒素分型引物见表1[4],基因组的提取同上。多重PCR扩增体系如下:上下游引物(10 μmol/L) 各1 μL(共4对引物,见表1),10× TransTaq-T Buffer 5 μL,2.5 mmol/L dNTPs 4 μL,TransTaq-T DNA Polymerase 1 μL,模板 2 μL,ddH2O 30 μL,总体系50 μL。PCR反应程序如下:94℃ 5 min;94℃ 30 s,53℃ 30 s,72℃ 30 s (30个循环);最后72℃ 延伸5 min。将PCR产物进行1%琼脂糖凝胶电泳。

表1 产气荚膜梭菌多重PCR毒素分型鉴定引物信息
1.7 分离菌的动物致病性试验和外毒素毒力试验将分离株接种到绵羊血平板中,37℃厌氧培养24 h 后挑取具有典型溶血环的单菌落,转接至厌氧肉肝汤培养基中厌氧培养14~16 h。按照5%的比例继续转接到厌氧肉肝汤培养基43℃厌氧振荡培养6 h,12 000 r/min 离心15 min 取上清,用0.22 μm 滤膜过滤,获得分离株外毒素。取上一步厌氧肉肝汤培养基的菌体,稀释到108CFU/mL,作为动物试验菌体。
制备的外毒素按照2倍倍比稀释,5只BALB/c小鼠为一组,每只腹腔注射0.2 mL。对照组注射等量无菌生理盐水,连续观察72 h,记录小鼠死亡情况。制备的菌体不稀释,5只BALB/c小鼠为一组,每只腹腔注射1 mL。对照组注射等量无菌生理盐水,连续观察72 h同时记录小鼠死亡情况。同时取菌体攻毒试验组小鼠的病变脏器进行触片染色镜检并进行细菌分离鉴定。
调查问卷分为《校企合作问卷调查表(学生用卷)》和《校企合作问卷调查表(企业用卷)》两种。其中学生用卷主要调查内容为:15道客观选择题和1道主观题(作为大学生,您希望在校开展哪些与专业相关的英语课程?) 通过学生用卷,主要了解到大学生更倾向于哪种大学英语教学模式、对于增设专业英语课程的看法、校企合作对于英语学习的启示以及校企合作下是否有助于大学英语教学改革等方面。企业问卷主要调查内容为:12道客观选择题和1道主观题(贵企业希望大学生加强哪些英语能力的培养?)通过企业用卷,调查企业期待的毕业生应具备哪些英语能力、英语在企业中的重要性和校企合作下的大学英语教学存在的主要问题等方面。
1.8 16S rRNA进化树分析对3株分离株16S rRNA序列的63~1 387碱基序列进行BLAST比对 (https://blast.ncbi.nlm.nih.gov/Blast.cgi)。将代表序列和分离株序列用MEGA 6.0 Clustal W算法进行比对分析,并参考邻接法绘制进化树(Bootstrap 1 000)。
1.9 药敏试验将3株分离株接种到厌氧肉肝汤培养基37℃厌氧培养至D600达到0.6~0.8,取300 μL 菌液涂布梭菌增菌培养基平板,并贴上对应的药敏片,在37℃厌氧培养24 h后测量其抑菌圈大小。
2 结果
2.1 产气荚膜梭菌的分离鉴定结果显示,所采集的样品中均成功分离出疑似产气荚膜梭菌菌株。分离菌株均为革兰阳性杆菌(图2)。在血平皿上形成典型的溶血环(图3),在厌氧肉肝汤培养基中产生大量气体,在石蕊牛奶培养基中“爆裂发酵”(图4)。生化试验结果显示:分离株对酪蛋白、吲哚、脂酶和水杨苷反应均为阴性,对卵磷脂酶、葡萄糖、甘露糖、麦芽糖和乳糖反应为阳性(表2)。根据《伯杰细菌鉴定手册》的结果作为参考,初步确定分离菌株为产气荚膜梭菌。同时在每头牦牛样品的分离菌株中挑选1株,共计3株细菌进行16S rRNA基因扩增(图5)。经过NCBI BLAST比对发现,3株分离菌均为产气荚膜梭菌。同时将基因序列上传GenBank(登录号为:MN960261、MN960262和MN960263)。

图2 细菌革兰染色镜检

图3 血平皿上菌落形态

图4 石蕊牛奶和厌氧肉肝汤生长情况


表2 分离菌株生化试验结果
2.2 产气荚膜梭菌的毒素分型对3株分离菌进行多重PCR扩增、鉴定,扩增结果见图6。结果显示,2株分离菌AD-01和AD-02只扩增出α毒素基因,为A型产气荚膜梭菌;BG-01分离株扩增出α和β毒素基因,为C型产气荚膜梭菌。
2.3 产气荚膜梭菌动物致病性和外毒素毒力试验试验组小鼠24 h内全部死亡,对照组72 h内精神状态良好,未见死亡。病死小鼠腹部略显膨大,对其尸体进行剖检,发现机体出现全身性病理变化,消化道以及实质性器官均存在程度不同的出血和病变。大脑出现淤血、脑积液增多;腹腔和胸腔内积存大量暗红色液体;小肠及胃部明显扩张膨胀,呈暗红色,少量出血,大肠黏膜也略肿胀;肝脏呈暗红色且明显肿胀。而对照组小鼠腹部未见膨胀,且剖检后腹腔、胸腔未见异常(图7)。
对病变脏器进行触片、镜检结果显示,病变脏器中存在大量革兰阳性杆菌。同时细菌的分离鉴定结果显示,试验组均能分离得到该病原菌,生理盐水对照组未分离到该细菌。对病变肝组织进行HE染色显示,死亡小鼠的肝脏出现充血、细胞核固缩浓染和细胞骨架破坏(图8)。
外毒素感染试验组小鼠精神状态不振、食欲不佳、毛皮竖毛、眼睛上睑下垂、暗沉。对照组小鼠精神状态良好,72 h内未见死亡。AD-01、AD-02以及BG-01分离株的死亡情况分别是:未进行稀释组72 h 内全部死亡;2-1试验组病死率均为40%;2-2试验组病死率分别是0%,20%,40%;2-3稀释倍数试验组病死率为0%,全部存活。具体试验数据见表3。以上动物试验结果显示,分离菌株及外毒素对小鼠均有强的致死性,符合产气荚膜梭菌的致病特征。

A.AD-01;B.AD-02;C.BG-01;D.空白对照
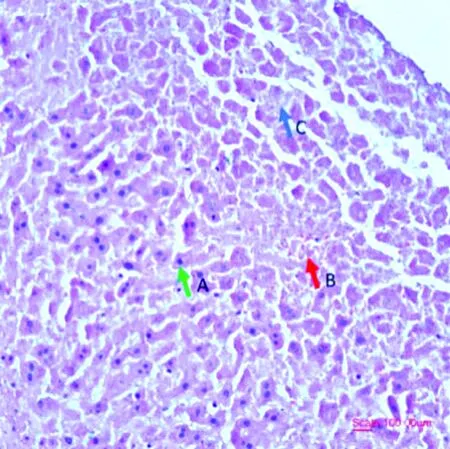
A.肝细胞核固缩浓染; B.充血; C.肝细胞骨架破坏
2.4 遗传进化分析将分离株16S rRNA 序列和国内外的经典菌株进行比较(图9),结果发现所分离得到的菌株在进化树上分属两个不同的分支。BG-01分离株同ATCC13124(人源,美国)分离株显示出较高的同源性,而且和LGM-J13、 J16、J9、J1株具有共同的来源(猪源,中国)。另外两株A型分离株,AD-01和AD-02,在产气荚膜梭菌的进化树上属于一个独立的分支。
2.5 药敏试验分离菌株的药敏试验结果如表4所示。结果显示,氨基糖苷类药物对分离菌均无作用。同时,分离菌对复方新诺明表现为耐药,对苯唑西林、头孢氨苄、多黏菌素B、呋喃唑酮表现出一定的耐药,对大多数常见抗菌药表现为敏感。
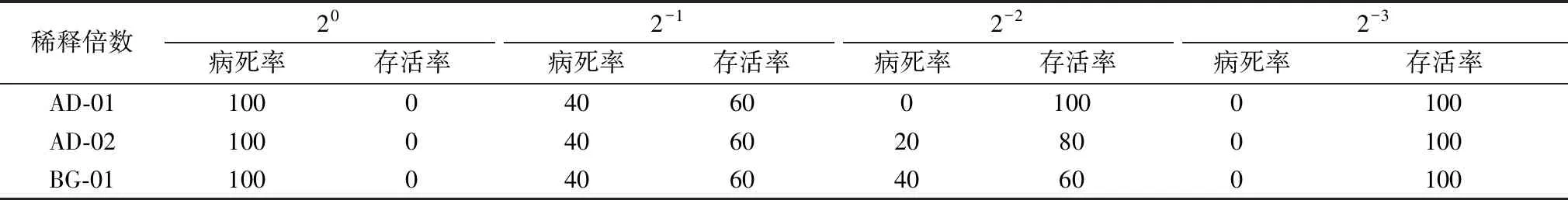
表3 外毒素攻毒后小鼠死亡情况 %

图9 基于3株分离株(●)16S rRNA序列进化树分析(MEGA 6.0,邻接法)
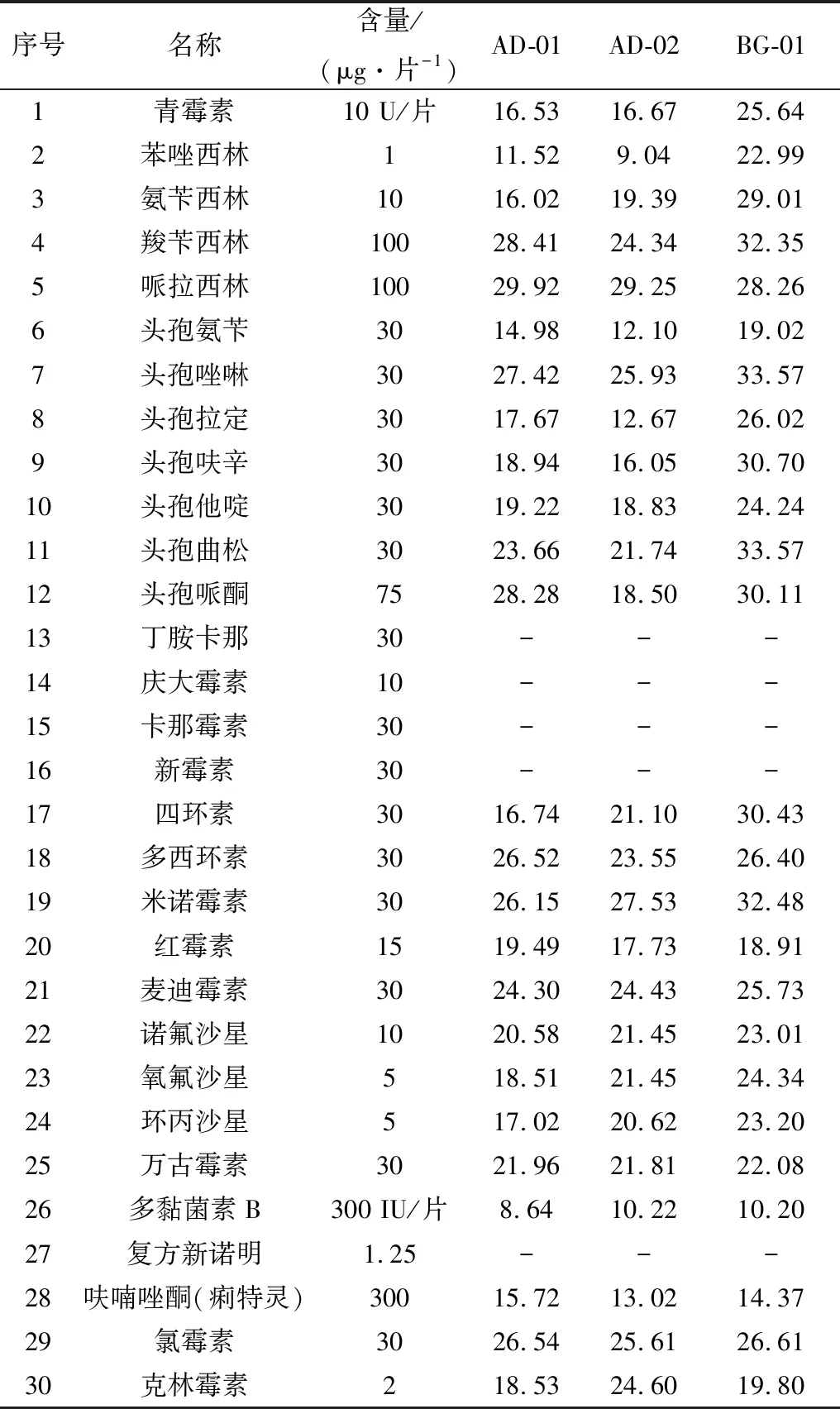
表4 分离株药敏试验的抑菌环直径 mm
3 讨论
近年来在世界范围内都有关于产气荚膜梭菌所引起动物疾病导致大量经济损失的报道,包括引起新生犊牛腹泻、犊牛皱胃炎、仔猪副伤寒以及鸡坏死性肠炎。也有研究证实产气荚膜梭菌能够在鸡、绵羊、山羊、猪或者是牛种群内引发大流行,因此产气荚膜梭菌值得我们深入研究和关注。本研究中,从病料中分离出疑似病原菌并进行了生化鉴定和挑取3株细菌进行16S rRNA的扩增鉴定,结果证实3株分离株均属于产气荚膜梭菌。这3株菌的动物致病性试验和外毒素毒力试验证实,分离株具有强烈的致病性,外毒素致死性强,符合产气荚膜梭菌通过分泌外毒素对宿主致病的特征。
基于产气荚膜梭菌的毒素多重PCR结果,可以将3株分离株归为两个亚型,其中AD-01和AD-02分离株为A型产气荚膜梭菌,BG-01分离株为C型产气荚膜梭菌。可见在西藏那曲市不同地区的流行毒株存在型的差异。资料显示,A型产气荚膜梭菌在我国是主要流行菌株,常见于自然环境中和动物粪便中。在西藏已有关于A型产气荚膜梭菌导致岩羊突然死亡的大量病例报道,这些猝死的岩羊主要表现为实质器官和肺脏的出血以及严重淤血。除此之外,A型产气荚膜梭菌在新疆地区的野猪群里也曾暴发过疫情。本研究中,在猝死的家畜中分离到了A型产气荚膜梭菌,这个结果暗示产气荚膜梭菌从最初的野生动物中的流行逐渐传播到家畜当中,应当引起重视。有趣的是,本研究从猝死的牦牛病料中也分离到了C型产气荚膜梭菌。一般而言,C型产气荚膜梭菌的分离多见于患有胃肠炎的猪或者鸡体内。然而在本研究中,证实A型和C型的产气荚膜梭菌均能够导致牦牛的猝死。
进一步的序列比对发现,BG-01分离株(C型)在进化树上同ATCC13124株和LGM株亲缘关系较近。LGM株本是从江苏南京的猪体内分离到的1株产气荚膜梭菌,BG-01分离株在进化树上的分布暗示产气荚膜梭菌在国内开始广泛流行。除此之外,AD-01和AD-02(A型)分离株在进化树上处于一个独立于国内其他分离株的分支上,这种进化的多样性一方面有可能是细菌适应西藏恶劣环境变异所导致的,另一方面也有可能是由于宿主的变化所致。基于产气荚膜梭菌16S rRNA的系统进化分析同产气荚膜梭菌的基因型或是致病特征无显著性相关。因此,一方面我们需要进一步扩大采样范围才能够分析产气荚膜梭菌关键毒素基因和遗传多样性,另一方面由于西藏地理环境的特殊性,对西藏地区产气荚膜梭菌引起的疾病和遗传进化情况值得我们深入调查。
近年来,由于临床对抗生素的滥用日趋严重,产气荚膜梭菌的耐药问题也变得越来越严峻。本研究对3株分离的产气荚膜梭菌进行了30种常用抗生素的耐药分析,结果显示,分离株对氨基糖苷类药物无作用,参考美国临床和实验室标准协会(CLSI)关于抗菌药物敏感性试验执行标准,我们发现梭菌对氨基糖苷类药物存在固有耐药性,因此该类药物对产气荚膜梭菌无作用。同时,3株分离株均对磺胺类药物复方新诺明耐药。有研究报道埃及分离的产气荚膜梭菌对多西环素耐药[23]。在本研究中,3株分离株对多西环素和四环素都具有较强的敏感性。除此之外,分离株对苯唑西林、头孢氨苄、多黏菌素B、呋喃唑酮表现出一定耐药。我们还发现AD-01和AD-02分离株的药敏试验结果相近,而BG-01的药敏试验结果与AD-01和AD-02分离株有一定差异。这可能是因为AD-01和AD-02分离株对应的地区有不合理使用抗生素所造成,提醒我们在临床上针对产气荚膜梭菌需要进行合理用药。临床上可以联合或者交叉使用敏感药物进行预防治疗以达到良好的效果。

