云南香猪PRRSV分离株ORF7基因遗传变异分析
郑龙龙,朱玲云,刘萍丹,赵德育,刘 佳,毕峻龙,杨贵树,舒相华*
(1.云南农业大学 动物科学技术学院,云南 昆明 650201;2.楚雄州动物疫病预防控制中心,云南 楚雄 675000)
香猪是我国优良微型地方猪种,具有体型矮小、肉质香嫩、皮薄骨细、玲珑美观和精灵逗人等特点,是加工制作色、香、味具全的高档肉产品的优质原料,一般饲养5~7周龄的乳猪出栏、屠宰最为合适。云南省普遍饲养巴马香猪,该品种源产于广西巴马瑶族自治县,是一个具有悠久的饲养历史和稳定的遗传基因且品质优良而珍贵稀有的地方小型猪品种。由于香猪饲养时间短,常不进行猪繁殖与呼吸综合征(PRRS)的免疫,因此容易感染该病。通过对猪繁殖与呼吸综合征病毒(PRRSV)毒株的全基因组序列进化树进行分析,推断HP-PRRSV毒株是由我国 CH-1a 样PRRSV毒株演化而来的。同时2006 年猪“高热病”也是由PRRSV变异株 (JXA1株) 引起的。
ORF7基因编码的N蛋白具有高免疫原性和较好的保守性,至少含有5个抗原决定簇[1],其中包括对美洲各型和欧洲各型的特异决定簇和所有毒株都保守的共同决定簇。由于这个特性,N蛋白能充当PRRSV的检测抗原,在PRRS的诊断方面有着十分重大的意义[2-3]。因此通过研究2001-2014年国内部分毒株编码ORF7基因可为研制 PRRSV 重组抗原和疫苗奠定理论基础。
本试验通过对云南香猪体内分离得到的PRRSV YN-2XZ1(GenBank序列号: 1776184) 和YN-3XZ2( GenBank序列号:1776193)毒株ORF7 基因进行克隆与序列分析,并与 GenBank 中公布的国内2001-2014年部分PRRSV 毒株的ORF7基因核苷酸序列进行同源性分析,为深入研究该毒株的遗传变异及其生物学特性提供参考依据。
1 材料与方法
1.1 病料来源采集云南省6个自治州20只1月龄疑似PRRS症状的香猪,临床出现双眼肿胀、有眼屎,呼吸困难、消瘦、腹泻、咳嗽、精神沉郁、食欲不振等症状,剖检可见肺脏出血、腹股沟淋巴结明显水肿出血等变化。
1.2 细胞及其他试剂Marc-145细胞购自上海中科院细胞库;DMEM细胞培养液、胎牛血清、双抗、胰酶和PBS购自Hyclone公司;EasyScript First-Strand cDNA Synthesis SuperMix、EasyScript Reverse Transcriptase(M-MLV,RNaseH-)购自北京全式金生物技术(TransGen Biotech)有限公司;其他试剂由云南农业大学动物科技学院传染病实验室提供。
1.3 样品处理取100 mg肺脏、50 mg淋巴结进行混合研磨,加入2 mL PBS液进行漩涡振荡,反复冻融3次,10 000 r/min离心30 min,取上清液1 mL加入100 μL双抗,4℃静止30 min。
1.4 病毒分离取500 μL样品处理液加入长至80%的Marc-145细胞中培养2 h,使用含5%胎牛血清的DMEM培养基进行盲传。第1代盲传后冻融3次,80 000 r/min离心4 h,取500 μL加入长至80%的Marc-145细胞中培养2 h,使用含5%胎牛血清的DMEM培养基进行盲传,逐日观察细胞病变(CPE)。
1.5 分子生物学鉴定参考段博芳等[4]方法进行ORF7基因PCR扩增,P1:5′-AATGGCCAGCCAGTCAATCA-3′;P2:5′-TCATGCTGAGGGTGATGCTG-3′,目的片段为330 bp。
1.5.1ORF7基因扩增及克隆 使用DNA提取试剂盒提取组织样品总DNA,根据PCR试剂说明书优化反应体系及条件,其中10×PCR Buffer 2.5 μL,dNTP Mixture 1 μL,上游和下游引物终浓度为0.2 μmol/L,Taq DNA聚合酶0.5 μL,模板300 ng(1.5~2.0 μL),加水补足25 μL。PCR反应条件:94℃ 3 min;94℃30 s,56℃ 30 s,72℃ 60 s,30个循环;72℃ 5 min 。取8 μL PCR扩增产物与适量上样缓冲液混合后,在120 V电压条件下用1.5%的琼脂糖凝胶进行电泳,30 min后在凝胶成像系统观测结果。将阳性PCR产物经切胶回收后与pMD18-T Vector进行连接反应,转化DH5α感受态细胞,挑取单克隆菌株,扩大培养,提取质粒,并使用限制性内切酶进行酶切鉴定。
1.5.2序列测定与分析 将鉴定为阳性的菌种进行测序分析,使用DNAStar和MEGA 4.0等生物学软件分别对所获得基因序列进行位点突变和遗传进化分析,并与国内外参考序列进行比较并绘制遗传进化树,参考序列见表1。

表1 分析所用的PRRSV毒株参考序列及其来源
1.5.3磷酸化分析 使用在线NetPhos 2.0 Server软件进行磷酸化预测,以磷酸化概率大于等于50%为有效数值,低于50%为无效数值,预测 ORF7基因编码的氨基酸磷酸化的可能性,为开发磷酸化抗体和基因突变研究提供理论依据。
1.5.4TCID50测定 取6孔细胞板中已长至单层的Marc-145细胞,胰酶消化稀释至1.0×105cell/mL的细胞悬液,96孔细胞培养板中每孔加入细胞悬液100 μL,静置于37℃、5% CO2培养箱中培养60 h,至细胞长至96孔板的80%,用含5%胎牛血清的DMEM培养基对病毒原液进行10倍倍比稀释,以10-1~10-9梯度向Marc-145细胞中加入病毒液,每一稀释度设6个重复,每孔接种100 μL。设6个孔为正常对照。置37℃、5% CO2培养箱中培养,持续观察120 h,结果按 Reed-Muench法计算TCID50。
1.5.5免疫印迹(WB)鉴定 初始1×105cells/mL的Marc-145细胞培养60 h后,使用毒力为200 TCID50/100 μL的毒株YN-2XZ1和YUN-3XZ2毒株接毒培养48 h,此时出现50%CPE,用PRRSV CH-la株的核衣壳蛋白( N蛋白)单抗进行WB试验。SDS配体胶60 V电泳70 min,90 V电泳40 min;60 V条件下使用0.22 μm PVDF膜,转膜1 h,鼠源N蛋白单克隆一抗(1∶100)4℃孵育10 h,PBS洗涤(10 min/次)3次;羊抗鼠二抗(1∶4 000)常温孵育2 h,PBS洗涤(10 min/次)4次,化学发光法检测WB结果。
2 结果
2.1 病毒致CPE观察将处理过的病料接种于Marc-145细胞,培养至第2代48 h时出现典型CPE,细胞聚集成丛、 固缩、变圆、部分细胞紧缩呈索状;72 h时表现为破碎、脱落(图1)。正常细胞未见异常。

A.正常Marc-145细胞;B.YN-2XZ1毒株72 h CPE;C.YN-3XZ2毒株72 h CPE
2.2 分子生物学结果
2.2.1ORF7基因扩增 细胞培养物经冻融3次后,提取总RNA,经核酸定量后使用100 ng进行RT-PCR扩增,用8 μL PCR产物经1.5%琼脂糖凝胶电泳检测,YN-2XZ1、YN-3XZ2毒株PCR扩增均在相近位置有1条带,与预期330 bp相符(图2)。
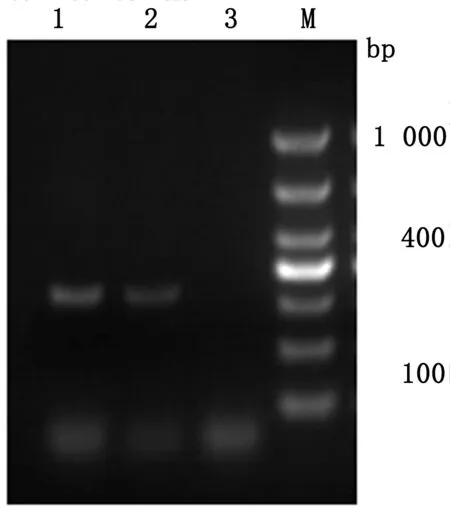
1.YN-2XZ1毒株PCR产物;2.YN-3XZ2毒株PCR产物;3.阴性对照;M.DL1000 DNA Marker
2.2.2免疫印迹(WB)鉴定 6孔板铺满80% Marc-145细胞时接种PRRSV 60 h,此时出现50%CPE。使用PBS洗涤的PRRSV CH-la株的核衣壳蛋白( N蛋白)单抗进行WB试验可见YN-2XZ1和YN-3XZ2毒株均具有特异性的信号,正常组检测不到信号(图3)。

图3 PRRSV N蛋白WB检测结果
2.2.3TCID50结果 使用96孔细胞板接种细胞培养物培养120 h后,按Reed-Muench法计算得出YN-2XZ1毒株的半数细胞感染力106.75TCID50/100 μL,YN-3XZ2毒株的半数细胞感染力106.05TCID50/100 μL。
2.2.4ORF7基因重组质粒酶切鉴定结果 将切胶回收纯化的ORF7基因的PCR扩增产物(330 bp)在4℃条件下经过12 h连接pMD18-T载体,转化入感受态细胞DH5α中,37℃振荡培养12 h后提取重组质粒进行酶切鉴定,用50 ng重组质粒经BamHⅠ和HindⅢ双酶切后,通过1.5%琼脂糖凝胶电泳检测得到2个大小分别为2 700,382 bp的目的片段,与预期相符,提示成功获得重组质粒(图4)。

1.YN-2XZ1毒株重组质粒酶切;2.YN-3XZ2毒株重组质粒酶切;M.DL1000 DNA Marker
2.2.5ORF7基因同源性分析 测序结果显示,试验获得的2株PRRSV ORF7基因长度为330 bp,编码110个氨基酸。利用生物学软件DNAStar对所获得的2株PRRSV ORF7基因序列与其他国内30条序列进行核苷酸同源性分析。结果表明,此次从香猪体内分离出的YN-2XZ1和YN-3XZ2毒株之间ORF7基因同源性为99.7%。YN-2XZ1毒株与国内2001-2014年参考序列核苷酸同源性为95.2%~100.0%,其中与2001-2005年参考序列核苷酸同源性分别为96.1%(CH-1a,2001),95.2%(CH2002,2002),95.2%(CH2003,2003),95.2%(CH2004,2004);与2006-2014年参考序列核苷酸同源性为98.5%~100.0%,与经典的美洲VR-2332毒株核苷酸同源性为94.0%。YN-2XZ2毒株与国内2001-2014年参考序列核苷酸同源性为94.9%~100.0%,与2001-2005年参考序列核苷酸同源性分别为95.8%(CH-1a,2001),94.9%(CH2002,2002),94.9%(CH2003,2003),94.9%(CH2004,2004);与2006-2014年参考序列核苷酸同源性为96.7%~100.0%,与经典的美洲VR-2332毒株序列核苷酸同源性为93.7%。
2.2.6遗传进化分析 遗传进化分析结果显示,国内毒株在2002-2004年与CH-1a毒株在一个分支,2005-2014年毒株在一个分支,均与美洲毒株VR-2332处于不同分支。本次获得的2株PRRSV与国内流行的变异PRRSV毒株ORF7基因进化同步(图5)。

图5 PRRSV ORF7基因遗传进化分析
2.2.7ORF7基因氨基酸突变分析 将获得的2株PRRSV ORF7基因编码的氨基酸序列和1999年公布的VR-2332毒株及我国2001-2014年公布的序列翻译的相应氨基酸序列进行比较(表2)。YN-2XZ1毒株和YN-3XZ2毒株ORF7基因编码的氨基酸无差异,与CH-1a毒株ORF7基因编码的氨基酸相比32位存在赖氨酸替换为精氨酸,35位存在丝氨酸替换为组氨酸,77位存在苏氨酸替换为丙氨酸,99位存在组氨酸替换为谷氨酰胺,103位存在缬氨酸替换为丙氨酸。
CH-1a毒株与国内2002-2014年毒株ORF7基因编码的氨基酸相比25位赖氨酸在2005年替换为精氨酸,32位赖氨酸在2006年、2007年、2009年、2011-2014年替换为精氨酸(R),35位丝氨酸在2006-2014年替换为天冬酰胺,40位天冬氨酸在2005-2014年替换为组氨酸,55位精氨酸在2002-2004年替换为脯氨酸,75位苏氨酸在2011年替换为丙氨酸,77位苏氨酸在2005-2014年替换为丙氨酸,95位组氨酸在2006-2007年、2009-2014年替换为谷氨酰胺,103位缬氨酸替换为丙氨酸。
CH-1a毒株与美洲毒株ATCCVR-2332 ORF7基因编码的氨基酸相比35位天冬酰胺替换为丝氨酸(表2)。
2.2.8N蛋白磷酸化分析 见表3。使用在线软件NetPhos 2.0 Server对参考序列及本次分析毒株序列进行磷酸化预测得出:2001-2005年22,35,63,85,103位丝氨酸有67.4%~99.8%的概率被磷酸化;45,54位苏氨酸有50.1%~93.6%概率被磷酸化,说明这5个位点极易发生突变。2006-2014年35位丝氨酸磷酸化概率低于50%,趋于稳定。

表2 ORF7基因片段中发生置换的氨基酸
3 讨论
本试验成功从香猪体内分离出2株PRRSV,均具有较高的致细胞病变效应,第2次传代即可造成Marc-145 细胞CPE,第2代细胞培养物进行半数细胞感染力测定,按Reed-Muench法得出YN-2XZ1毒株的半数细胞感染力106.75TCID50/100 μL,YN-3XZ2毒株的半数细胞感染力106.05TCID50/100 μL。2006年童光志等[6-9]从全国12个省市48个疑似PRSS发病猪场采集的样品研究表明,2006年前PRRSV分离毒株必须经原代巨噬细胞(PAM)传代后才能适应Marc-145细胞,从而产生显著CPE。在2006年暴发HP-PRRSV时分离出的15株PRRSV在Marc-145细胞上第1代盲传即可产生CPE,随后在我国分离的PRRSV毒株均表现出不需PAM细胞传代,盲传1~5代直接适应Marc-145细胞。本试验从香猪体内分离的PRRSV YN-2XZ1和YN-3XZ2毒株需经1次传代才能适应Marc-145细胞,产生CPE,致病力相对2006年HP-PRRSV显著下降,提示云南香猪群体中PRRSV可能不具有高暴发性和高致病力,不会引起重大经济损失和社会恐慌,但仍需对此加以关注。猪是PRRSV的唯一宿主,目前主要以疫苗接种来进行预防,免疫失败是造成PRRSV大规模流行和重大经济损失的主要原因。范阿春等[11-13]对云南省PRRSV的血清学及危害情况进行调查分析得出云南省PRRSV免疫后抗体阳性率为82.76%~100.0%,表明云南省PRRSV免疫状况较好,暴发大规模PRRSV的可能性较小,与本研究的推断相同。但是由于香猪饲养时间短,免疫接种情况较差,因此仍然面临PRRSV的威胁,并有可能传染给大规模饲养的家猪,造成重大经济损失的可能性依然存在,因此需要对香猪PRRSV感染状况进行关注,以防止其散毒并造成家猪的大规模感染。

表3 ORF7基因编码氨基酸磷酸化分析(磷酸化概率) %
对CH-1a毒株与2006-2014年HP-PRRSV毒株序列分析得出:CH-1a毒株55位精氨酸替换为脯氨酸,77位苏氨酸替换为丙氨酸,103位缬氨酸替换为丙氨酸;使用CH-1a毒株制备的单克隆N蛋白抗体进行WB试验,仍然可以检测到目的条带,提示55,77,103位氨基酸的替换不影响使用WB的方法检N蛋白。使用在线软件NetPhos 2.0 Server对ORF7基因编码的氨基酸进行磷酸化分析得出:参考毒株和此次分离毒株的54位苏氨酸和85位丝氨酸磷酸化可能性高于90%,有较高的突变可能性,因此该位点具备较高的可能性通过定点突变获得单克隆磷酸化抗体,可以用于区别野毒株和疫苗毒株[13-15]。
2005年前N蛋白35位丝氨酸磷酸化概率为67.4%~99.8%,2006-2014年N蛋白35位丝氨酸磷酸化概率低于50%,在2006年国内暴发HP-RRSV至今,各省份主要流行HP-PRRSV,提示该位点氨基酸不易于磷酸化可能与 NSP-2蛋白基因缺失从而引起HP-RRSV有关[16-18],但需要进一步研究证实。N蛋白中含有类似于核定位信号(nuclear localzation signal,NLs ) 的保守的碱性决定簇。2009年李吉达等[19]对辽宁、吉林、河北、山东、河南、江苏、浙江、广西等省PRRS疫情进行跟踪调查,并分离出11株PRRSV毒株,通过分析指出N蛋白Pat7基序的突变可能会影响PRRSV的核定位,与本研究结果有相近之处,需要进一步研究加以验证。
本试验对及时掌握PRRSV ORF7基因的遗传变异,了解N蛋白免疫原性和疫苗保护效率,为有效研发新疫苗及临床用疫苗的选择等提供了理论依据,并为全面预防和控制本病提供支持。随着人们对生活质量的重视与生活品质的追求,以及地方品种资源的开发,云南省及国内其他省市的香猪数量将会在未来显著增加,因此很有必要对存在于香猪群体中的PRRSV毒株进行分子流行病学研究,以了解流行状况和基因变异,对目前最为有效的疫苗预防方式提供高效的选择依据具有重要的实际意义与参考价值。

