鸭坦布苏病毒E蛋白具有独特交叉反应性中和表位的鉴定
林委卫,陈雪明,李晨曦,白小飞,刘 明,张 云
(中国农业科学院 哈尔滨兽医研究所 兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
鸭坦布苏病毒(DTMUV)是黄病毒科黄病毒属的单股正链RNA病毒。该病毒家族还包括登革热病毒(DENV)、西尼罗河病毒(WNV)、日本脑炎病毒(JEV)、蜱媒脑炎病毒(TBEV)、寨卡病毒(Zika virus)等重要媒介传播人畜共患病毒,这些病毒常引起严重的发病率和死亡率,黄病毒的流行仍然是世界范围内的主要公共卫生问题。
黄病毒感染后,动物产生特异性和交叉反应性两种类型抗体。交叉反应性抗体会引发3个具有公共卫生意义的问题。首先,交叉反应抗体使得血清学诊断无法识别被感染的病毒,特别是当发生不同的黄病毒感染时。其次,交叉反应抗体可能通过抗体依赖性增强(ADE)导致更严重的黄病毒继发感染,特别是继发性DENV、WNV和ZIKV感染[1-2]。第三,交叉反应抗体所致的ADE又引发了人们对黄病毒疫苗研发的担心。最近暴发的ZIKV使黄病毒疫苗的研发更加困难和复杂,因为无论在体内还是体外,抗DENV、WNV和ZIKV的抗体已被证明能够彼此间发生交叉反应,且这些抗体能增强其他黄病毒的感染或复制[1-2]。因此,了解E蛋白交叉反应表位对于提高公众对这些病毒的认识至关重要。
DTMUV对鸭的产蛋量[3-4]有毁灭性的影响。DTMUV是黄病毒科黄病毒属的一员,其E蛋白氨基酸序列与JEV(66.0%)、WNV(65.3%)、ZIKV(53.0%)、DENV(45.3%)、黄热病病毒(44.3%)和TBEV(41.1%)具有高度的相似性。DTMUV在老鼠动物模型中表现出年龄依赖性的神经侵袭,并介导ADE疾病感染的严重性[5]。
与其他黄病毒一样,DTMUV基因组编码1个多聚蛋白,在宿主和病毒蛋白酶作用下裂解成3种结构蛋白(C、prM/M和E)和7种非结构蛋白[6]。黄病毒E蛋白是诱导机体产生免疫保护性抗体的主要抗原,在膜融合和介导病毒与细胞受体结合过程中起至关重要作用[7]。因此,黄病毒E蛋白直接影响病毒的宿主范围、组织嗜性和毒力。其他黄病毒E蛋白和表位的X射线晶体学分析表明,E蛋白包含3个典型结构域(结构域Ⅰ[DⅠ]、DⅡ和DⅢ)。
前期利用单克隆抗体3B6、1F3和1A5,已经成功鉴定出表位374ExE/DPPFG380、221LD/NLPW225和87YAEYI91 [8-9]。黄病毒E蛋白具有保护性免疫功能,鉴于其产生难以区分的交叉反应性抗体,给血清诊断带来严重困难。此外,交叉反应抗体还通过ADE增加继发性黄病毒感染后疾病的严重性。因此,鉴定交叉反应表位对于了解血清诊断和提高黄病毒感染ADE相关问题的认知至关重要。
1 材料与方法
1.1 材料和试剂单克隆抗体1G2由本实验室制备保存[10];日本乙型脑炎病毒(JEV)由上海兽医研究所童光志研究员惠赠。pGEX-6P-1、pET30a和pCDNA3.1质粒、感受态大肠杆菌DH 5α及感受态细胞BL 21(DE3)均购自宝生物(TaKaRa)公司;限制性内切酶EcoRⅠ和XhoⅠ购自New England Bio Labs 公司;T4DNA连接酶购自TaKaRa公司;质粒小量试剂盒购自 Axygen 公司;辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG购自KPL公司;蛋白质相对分子质量Marker购自MBI公司;DAB显色液购自北京中杉金桥公司。
1.2 中和试验(PRNT)利用Protein G亲和层析柱对1G2进行纯化,非中和的同型对照单抗1B11作为阴性对照。将纯化的单克隆抗体1G2连续10倍稀释与约100 PFU的DTMUV混合,并在37℃孵育1 h,然后将混合物(200 μL/孔)添加到BHK-21细胞单层中,孵育1 h。去除上清,然后将含有1%低熔点琼脂糖的DMEM(含4%的FBS)铺于细胞上,再培养4 d后,用TrueBlue (KPL,Gaithersburg,MD,USA)进行染色,记录噬斑数。
1.3 抗原表位的筛选参考文献[11]所述的原核表达菌系统,表达了来自DTMUV E蛋白的一系列截短肽。利用人工合成的6对针对重叠截短E蛋白基因(命名P1-P6)设计引物,利用EcoRⅠ/XhoⅠ限制性位点(表1)将其克隆到带有His标签的pET30a(Novagen,Madison,WI)载体中。为了进一步精确地定位表位,将位于E蛋白221~235 aa的多肽进一步合成6个部分重叠肽的多肽基因(命名为P7-P12),并将其克隆到带有GST标签的pGEX6p-1载体中。将阳性重组质粒转化大肠杆菌Rosetta(DE3)细胞,在37℃下用1.0 mmol/L IPTG诱导4 h,用Western blot检测各肽对1G2的免疫反应。
1.4 关键氨基酸位点的确定为了精确定位MAb 1G2结合的关键残基,根据最小表位GSSAGTWQN的序列,用逐个氨基酸定点突变的方法,设计合成相应多肽的寡核苷酸序列(表2)。在互补的2条寡核苷酸链中,正义链5′-端引入XhoⅠ酶切位点,反义链5′-端引入EcoRⅠ酶切位点。2条互补的寡核苷酸链,退火后可形成双链的DNA,可直接与EcoRⅠ和XhoⅠ酶切处理的pGEX-6P-1载体连接,得到重组质粒测序验证。将重组质粒转化大肠杆菌Rosetta(DE3)细胞,在37℃下用1.0 mmol/L IPTG诱导4 h,用Western blot检测各个突变肽对1G2的免疫反应。以融合表位肽P11(GST-GSSAGTWQN)和肽N(GST-YIRTPACWD,番鸭呼肠孤病毒σB蛋白表位肽)[11]为阳性对照和阴性对照。

表1 克隆截短E蛋白所用引物

表2 克隆表达突变氨基酸表位多肽所用引物
1.5 Western blot 分析将测序正确的重组质粒进行诱导,表达后的样品经SDS-PAGE电泳后,电转移到纤维硝酸素(NC)膜上;用5%脱脂乳(PBS)4℃封闭过夜,PBS洗3遍,每遍5 min;以1∶1 000倍稀释的单抗1G2作为一抗,37℃孵育1 h;PBST(0.1% Tween-20)洗3遍,每遍5 min;然后1∶2 000倍稀释的HRP标记的山羊抗小鼠 IgG作为二抗,37℃孵育1 h;PBST(0.1% Tween-20)洗3遍,每遍5 min;DAB显色观察结果。
1.6 表位交叉反应性分析采用免疫荧光法(IFAs)检测1G2对DTMUV、JEV、ZIKV和WNV的交叉反应性。人工合成WNV(Ew)和ZIKV(Ez)的E编码基因。参考DTMUV E蛋白真核表达方法[12],将合成基因克隆到pCDAN3.1(Invitrogen,Carlsbad,CA)中,以构建重组质粒pCDNA-Ew和pCDNA-Ez。在6孔板中80%融合的BHK21细胞感染DTMUV或JEV(0.001 MOI),或参考DTMUV E蛋白的真核表达方法[12],转染pCDNA-Ew或pCDNA-Ez。感染或转染的BHK21细胞在DMEM中于37℃孵育48~72 h。细胞于4℃在10%福尔马林中固定过夜,用70%乙醇渗透20 min,并在免疫染色前用磷酸盐缓冲液(PBS)冲洗。以单克隆抗体1G2或正常小鼠血清稀释300倍作为阴性对照。37℃孵育1 h后,用PBST洗涤细胞3次。然后用FITC结合抗鼠IgG(KPL)200倍稀释液在37℃下处理细胞0.5 h,并用PBS冲洗。然后用2 mg/L Hoechst染色,在室温下染色10 min,并用PBST清洗5次后,用共聚焦荧光显微镜检测阳性细胞。
1.7 E蛋白的结构分析由于DTMUV E蛋白与JEV具有62%的序列同源性,因此DTMUV的模型可依据JEV的jeveprotein(PDB-ID:3P54)[13]的晶体结构模型。即利用PyMOL[14]中的quat.py(https://pymolwiki.org/index.php/biolocalunit/quat)建立基于JEV包装对称性的成熟DTMUV病毒模型。1G2表位的假定构象是由MODELLER等[15]中的完全模拟退火分子动力学过程生成的。从100个独立生成的模型中,选择10个势能最低的模型进行进一步的分析。1G2表位的均方根波动(RMSF)由pymol中的RMSF_states.py脚本(http://pldserver1.biochem.queensu.ca/~rlc/work/pymol/)计算。用POPS(32)计算了DTMUV E蛋白在残留水平上的极性。
2 结果
2.1 单抗1G2中和活性和最小表位的确定用PRNT法测定纯化的1G2对DTMUV的中和活性。结果表明,PRNT50质量浓度为(0.32±0.07) mg/L时,单克隆抗体1G2能有效中和DTMUV,而对照单克隆抗体1B11不能中和DTMUV。为了确定1G2的最小表位,使用单克隆抗体1G2和E蛋白的表达重叠肽(表1)进行了Western blot。多肽P1、P2、P3、P5、P6、P7、P8、P9、P11和PE被1G2识别(图1);P4、P10、P12和阴性对照(Pc1和Pc2)不被1G2识别。结果表明,1G2只与含有特定氨基酸序列GSSAGTWQN的多肽反应,而与截短的缺少G或N的多肽以及阴性对照肽(Pc1或Pc2)不发生反应。1G2只与含有特定氨基酸序列核心GSSAGTWQN [P11(227~235 aa)] 的肽反应,证实GSSAGTWQN是1G2识别所需的最小氨基酸序列。

M.蛋白Marker;P1~P12.表1截短的E蛋白片段;PE.表达的E蛋白;Pc1,Pc2.pET30a 和 pGEX6p-1表达的阴性对照
2.2 关键氨基酸残基鉴定通过Western blot检测1G2对突变重组肽的反应性来确定关键氨基酸位点。当表位重组肽中的氨基酸发生突变时:即Ser229Thr(S229T)、Gly231Ala(G231A)、Thr232-Ser(T232S)和Trp233Phe(W233F),Western blot(图2)显示,S229T和T232S的突变对1G2的反应性没有任何影响,而G231A和W233F的突变则消除了与1G2的反应性。接下来当表位肽氨基酸发生单一突变Gly227Ala(G227A)、Ser228Ala(S228A)、Gln234Ala(Q234A)、Asn235 Thr(N235-T)和Ala230Thr(A230T)以及Gly231Ser(G231S)和Trp233Tyr(W233Y)时,Western blot结果显示,G227A、S228A、Q234A和N235T的突变对1G2的反应性没有影响;但是发生Gly231(G231S)和Trp233(W233Y)的突变时,完全消除了表位与1G2的反应性。结果表明,W233(W233F/W233Y)或Gly231(G231A/G231S)的突变消除了与1G2的结合,证实W233和Gly231是1G2与表位结合的关键氨基酸位点。
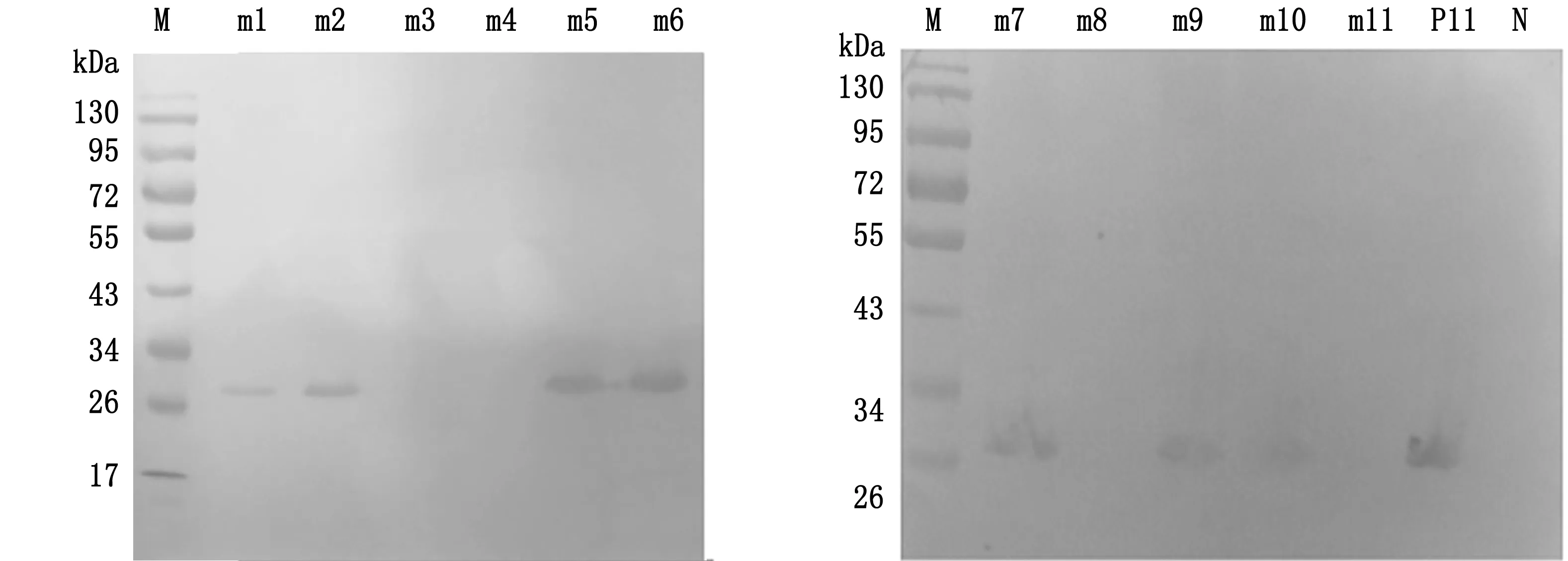
M.蛋白Marker;m1~m11.表2中突变表位肽;P11 (GST-GSSAGTWQN),N (GST-YIRTPACWD).分别用作阳性和阴性对照
2.3 1G2对DTMUV、JEV、WNV和ZIKV中E蛋白的识别为了进一步确定1G2是否能与转染质粒pCDNA-Ew和pCDNA-Ez或感染DTMUV或JEV的BHK-21细胞表达的E蛋白抗原结合,进行了免疫荧光分析(图3)。用荧光共聚焦显微镜观察,1G2在转染或病毒感染的细胞中均表现出特征性的胞浆绿色荧光,而未感染细胞未发现绿色荧光(略),表明1G2是识别DTMUV、JEV、WNV和ZIKV的交叉反应性抗体。
2.4 表位定位DTMUV E蛋白单体包含3个结构域(图4A)。1G2识别表位位于DⅡ的hi环(h和i链之间)(图4A)。hi环是DⅡ中段凹槽的一部分。229S、232T和233W的侧链面向DⅡ的上表面,228S和230A的侧链面向DⅡ的外表面(图4B)。然而,233W的大芳香侧链被来自链a、d和h的残基包围,因此其极性降低。尽管234Q和235N被预测为E蛋白二聚体上的暴露残基,但它们的侧链面向病毒膜(图4B,C),因此,成熟的DTMUV粒子上的这2个残基无法被抗体识别(图4D)。
3 讨论
通过使用Western blot和重叠肽筛选策略,成功地鉴定了最小表位227GSSAGTWQN235。如IFA所示,1G2与JEV感染或pCDNA-Ew/Ez转染BHK-21细胞中的E蛋白反应,证实GSSAGTWQN是DTMUV、JEV、WNV和ZIKV的交叉反应表位。仅231G或233W突变就破坏了1G2与JEV、WNV和ZIKV E蛋白的结合,提示231G和233W是这些黄病毒的交叉反应性表位关键氨基酸位点。氨基酸W233在黄病毒中是完全保守的,包括DTMUV、JEV、ZIKV、WNV、YFV、DENV1-4、MVEV和SLEV。已经报道1B7-5、6B6C-1和4G2多个单抗识别DⅡ[16]融合环上的一组重叠表位(G104/G106/G107/E126/T226和W233),考虑到1G2识别E蛋白中的关键氨基酸G231和W233,1G2表位代表了DⅡ hi环上一种新的交叉反应性中和抗原表位。DTMUV E蛋白结构的三维结构分析表明,表位GSSAGTWQN,包括2个关键氨基酸G231和W233,均暴露在成熟病毒粒子表面,构成一个新的构象表位。

图3 免疫荧光方法对单抗1G2与DTMUV、JEV、WNV和ZIKV交叉反应的鉴定(单抗1G2与Hoechst对感染DTMUV 和JEV 或转染 pCDAN-Ew 和 pCDAN-Ez 后的BHK-21 细胞表达的E蛋白后的共定位荧光检测)
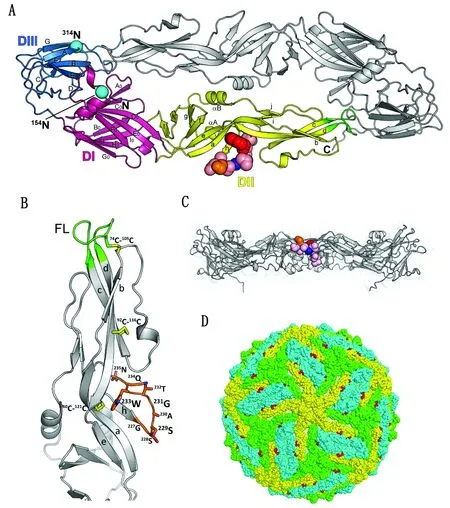
A.DTMUV E 蛋白二聚体(DTMUV E 单体有3个结构域:DⅠ (洋红色),DⅡ(黄色),DⅢ (蓝色),彩色球代表表位(GSSAGTWQN)中的氨基酸,229S、231G和233W 分别用橙色、蓝色和红色表示,2个预测的N-糖基化位点用天蓝色球表示);B.DTMUV E蛋白的结构域Ⅱ(1G2表位用橙色枝条表示,融合环 (FL)绿色表示,二硫键用黄色枝条表示);C.DTMUV E 蛋白二聚体侧面图(229S、231G和233W分别用橙色、蓝色和红色表示);D.1G2表位残基(红色)在成熟的DTMUV伪原子模型图中的定位
除JEV、MVEV或SLEV外,大多数黄病毒都含有G231氨基酸,包括表位区的DTMUV、ZIKV、WNV、YFV、DENV1-4、MVEV和SLEV。由于缺乏侧链,231G在抗体识别中不可能起作用,然而,它可能对环结构(或表位结构)的形成起重要作用。231G残基不保守,但许多黄病毒E蛋白需要在该环域中的1个或2个甘氨酸来形成β-转(YFV有3个甘氨酸)。对于那些环中没有甘氨酸的E蛋白(JEV、SLEV和MVEV),可能需要脯氨酸残基来形成β-转角,这意味着231G对于功能表位的结构完整性非常重要,而残基本身不是用来识别的[17-18];这也表明1G2识别天然的E蛋白单体仅在非还原条件下,但不与变性和还原的E蛋白结合。
总之,本研究鉴定了黄病毒一个新的交叉反应性表位,为DTMUV和其他黄病毒E蛋白表位的结构、功能以及表位疫苗的研究提供了新的见解。此外,本研究还可以提高人们对黄病毒血清诊断中出现的交叉反应问题的认知。

