氧糖剥夺/复氧所致细胞焦亡在肺微血管内皮细胞损伤中的作用*
肖宗懿, 王小燕, 易 寒, 宋 娟, 安雨轩, 王寿勇
(重庆医科大学附属儿童医院麻醉科,国家儿童健康与疾病临床医学研究中心,儿童发育疾病研究教育部重点实验室,儿科学重庆市重点实验室,重庆400014)
肺微血管内皮细胞损伤是体外循环所致急性肺损伤(acute lung injury,ALI)的基本病理生理改变之一,它继发于缺血再灌注和高炎性因子背景之下[1]。细胞焦亡是一种程序性细胞死亡过程,它区别于其它程序性细胞死亡方式的最显著特点是伴随强烈炎症反应[2]。研究表明,缺血再灌注是诱发多种细胞发生焦亡的有效外界刺激因素[3-6],但体外循环相关性肺损伤中是否涉及微血管内皮细胞焦亡机制,目前尚不清楚。本研究拟以人肺微血管内皮细胞(human pulmo⁃nary microvascular endothelial cells,HPMVECs)为研究对象,通过建立氧糖剥夺/复氧(oxygen-glucose de⁃privation/reoxygenation,OGD/R)细胞模型,来模拟体外循环中HPMVECs的缺血再灌注过程,观察OGD/R是否诱发细胞焦亡,为进一步理解体外循环所致急性肺损伤发生机制提供新的理论参考。
材料和方法
1 细胞株和主要试剂
原代HPMVECs 购自武汉普诺赛生命科技有限公司。ECM 完全培养基购自Sciencell;无糖DMEM培养基购自迈晨科技有限公司;ELISA 试剂盒购自欣博盛公司;乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒购自南京建成;MTT试剂盒购自北京索莱宝公司;Trizol 购自Invitrogen;逆转录试剂盒购自MedChemExpress;兔抗人caspase-1多克隆抗体、兔抗人核苷酸结合寡聚化结构域样受体蛋白3(nucleo⁃tide-binding oligomerization domain-like receptor pro⁃tein 3,NLRP3)多克隆抗体、兔抗人含caspase 募集结构域的凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a caspase recruitment do⁃main,ASC)多克隆抗体和鼠源GAPDH 抗体均购自Proteintech;山羊抗兔Ⅱ抗和兔抗鼠Ⅱ抗购自成都正能生物;caspase-1抑制剂VX-765购自APExBIO。
2 主要方法
2.1 预实验筛选HPMVECs 适宜OGD/R 的条件内皮细胞用ECM 完全培养基(含5%胎牛血清、1%青霉素-链霉素和1%内皮细胞生长因子)在37℃、5% CO2的环境下培养,每1~2 d 换液,细胞密度达90%以上时进行传代。取3~4 代细胞进行预实验,将细胞接种于96孔板上(每孔25 000~30 000个),并分为对照(control)组和OGD/R 各组,每组设置3个复孔。control 组全程平行对照培养,仅与各OGD/R 组平行时点实施更换完全培养基操作;OGD/R 组分别采用DMEM 无糖培养基于94%N2、1%O2、5%CO2条件下培养2、4 和8 h,然后采用与对照组相同条件复糖复氧继续培养12 h。处理结束后采用MTT 法检测细胞活力,并在倒置显微镜下观察细胞形态学改变。结果显示OGD 处理8 h 细胞活力显著降低,且细胞形态改变类似细胞焦亡,故后续实验中采用OGD 8 h、恢复12 h为本研究实验条件。
2.2 实验分组 取3~4 代细胞分为control 组、OGD/R 组和VX-765(caspase-1 抑制剂)组。OGD/R 组按照预实验筛选条件培养;control 组不实施OGD/R 处理,仅在平行时点更换新鲜培养液;VX-765 组在OGD/R 之前4 h 给予VX-765(50 μmol/L)处理,其余培养条件同OGD/R组。
2.3 RT-qPCR 法 检 测caspase-1、NLRP3 和ASC 的mRNA 水平 用Trizol 法提取总RNA,用逆转录试剂盒获取cDNA,使用SYBR Green 进行RT-qPCR,目标基因引物见表1。逆转录的条件设定为:25℃5 min,42℃30 min,85℃2 min。实时荧光定量PCR条件设定为:95℃3 min;95℃10 s,60℃30 s,共39个循环。所有实验至少重复3次。

表1 RT-qPCR引物合成序列Table 1. The sequences of the primers for RT-qPCR
2.4 Western blot法检测caspase-1、NLRP3和ASC的蛋白水平 细胞处理结束后,PBS 清洗并用胰酶消化,收集细胞沉淀,用全蛋白提取试剂盒提取总蛋白,BCA 法测定蛋白浓度后将蛋白煮沸12 min 变性。以20 μg蛋白上样至10%的聚丙烯酰胺凝胶,通过SDSPAGE将蛋白混合样分离。再250 mA转膜2 h,用5%脱脂牛奶封闭90 min,TBST清洗3次,每次5 min。加入特异性Ⅰ抗,4℃摇床孵育过夜,TBST清洗4次,加入辣根过氧化物酶标记的Ⅱ抗,室温孵育2 h,TBST清洗4 次,每次10 min。以GAPDH 为内参照,ECL 曝光显影,结果采用Quantity One软件进行分析。
2.5 检测细胞培养上清液中IL-1β 和IL-18 浓度及LDH 活性 收集细胞培养上清,4℃、1 000×g 离心20 min,吸取上清液,于-80℃冰箱备用。按照ELISA试剂盒说明书进行操作,在酶标仪中读取波长450 nm 处的吸光度(A),制作标准曲线,并按照标准曲线计算样本中IL-1β 和IL-18 浓度。采用LDH 试剂盒检测各组细胞上清液中LDH 活性:LDH 活性(U/L)=(测定孔A 值-对照孔A 值)/(标准孔A 值-空白孔A值)×标准孔浓度(0.2 μmol/L)×1 000。
3 统计学处理
采用SPSS 25.0 软件进行统计学分析,采用GraphPad Prism 7.0 软件绘图。计量资料以均数±标准差(mean±SD)表示。两组间均数比较采用独立样本t 检验;多组间均数比较先采用单因素方差分析,然后采用Bonferroni 法进行两两比较。以P<0.05 为差异有统计学意义。
结 果
1 HPMVECs适宜OGD/R的条件筛选
MTT 结果显示,OGD 处理2、4 和8 h 再复氧12 h的HPMVECs 相对于control 组的细胞活力分别为(94.0±0.7)%、(79.1±4.6)%及(69.3%±3.5)%;与control组相比,OGD处理4 h细胞活力开始降低,8 h时已出现显著下降(P<0.05),见图1A。显微镜下观察到control 组细胞多呈现出纺锤体形,细胞连接紧密,排列成铺路石样;而OGD 处理8 h 后细胞明显变圆变肿胀,细胞排列疏松,漂浮细胞增多,形态学改变与细胞焦亡特点类似,见图1B。

Figure 1. Selection of the suitable OGD/R condition for HPMVECs. A:the effect of OGD/R on cell viability;B:morphological changes of the cells were observed under inverted microscope(×200). Mean±SD. n=3. *P<0.05 vs control group.图1 筛选HPMVECs适宜OGD/R的条件
2 OGD/R对HPMVECs中焦亡相关分子mRNA和蛋白表达的影响
RT-qPCR 结果显示,与control 组相比,OGD/R组焦亡相关分子caspase-1、NLRP3 和ASC 的mRNA表达上调(P<0.05);采用VX-765 处理后,OGD/R 引起焦亡相关分子表达上调的作用被抑制(P<0.05),其中VX-765 组caspase-1 的mRNA 表达水平还低于control组(P<0.05),见图2。
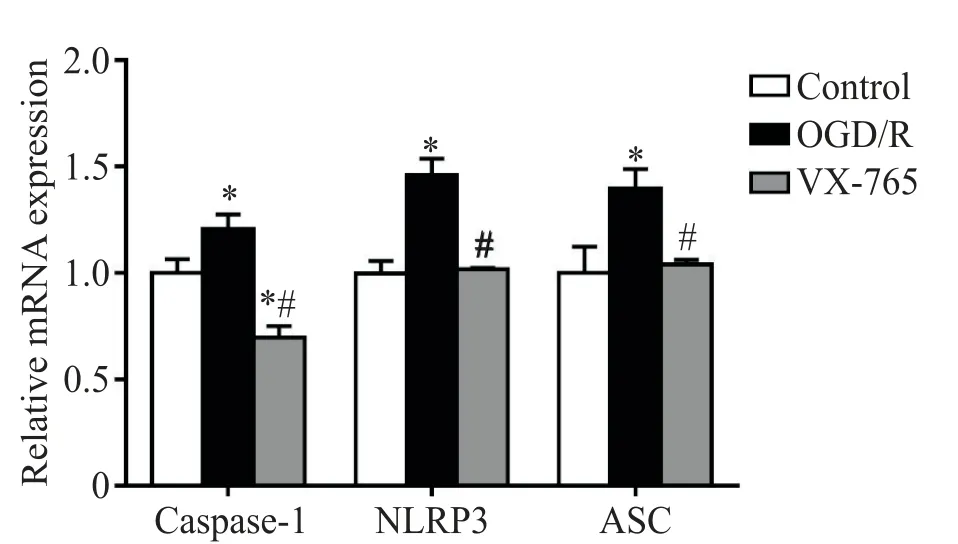
Figure 2. The effects of OGD/R on the mRNA expression levels of caspase-1,NLRP3 and ASC in HPMVECs. Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs OGD/R group.图2 OGD/R 对HPMVECs 中caspase-1、NLRP3 和ASC mRNA表达的影响
Western blot结果显示,与control组相比,OGD/R处理后焦亡相关蛋白caspase-1、NLRP3 和ASC 的表达上调(P<0.05);使用VX-765 处理后,OGD/R 引起的焦亡相关蛋白表达上调被抑制(P<0.05),并且VX-765 组caspase-1 的蛋白表达水平还低于control组(P<0.05),见图3。
3 OGD/R对上清液中IL-1β和IL-18水平的影响
ELISA 结果显示,经OGD/R 处理后细胞上清液中IL-1β 和IL-18 的含量均显著增加(P<0.05);经VX-765 处理后,VX-765 组细胞上清液中IL-1β 和IL-18 的含量较OGD/R 组降低(P<0.05),但与control组水平相近,见图4。
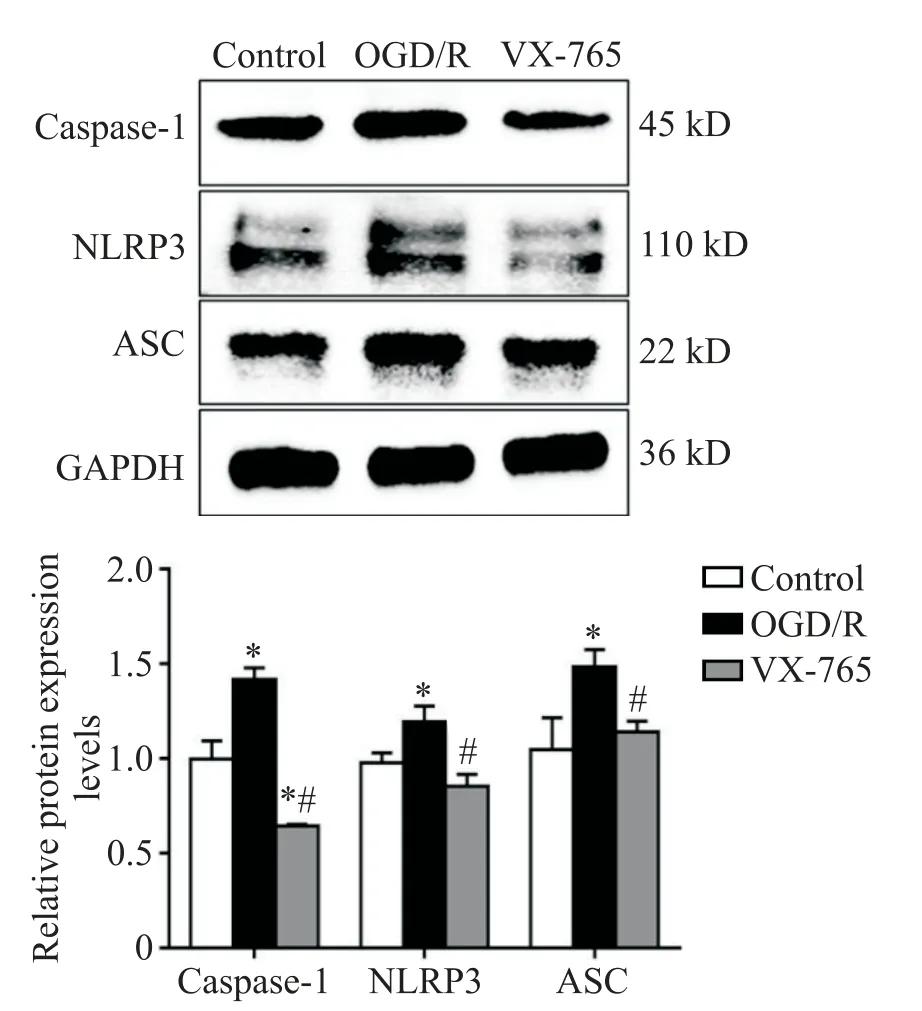
Figure 3. The effects of OGD/R on the protein expression levels of caspase-1,NLRP3 and ASC in HPMVECs. Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs OGD/R group.图3 OGD/R 对HPMVECs 中caspase-1、NLRP3 和ASC 蛋白表达的影响

Figure 4. The effects of OGD/R on the levels of IL-1β and IL-18 in the supernatant. Mean±SD. n=3. *P<0.05 vs con⁃trol group;#P<0.05 vs OGD/R group.图4 OGD/R对上清液中IL-1β和IL-18表达的影响
4 OGD/R对LDH水平的影响
LDH 检测结果显示,与control 组比较,OGD/R组LDH 水平升高(P<0.05);VX-765 处理后,LDH 水平恢复至control组水平(P<0.05),见图5。
讨 论
本研究发现,体外培养的HPMVECs 经OGD/R处理后,活力降低,胞体肿胀变圆,排列疏松,漂浮细胞增多,并伴有上清液中IL-1β 和IL-18浓度升高,提示OGD/R 可能诱导细胞发生焦亡;同时,OGD/R 后,HPMVECs 细胞 焦 亡相 关 分子caspase-1、NLRP3 和ASC的mRNA和蛋白表达明显上调,且可被焦亡抑制剂VX-765所抑制。本研究还发现,OGD/R后培养上清中细胞损伤标志物LDH 水平升高,而VX-765处理能抑制此种改变。这些结果提示本研究条件下,OGD/R可通过诱发细胞焦亡而导致HPMVECs损伤。

Figure 5. The effect of OGD/R on the LDH level. Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs OGD/R group.图5 OGD/R对LDH水平的影响
细胞焦亡是一种caspase 依赖性的细胞程序性死亡,主要通过连接蛋白ASC 的pyrin 和CARD 结构域招募NLRP3 等炎性蛋白和caspase-1 前体,形成炎症小体并引起下游caspase-1 活化,后者通过催化GSDMD 蛋白及IL-1β 和IL-18 前体裂解,分别引起胞膜完整性破坏,以及IL-1β 和IL-18的活化和释放,引发炎症反应[7-9]。本研究中,OGD/R处理后,细胞焦亡关键分子caspase-1、NLRP3 和ASC 的mRNA 和蛋白表达水平显著上调,细胞培养上清液中焦亡标志性蛋白IL-1β 和IL-18 水平升高,这表明OGD/R 后,细胞焦亡关键信号通路被激活。caspase-1 是焦亡最主要的信号分子之一,VX-765 是其选择性抑制剂,可抑制其表达和活性[10]。本研究中,预先采用VX-765处理后,上述焦亡信号通路关键分子的mRNA 和蛋白表达水平均出现下调,细胞培养上清中焦亡标志性蛋白IL-1β 和IL-18 水平基本恢复至对照组水平,表明VX-765可抑制OGD/R所致的细胞焦亡。
检测细胞培养上清中的LDH可反映细胞损伤程度及细胞膜完整性[11]。细胞焦亡的形态特征改变包括细胞肿胀、变形,细胞膜完整性破坏,胞浆内物质漏出[12]。本研究中OGD/R 后上清液中LDH 水平升高反映细胞膜完整性被破坏,结合上清中焦亡标志性蛋白IL-1β 和IL-18 水平升高,以及VX-765 可以逆转上述改变,可以进一步证明OGD/R 通过细胞焦亡途径引起细胞损伤的事实。本研究还发现,使用VX-765 后,细胞caspase-1 的mRNA 和蛋白表达水平低于对照组,这表明VX-765 可抑制caspase-1 的基础表达,其意义有待进一步探讨。
细胞焦亡的发生依赖于caspase-1介导的经典途径以及caspase-4、caspase-5和caspase-11介导的非经典途径[13]。本研究证实OGD/R 可激活HPMVECs 经典焦亡途径,本研究条件下是否同时激活caspase-4、caspase-5 和caspase-11 依赖的非经典途径尚有待进一步研究。
本研究利用OGD/R模拟临床上体外循环过程中肺微血管内皮细胞缺血再灌注过程。肺缺血再灌注是体外循环中最突出的病理刺激,HPMVECs结构和功能损坏是其最重要的病理生理特点,且发生于高炎症因子水平背景之下,这与细胞焦亡发生条件存在一致性[14]。因此,本研究结果可能提示体外循环过程中因肺缺血再灌注引发的急性肺损伤可能有肺微血管内皮细胞焦亡机制参与。但是本研究条件下体外培养细胞的OGD/R条件和环境与临床实际情况可能存在诸多不一致,临床条件下尚包括全身炎症反应综合征、低温与复温、肠道内毒素转位、手术创伤、酸碱平衡与电解质变化、凝血与纤溶系统改变等[15]。因此,细胞焦亡机制是否参与临床条件下体外循环相关性急性肺损伤仍需通过临床相关研究来进一步证实。
综上所述,OGD/R可导致体外培养的HPMVECs发生焦亡,抑制细胞焦亡经典途径可缓解OGD/R 对HPMVECs 的损伤,这提示临床上体外循环相关性急性肺损伤可能有肺微血管内皮细胞焦亡机制参与,但尚有待进一步研究来证实。

