奥沙利铂全身静脉化疗联合深部热疗治疗Ⅳ期消化道肿瘤的效果观察
张健
早期消化道肿瘤患者常无特异性症状,诊断时多为中晚期,因而失去了手术治疗的机会。其对化疗的敏感性较高,化疗是目前治疗晚期消化道肿瘤的主要方法。三代铂类药物联合应用是晚期消化道肿瘤的一线治疗方法[1]。在消化道肿瘤化疗中,奥沙利铂是常见的第三代抗肿瘤药物。伴随着医疗技术和热疗理论的迅速发展,对肿瘤热疗的研究不断深入,越来越多新的治疗方法应用于临床,取得了满意的疗效。热疗是目前消化道晚期肿瘤治疗的新方法,该方法可有效提高晚期消化道肿瘤的疗效。本研究选取本院2018 年1 月~2021 年1 月收治的Ⅳ期消化道肿瘤患者共110例,观察奥沙利铂全身静脉化疗联合深部热疗治疗该疾病的临床效果及安全性。具体报告如下。
1 资料与方法
1.1 一般资料 选取本院2018 年1 月~2021 年1 月收治的Ⅳ期消化道肿瘤患者共110例,随机分为对照组和观察组,各55例。对照组年龄61~78 岁,平均年龄(65.12±5.44)岁;体质量41~82 kg,平均体质量(62.13±11.34)kg;肿瘤类型:结直肠癌25例,其他30例;其中男30例,女25例。观察组年龄62~77 岁,平均年龄(65.82±4.67)岁;体质量42~81 kg,平均体质量(62.24±11.61)kg;肿瘤类型:结直肠癌27例,其他28例;其中男32例,女23例。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法 两组患者化疗前均给予5-羟色胺3(5-HT3)受体拮抗剂预防化疗过程中发生呕吐反应,为了保护肝脏和维持水电解质平衡,则常规给予保肝、补液等对症支持治疗。对于治疗前明确诊断Ⅲ度以上骨髓抑制的Ⅳ期消化道肿瘤患者皮下注射重组人粒细胞刺激因子。对照组单纯采用奥沙利铂全身静脉化疗治疗,取130 mg/m2奥沙利铂+500 ml 浓度5%葡萄糖注射液进行全身化疗。观察组给予奥沙利铂全身静脉化疗联合深部热疗治疗,化疗方法同对照组;深部热疗增敏疗法中奥沙利铂用药1/3 后进行热疗,患者保持仰卧位,全身热疗定位上界为患者剑突下2 横指,下界为耻骨联合上2 cm 的部位,两侧均在双侧腋前线,机头至皮肤之间保持25~30 cm 距离,实行远距离、大深度加热,保持输出功率为0~900 W,透热深度>8 cm,治疗过程采取精确测温方式,促使肿瘤内温度>42.5℃,并关注患者反应,确保治疗安全性。两组3 周治疗1 次,并作为1 个周期,均治疗2 个周期。
1.3 观察指标及判定标准 ①比较两组患者治疗前后外周血 T 淋巴细胞(CD3+、CD4+)免疫功能及血管内皮生长因子、血清细胞粘附分子、基质金属蛋白酶-9、基质金属蛋白酶-2。②治疗效果,根据世界卫生组织制定的判定标准,完全缓解:治疗后肿瘤完全消失;部分缓解:治疗后肿瘤体积缩小>50%;稳定:肿瘤体积缩小≤50%或增大≤25%;进展:肿瘤体积增大>25%,或者出现一个或多个新病灶;总有效率=完全缓解率+部分缓解率+稳定率[2]。③比较两组患者不良反应发生率。
1.4 统计学方法 采用SPSS22.0 统计学软件进行数据统计分析。计量资料以均数±标准差() 表示,采用t检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组外周血T 淋巴细胞免疫功能及血管内皮生长因子、血清细胞粘附分子、基质金属蛋白酶-9、基质金属蛋白酶-2 比较 治疗前,两组CD3+、CD4+、血管内皮生长因子、血清细胞粘附分子、基质金属蛋白酶-9、基质金属蛋白酶-2 比较差异无统计学意义(P>0.05);治疗后,观察组CD3+、CD4+、血管内皮生长因子、血清细胞粘附分子、基质金属蛋白酶-9、基质金属蛋白酶-2 均优于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组外周血T 淋巴细胞免疫功能及血管内皮生长因子、血清细胞粘附分子、基质金属蛋白酶-9、基质金属蛋白酶-2 比较()
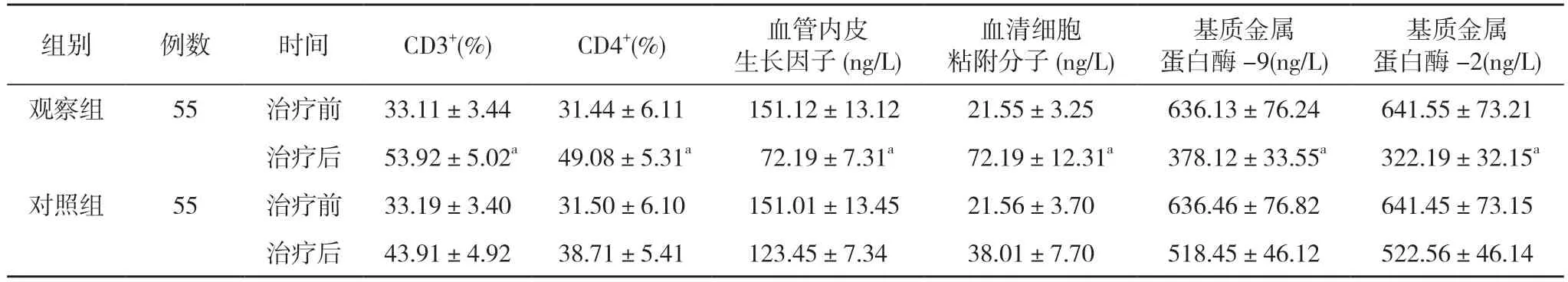
表1 两组外周血T 淋巴细胞免疫功能及血管内皮生长因子、血清细胞粘附分子、基质金属蛋白酶-9、基质金属蛋白酶-2 比较()
注:与对照组比较,aP<0.05
2.2 两组治疗效果比较 观察组完全缓解3例,部分缓解15例,稳定8例,进展29例,总缓解率为47.27%;对照组完全缓解2例,部分缓解8例,稳定5例,进展40例,总缓解率为27.27%;观察组总缓解率高于对照组,差异有统计学意义(P<0.05)。见表2。

表2 两组治疗效果比较(n,%)
2.3 两组不良反应发生率比较 观察组不良反应发生率为27.27%(15/55),低于对照组的54.55%(30/55),差异有统计学意义(P<0.05)。
3 讨论
随着饮食结构的改变,消化道肿瘤的侵袭性和恶化程度日益加重,临床治疗变得越来越困难。为了改善消化道肿瘤患者的症状,延长患者的生存时间,对其进行有效的治疗是十分必要的。随着病情逐渐恶化,大部分患者确诊时已属晚期或局部转移,受环境等因素的影响,晚期消化道肿瘤患者病情加重,侵袭性更强,免疫功能下降,生存率降低,所以要积极治疗,提高患者的免疫力[3,4]。
对于晚期消化道肿瘤患者,治疗原则是阻止高水平的生长因子和新血管的形成,减少恶性腹水的形成。临床上常采用化疗方案治疗。化疗药物主要为铂类,属广谱抗肿瘤药物,可有效穿透肿瘤细胞,摧毁深层癌细胞,疗效更精确。其中,奥沙利铂结合的DNA 复制产物可通过错配修复功能消除,从而诱发细胞凋亡。研究发现,错配修复功能缺陷能够绕过与奥沙利铂结合的 DNA 片段继续复制,从而产生顺铂(CDDP)抵抗,奥沙利铂可替代顺铂氨基,加强对DNA 复制和转录的阻滞作用,经临床观察奥沙利铂的抗肿瘤活性优于顺铂,且无交叉耐药[5,6]。但是,传统单一化疗耐受性低,不良反应发生率高,疗效不明显。很多临床研究表明,热疗能将肿瘤组织的温度提高到40~44℃,从而阻止肿瘤细胞生长或死亡。由于肿瘤组织在体内生长时会出现血管畸形、毛细血管及结构受压、血窦现象,患者的血供和血流也会明显减少,为热疗创造了有利条件,血液循环在正常组织的加热过程中完全散失,而肿瘤组织因散热性差,使局部温度比正常组织高5%~10%,在微波高能量聚焦过程中肿瘤细胞的温度可达到45℃。同时,正常组织仍然处于低温状态[7,8]。另外,在高温条件下肿瘤细胞膜流动性明显增强,导致膜结构、功能及超微结构发生破坏。此外,热疗还能加速药物进入肿瘤细胞的速度,从而加速药物诱导肿瘤细胞凋亡,特别是在热疗中,当肿瘤组织中心温度升高,在酸性环境下更易引起凋亡[9,10]。热疗联合化疗可覆盖所有的肿瘤病变,而热疗与化疗对晚期消化道肿瘤的治疗具有协同作用。对于Ⅳ期消化道肿瘤患者,局部热疗是一种综合疗法,其能直接杀死体内局部肿瘤细胞。热疗与化疗相互作用,提高了肿瘤细胞的杀伤力。静态肿瘤细胞对化疗不敏感,而热疗对其是致命的。高温治疗可改变细胞膜的稳定状态,增加药物的通透性和吸收能力,能有效抑制 DNA 损伤的修复[11,12]。
本研究结果显示,治疗后,观察组CD3+、CD4+、血管内皮生长因子、血清细胞粘附分子、基质金属蛋白酶-9、基质金属蛋白酶-2 均优于对照组,差异有统计学意义(P<0.05)。观察组总缓解率高于对照组,差异有统计学意义(P<0.05)。观察组不良反应发生率低于对照组,差异有统计学意义(P<0.05)。
综上所述,奥沙利铂全身静脉化疗联合深部热疗治疗Ⅳ期消化道肿瘤的临床疗效确切,可有效改善血清学指标,且未增加不良反应,值得推广。

