超重或肥胖患者胃食管反流病对睡眠呼吸暂停综合征的影响研究
卡哈尔·吐尔逊 再努尔·语苏普 买买提吐尔逊·吐尔迪 唐荣华 阿地力江·阿力甫 吴源泉 艾克拜尔·艾力 克力木·阿不都热依木
胃食管反流病(Gastroesophageal reflux disease,GERD)是指胃十二指肠内容物反流入食管所致的反酸、烧心等症状,以及进一步反流到咽喉部甚至肺等食管临近器官导致的食管外疾病,如哮喘、慢性咳嗽、特发性肺纤维化、声音嘶哑、咽喉炎和牙蚀症等[1]。相关研究显示,在西方国家大约10~20%人患有GERD[2]。一项最新meta分析结果显示,在我国GERD发病率为12.2~12.7%,在农村和城市中的患病率分别为7.8%、7.7%,男性中约12.9%人患有GERD,而女性约8.1%的人被确诊为GERD,军人当中GERD的发病率较高,大概为30.7%[3]。
有研究报道GERD与阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea syndrome,OSAS)密切相关[4],尤其是超重或肥胖人群中GERD、OSAS和肥胖之间的相关性研究变成热门话题。如:Kim[5]等报道中心性肥胖是GERD的独立危险因素。除此之外,诸多研究报道GERD与OSAS是相互危险因素,并且有些学者根据其病理生理学特点假设它们之间可能存在恶性循环的关系[6-8],但尚无比较权威的数据来证实。
众所周知,肥胖人群中OSAS和GERD的发病率明显高于体重正常人群,将肥胖可作为此两种疾病共同危险因素。因此研究GERD对OSAS的影响时必须考虑肥胖对研究结果的影响。虽然OSAS对GERD的影响有一些研究,反而GERD对OSAS的影响方面研究较少,关于将肥胖人群作为研究对象研究GERD对OSAS及其食管功能和肺功能影响的研究尤为少见。本研究将超重或肥胖人群作为研究对象,探究肥胖GERD对OSAS的影响及OSAS及其间所在的潜在的机制。
资料和方法
一、对象
选取2018年9月至2020年6月在新疆维吾尔自治区人民医院微创疝和腹壁外科就诊住院的根据肺功能排除肺通气功能障碍的125例患者,按照24 h食管测酸结果将其中69例患者纳入到GERD组作为病例组、其他56例患者列入到非GERD组作为对照组。
二、方法
食管24 h pH值测定:用24 h多通道腔内气阻仪联和pH值监测系统的一个电极置在食管下括约肌(lower esophageal sphincter,LES)以上3 cm处、其余三个电极留置在依次往上2 cm,另两个电极留置食管上括约肌(upper esophageal sphincter,UES)处,酸碱度感受器安置于LES相应监测部位。导管记录仪连接好并检查监测成功能后佩戴病人24 h,交代患者白天不要平躺、正常饮食、避免饮酸奶和各种饮料,使用ManoView软件分析数据。食管酸碱度分为酸性、弱酸性、非酸性,食管pH值降幅≥1且降至4以下定为酸反流,食管pH值降幅≥1,但食管pH值仍在4.0~7.0之间被定为弱酸反流;反流事件不能将食管pH值降到7以下被确定为非酸反流。根据反流物达到食管近段或远段的高低不同,将达到UES下方5 cm处的酸反流被定为食道近端反流。根据美国胃肠学会胃食管反流诊断指南和Johnson的标准,Demeester评分以≥14.7作为GERD的诊断标准[9]。
食管动力监测:使用36通道ManoScan360“固态高分辨率胃肠动力学检查系统(Sierra ScientificInstruments公司,美国),专业监测人员按照标准操作规范进行食管动力监测,并通过ManoView全自动胃肠动力分析软件进行数据采集及分析,描绘食管动力学压力分布。通常膈肌和LES大致在同一水平线上,根据食管测压系统确定食管裂孔疝标准为膈肌和LES分离距离≥2 cm。通过食管动力学监测系统和分析软件分别测出静息框内的胃内压、食管内压、吸气和呼气状态时间的食管内压。通过公式“胃内压-食管内压=胃食管压力差,吸气状态食管内压-呼气状态食管内压=吸呼气压力差绝对值”计算出胃食管压力差和吸呼气状态食管内压绝对值。
睡眠研究:所有研究对象使用康迪E系列睡眠监测系统在标准睡眠监测室进行夜间睡眠呼吸监测。根据美国斯坦福大学提出并已被世界公认的诊断标准,在夜间7 h睡眠中,反复发作以阻塞性为主的睡眠呼吸暂停和低通气>30次或睡眠中睡眠呼吸暂停和低通气次数>5次/h可以确诊为阻塞性睡眠呼吸暂停综合征,严重程度使用呼吸暂停低通气指数(apnea hypopnea index,AHI)表示[10]。
常规肺功能、脉冲震荡、肺容积检查:采用MasterScreen PFT呼吸气流-流速描计仪器(Jaeger®;CareFusion,德国),MasterScreen Body人体体积描记系统和MasterScreenms(Jaeger;CareFusion,德国)系统,由专科肺功能监测医师按照标准操作要求分别进行常规肺功能、肺容积和不同频率的脉冲震荡下的呼吸力学特点进行测定,为避免偏倚,肺功能监测医师不知道患者分组情况。本次研究我们所纳入参考的脉冲震荡(impulse oscillation system,IOS)参数包括坐位和仰卧位状态的Zrs5、Rcentral和Rperipheral呼吸系统阻抗(respiratory system impedance,zrs)。Zrs5 Hz、Rcentral和Rpefipheral气道阻力分别代表气道总弹性阻力、肺中心气道弹性阻力和肺周围气道弹性阻力。R5-R35和X5-X35代表5~35Hz脉冲震荡阻力下气道弹性阻力及电阻抗。
三、统计学方法
所有统计数据均采用SPSS 25软件进行分析。符合正态分布的数据均采用均数±(±s)标准差,非正态分布数据采用中位数(极差)表示。分类变量资料采用卡方检验进行分析。用独立样本t检验对符合正态分布且具有方差齐性的资料进行组间比较,P<0.05表示差异有统计学意义。
结 果
本研究所纳入的患者性别、民族、年龄、身高、体质量、体质量指数、肺通气一秒率(FEV1/VCMAX)和潮气量(IC-B)2组分布差异无统计学意义(P>0.05,见表1)。
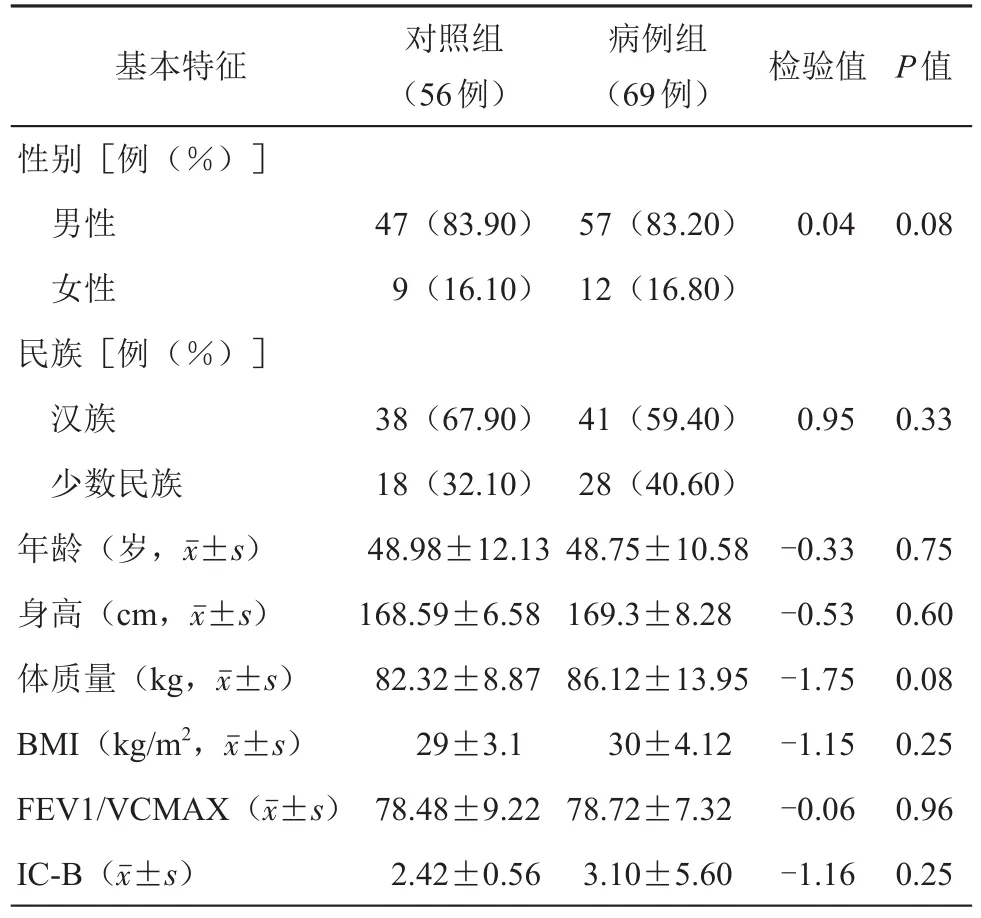
表1 两组患者一般资料分布比较
根据夜间睡眠监测结果将69例病例组中5例(7%)确诊为非OSAS,64例(93%)确诊为OSAS患者。56例对照组中39例(70%)确诊为非OSAS,17例(30%)确诊为OSAS患者。OSAS患者共计81例,非OSAS患者共计44例。病例组OSAS的发生率明显高于对照组,差异有统计学意义(χ2=52.8,P<0.001)。
2组肺通气无明显差异情况下比较2组患者坐位状态下的肺气道弹性阻力及电阻抗比较结果如下:病例组气道总弹性阻力(Zrs5)、中心气道弹性阻力(Rcentral)、周围气道弹性阻力(Rpefipheral)、5~35 Hz脉冲震荡阻力下气道弹性阻力明显高于对照组,2组差异有统计学差异(P<0.05)。5~35 Hz脉冲震荡阻力下病例组呼吸道电抗Xrs略低于对照组,但2组差异无统计学意义(P>0.05,见表2)。
表2 2组患者坐位状态下呼吸力学指标的比较(±s)
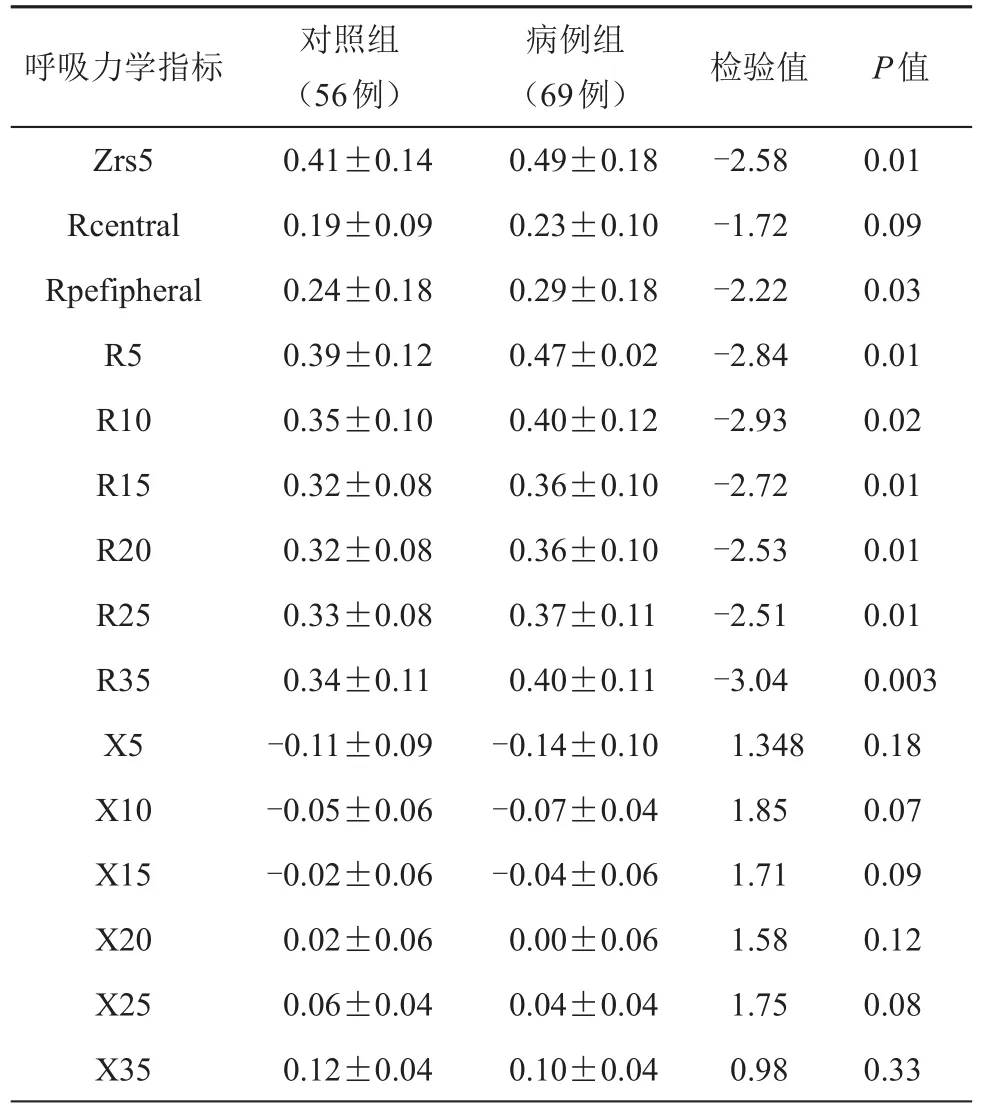
表2 2组患者坐位状态下呼吸力学指标的比较(±s)
呼吸力学指标 检验值P值Zrs5 Rcentral Rpefipheral R5 R10 R15 R20 R25 R35 X5 X10 X15 X20 X25 X35对照组(56例)0.41±0.14 0.19±0.09 0.24±0.18 0.39±0.12 0.35±0.10 0.32±0.08 0.32±0.08 0.33±0.08 0.34±0.11-0.11±0.09-0.05±0.06-0.02±0.06 0.02±0.06 0.06±0.04 0.12±0.04病例组(69例)0.49±0.18 0.23±0.10 0.29±0.18 0.47±0.02 0.40±0.12 0.36±0.10 0.36±0.10 0.37±0.11 0.40±0.11-0.14±0.10-0.07±0.04-0.04±0.06 0.00±0.06 0.04±0.04 0.10±0.04-2.58-1.72-2.22-2.84-2.93-2.72-2.53-2.51-3.04 1.348 1.85 1.71 1.58 1.75 0.98 0.01 0.09 0.03 0.01 0.02 0.01 0.01 0.01 0.003 0.18 0.07 0.09 0.12 0.08 0.33
同样条件下比较2组患者仰卧位状态肺气道弹性阻力及电阻抗比较结果显示:病例组气道总弹性阻力、中心气道和周围气道弹性阻力及脉冲震荡阻力在5~35 Hz下气道弹性阻力明显高于对照组,两组差异有统计学差异(P<0.001);病例组呼吸道电抗明显低于对照组,两组差异有统计学差异(P<0.001,见表3)
表3 2组患者仰卧位状态肺气道阻力的比较(±s)
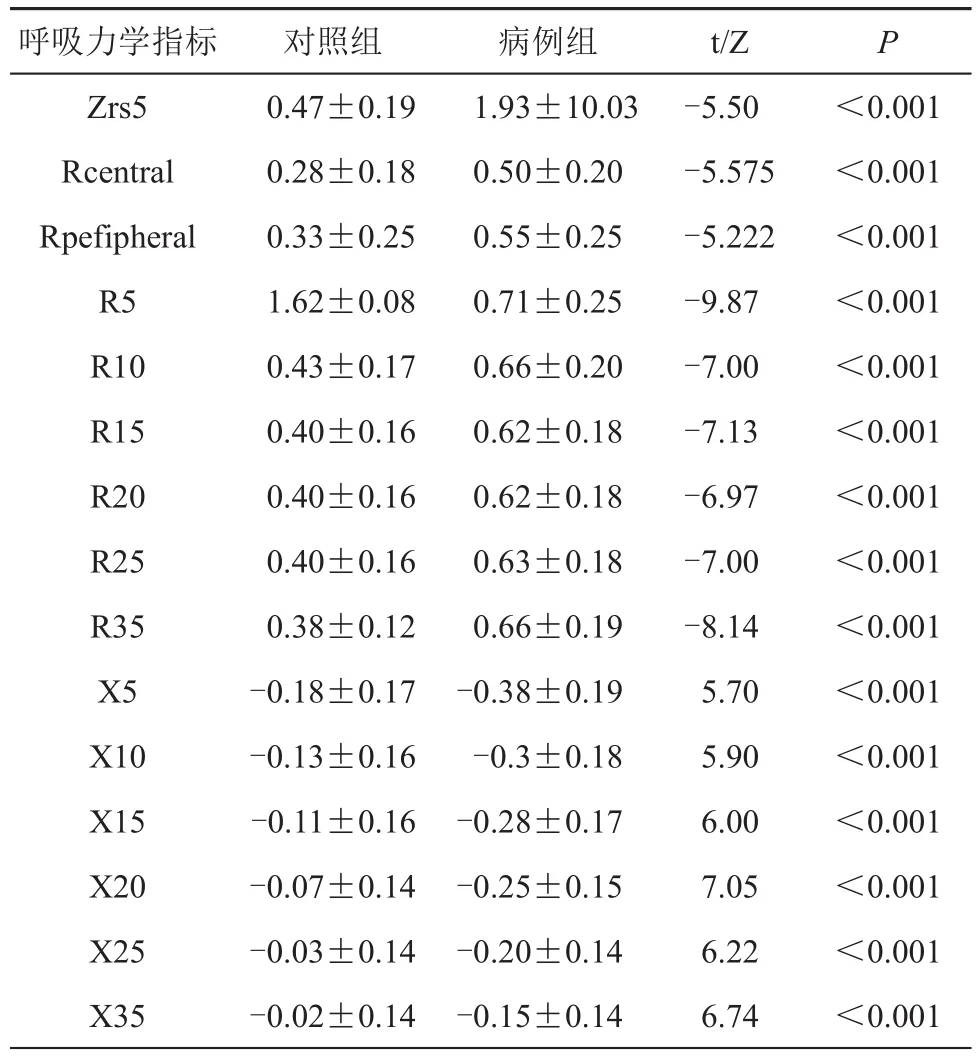
表3 2组患者仰卧位状态肺气道阻力的比较(±s)
呼吸力学指标Zrs5 Rcentral Rpefipheral R5 R10 R15 R20 R25 R35 X5 X10 X15 X20 X25 X35对照组0.47±0.19 0.28±0.18 0.33±0.25 1.62±0.08 0.43±0.17 0.40±0.16 0.40±0.16 0.40±0.16 0.38±0.12-0.18±0.17-0.13±0.16-0.11±0.16-0.07±0.14-0.03±0.14-0.02±0.14病例组1.93±10.03 0.50±0.20 0.55±0.25 0.71±0.25 0.66±0.20 0.62±0.18 0.62±0.18 0.63±0.18 0.66±0.19-0.38±0.19-0.3±0.18-0.28±0.17-0.25±0.15-0.20±0.14-0.15±0.14 t/Z-5.50-5.575-5.222-9.87-7.00-7.13-6.97-7.00-8.14 5.70 5.90 6.00 7.05 6.22 6.74 P<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001
食管功能学检查结果提示病例组胃食管压力差、LES静息压、UES静息压、远端收缩积分明显小于对照组,病例组食管裂孔大小对照组,2组差异有统计学意义P<0.05。病例组LES长度小于对照组,差异无统计学意义(P>0.05,见表4)。
表4 2组患者食管动力学指标的比较(±s)
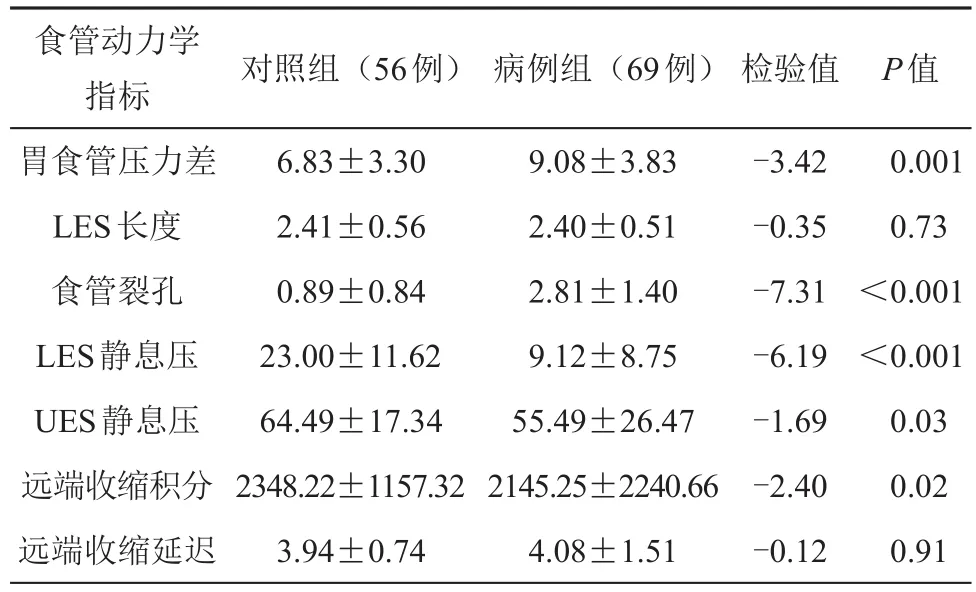
表4 2组患者食管动力学指标的比较(±s)
注:LES为是食管下括约肌;UES为食管上括约肌
食管动力学指标胃食管压力差LES长度食管裂孔LES静息压UES静息压远端收缩积分远端收缩延迟对照组(56例) 病例组(69例)检验值P值0.001 0.73<0.001<0.001 0.03 0.02 0.91 6.83±3.30 2.41±0.56 0.89±0.84 23.00±11.62 64.49±17.34 2348.22±1157.32 3.94±0.74 9.08±3.83 2.40±0.51 2.81±1.40 9.12±8.75 55.49±26.47 2145.25±2240.66 4.08±1.51-3.42-0.35-7.31-6.19-1.69-2.40-0.12
确定超重或肥胖OSAS患者中食管酸反流程度与食管算反流直接相关的食管功能学指标与OSAS严重程度是否相关行相关性分析结果显示,Demeester评分、食管近端反流百分比、食管裂孔大小、胃食管压力差与AHI相关性有统计呈正相关(r>0,P<0.05)。远端收缩延迟、吸呼气压力差与AHI相关性有统计学意义((r<0,P<0.05))。LES静息压、UES静息压与AHI呈负相关(r<0),但差异无统计学意义(P>0.05,见表5)。
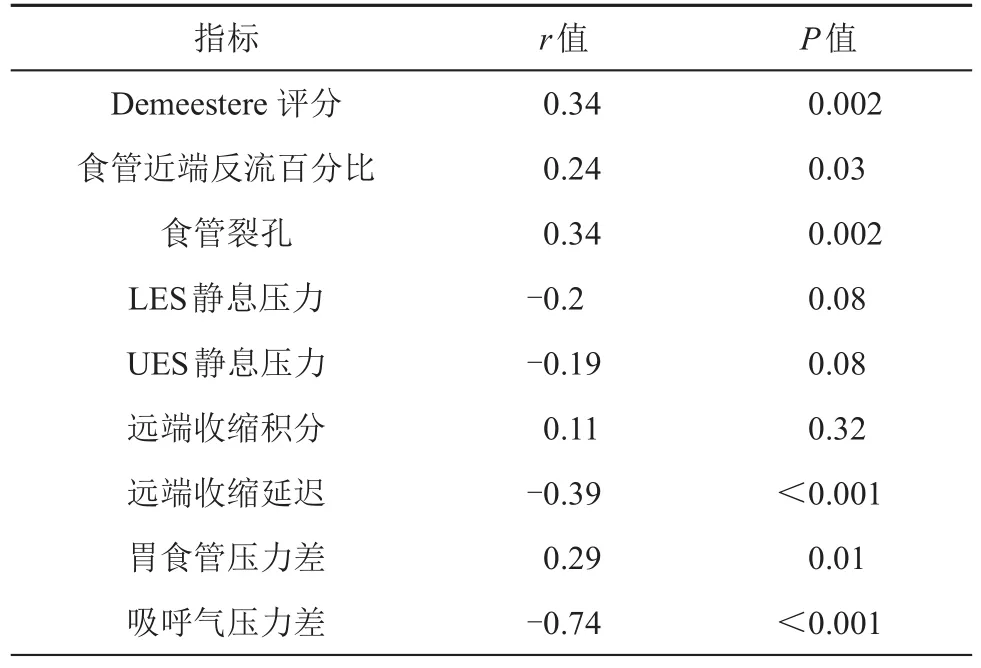
表5 两组患者胃食管反流相关指标与AHI相关分析
讨 论
本研究以超重或肥胖患者作为研究对象,各种混杂因素在病例组和对照组分布无明显差异的情况下探究GERD对OSAS的发生、气道弹性阻力、食管功能的影响和食管酸反流及食管功能障碍与OSAS严重程度相互关系。本研究结果提示肥胖合并GERD患者OSAS的发病率明显高于单纯患者,且影响肺弹性阻力,食管功能也有一定的障碍。韩国学者You等[11]报道合并GERD尤其是非糜烂性胃食管反流病患者发生OSAS的概率明显高于健康体检者,结果与本研究结果有所相似。有学者报道合并GERD的OSAS患者AHI明显高于单纯OSAS组[12,13]。陈美玲等报道[14]类似的研究结果,并建议治疗GERD是需要重视是否合并OSAS并及其治疗。除此之外,艾克拜尔[15]等学者报道食管裂孔疝所致的GERD患者进行手术治疗后随着GERD症状的缓解OSAS症状明显缓解。结合以上研究报道及本研究结果说明GERD可能为OSAS的主要危险因素之一。
近年来,脉冲振荡检测系统因具有无创、耗时短及操作简便等优势目前广泛应用于测定呼吸系统(胸内,外气道)的阻力来评价OSAS患者呼吸系统力学特征的重要工具。本研究结果显示病例组气道总弹性阻力、中心、周围及气道弹性阻力及5~35 HZ脉冲震荡阻力下下气道弹性阻力高于对照组,5~35 Hz脉冲震荡下气道电阻抗低于对照组,而且,仰卧位状态下以上观察指标2组差距更大。Arikiny等[16]学者报道肥胖OSAS患者的气道总弹性阻力和外周气道阻力的显著升高,与OSAS的严重程度正相关,但此研究未报道是否合并GERD。阿孜古丽[17]、张玉沛18]等学者报道OSAS患者呼吸总阻抗(Zrs5)和5~35 Hz脉冲震荡阻力下的呼吸道弹性阻力显著高于非OSAS组,而呼吸电抗显著降低,与本研究结果有所相似之处。GERD对OSAS患者气道弹性阻力的影响的原因可能是胃内酸性物质反流至咽喉部导致黏膜水肿致咽喉部狭窄诱发或加重OSAS,部分患者酸性反流物长期的慢性刺激气道致肺外或肺内气道黏膜病变,增厚、气道顺应性降低导致气道弹性阻力的增高。
众周所知,GERD的发生发展中食管功能的障碍是不可忽略的因素之一。本研究中病例组食管裂孔大小明显大于对照组,远端收缩积分、食管上、下括约肌静息压明显低于对照组。除此之外,通过食管动力检测系统计算2组胃食管压力差也有显著差异,以上食管功能学指标在食管酸反流事件发生中起着非常重要作用。国内有学者报道合并GERD的情况下远端收缩积分、LES静息压明显低于对照组,食管裂孔疝发病率高于对照组[19]。Harika Gorti[20]等学者胃食管反流病患者LES静息压、食管蠕动功能明显低于健康组,类似于本研究结果。
本研究结果显示GERD患者食管酸反流程度及反映食管功能障碍的重要指标与OSAS严重程度有明显相关性。近期发表的一篇meta分析结果也确认了GERD及OSAS的相关性[4]。Kim Y等[21]学者报道经过胃镜证实为反流性食管炎的严重程度与OSAS严重程度的相关性。本研究结果结合文献报道可以认为GERD与OSAS的严重程度正相关。主要机制分析如下:(1)一般卧位状态下反流事件发生较多,刺激咽喉部导致炎性增生进一步狭窄咽喉部加重诱发或加重OSAS,因为肥胖患者咽喉部脂肪堆积较多,横经较小,此现象尤为多见;(2)食管酸性反流物长期缓慢微量吸入到气管导致气管壁层厚、狭窄、弹性下降而加重OSAS;(3)本研究结果所提示超重或肥胖GERD组OSAS发生率较高及弹性阻力高于非GERD组,OSAS患者为克服增高的气道弹性阻力,呼吸运动力度有所加深,而增高胸腔负压,影响食管内压、增高胃食管压力差导致胃内容物吸入到食管内从而加重OSAS而形成恶性循环。
本研究有一定的缺点,如:吸烟等混杂因素没能纳入基线资料中,分析GERD对OSAS的影响时将咽喉部横经或经过喉镜确认的咽喉部水肿或淋巴结肿大等因素没纳入,睡眠分析时呼吸暂停指数、低通气指数、缺氧程度等指标没进行比较。
综上,超重或肥胖患者中GERD是加重或诱发OSAS的重要危险因素之一,GERD患者食管酸反流及食管功能障碍与OSAS的严重程度密切相关。食管酸性反流物长期刺激咽喉部及气道粘膜而导致的一系列病理生理变化可能其潜在的机制之一。

