柑橘抗逆基因WRKY75的克隆与表达分析
卢 婷,杨 莉,胡 威,匡柳青,郭文芳,沈 丹,刘德春,刘 勇
(江西农业大学 农学院,江西 南昌 330045)
【研究意义】植物作为一类固着生长而生存的生物,生物胁迫和非生物胁迫使其在复杂多变的自然环境中面临诸多挑战[1]。在应对环境胁迫时,植物通过信号转导及应答来维持生命活动的稳定[2-3]。由于对环境的适应,植物本身形成了对外界逆境的抵御机制,通过转录调控等途径使植株抗性增强。胁迫应答的转录因子在这一过程中发挥着重要作用[4]。【前人研究进展】WRKY 转录因子是高等植物特有的一类WRKY-GCM1 锌指转录因子超家族[5]。WRKY基因存在于多种植物中,如拟南芥(Arabidopsis thaliana)(74 个WRKY基因)和水稻(Oryza sativa)(大约100 个)[6-7]、苹果(Malus domestica)(127 个)[8]、番茄(Solanum lycopersicum)(81 个)[9]等。SPF1基因是第1 个分离的WRKY 转录因子,来自于甘薯[10]。WRKY 家族基因是植物特有的一类转录因子,其蛋白序列均包含至少1 个保守的WRKY 结构域,约含60 个氨基酸残基,其中N 端含有高度保守的氨基酸序列(WRKYGQK),C 端则包含1 个锌指结构(CX4-7CX22–23HXH/C)[11]。【本研究切入点】大量研究表明,WRKY 家族基因在转录调控和植物抗逆方面起着重要作用。拟南芥AtWRKY11和AtWRKY17在不同发育阶段下会受到ABA、高盐和渗透胁迫的诱导上调表达。另外,在胁迫下,这2 个基因的突变体表现出较慢的萌发和受损的根生长,双突变体幼苗比单突变体受影响更大。表明WRKY11和WRKY17并不严格限于植物防御反应,也在拟南芥响应非生物胁迫耐受性中起着一定作用[12]。棉花GhWRKY42被证明是在MeJA,脱落酸,干旱和高盐处理下差异诱导表达的。在GhWRKY42的启动子区域还有许多应激反应顺式作用元件,表明GhWRKY42可能参与了调节非生物胁迫反应,而且GhWRKY42还与叶片早衰和茎的发育有关,为进一步研究棉花GhWRKY42的功能奠订了坚实的基础[13]。小麦TaWRKY93可以通过增强渗透调节、维持膜稳定性和增加胁迫相关基因的表达来提高植物对高盐、干旱和低温胁迫的耐受性,并促进植物根系发育,可作为小麦抗逆基因工程育种的候选基因[14]。拟南芥AtWRKY75具有调控植物侧根和须根发育,增强植物抵御磷胁迫的功能[15]。进一步研究表明,WRKY75也可以调节叶片衰老[16],影响植物开花[17],增强植物抵御病菌的能力[18]。此外,干旱、高盐、高温和脱落酸(ABA)等非生物胁迫也能诱导玉米ZmWRKY40表达,并且在ZmWRKY40的启动子区域存在几个胁迫相关的转录调控元件。ZmWRKY40的过表达通过调节胁迫相关的元件提高了转基因拟南芥的耐旱性,ZmWRKY40为了解玉米对非生物胁迫的响应机制提供了一个参与干旱胁迫响应的候选基因和理论基础[19]。基于前人研究的基础上,本文选取4 个常见柑橘类物种对WRKY75基因进行逆境处理等非生物胁迫的柑橘抗逆研究。【拟解决的关键问题】柑橘是世界上主要的栽培果树,也是我国南方最重要的果树之一,具有重要的经济价值。柑橘喜热、怕霜冻、不耐低温和干旱。因此,提高柑橘抗逆性是柑橘育种中的重要工作。分子育种是提高柑橘育种效率、缩短育种周期的重要技术。目前在柑橘中已有NAC83、MYB15和COR15a[20]、PtrZPT2-1[21]、CsBZIP40[22]、FcWRKY40[23]、CrNCED1[24]、CsbHLH18[25]、CsATG18a和CsATG18b[26]等多个抗逆基因的相关研究。但是,有关柑橘WRKY75基因的研究未见报道。本研究从柠檬、甜橙、金柑和芦柑中克隆得到了4个新的WRKY 家族基因,分别命名为ClWRKY75、CsWRKY75、FmWRKY75和CrWRKY75,并进行了详细的生物信息学分析。同时,通过实时荧光定量PCR 技术对其在低温、干旱和高盐等非生物胁迫下的表达模式进行了分析,为今后使用转基因技术提高柑橘抗逆性奠定了基础。
1 材料与方法
1.1 材料及处理
将柠檬[Citrus limon(L.)Burm.f.]、甜橙[Citrus sinensis(L.)Osbeck.]、金柑[Fortunella margarita(Lour.)Swingle.]、芦柑[Citrus reticulataBlanco.]种子分别播种于含有7 g/L 琼脂,30 g/L 蔗糖,pH 6.0 的MS 培养基中,置于江西农业大学农学院园艺系实验室培养箱(25±1)℃,16 h 光照/8 h 黑暗,光照强度12 000 lx)中培养。待幼苗长到约25 cm 时,揭膜培养1~2 d,再移植到Hoagland 培养液中预培养2 d,然后分别将幼苗移到4 ℃培养箱中进行低温培养,干旱和高盐处理移到含有20% PEG6000 和含有250 mmol/L NaCl 的Hoagland 液体培养基中常温培养。柠檬、甜橙、金柑和芦柑的每种胁迫处理15~20 株植株,均以室温(25 ℃)下不加处理的Hoagland 液体培养植株作对照,分别在处理后0,1,3,6,12,24 h 取其叶片,液氮速冻,置于-80 ℃超低温冰箱储存、备用。
1.2 柑橘总RNA提取及cDNA合成
采用TaKaRa MiniBEST Plant RNA Extraction Kit 总RNA 提取试剂盒(TaKaRa,日本)分别提取柠檬、甜橙、金柑和芦柑的叶片总RNA。用超微量分光光度计检测总RNA 的浓度,1%琼脂糖凝胶电泳检测其完整性。以各个样品的总RNA 为模板,采用Prime ScriptTMRT reagent Kit with gDNA Eraster(Perfect Real Time)试剂盒(TaKaRa,日本)反转录合成cDNA 第一链,将其存放于冰箱-20 ℃,以备后续试验基因克隆和实时定量PCR的模板备用。
1.3 基因克隆
从华中农业大学甜橙基因组数据库(http://citrus.hzau.edu.cn/orange/)中搜索获得包含完整开放阅读框(ORF)的甜橙CsWRKY75基因的cDNA 序列,利用软件Primer Premier 5 设计合成1 对基因特异性引物QS:5'AATAGTCGAATCTGCCCACC 3';QA:5'CTGCTGCTTGCTAGTTGAGG 3',同时分别使用柠檬、甜橙、金柑和芦柑叶片第一链cDNA 为模板与PCR 扩增试剂盒TaKaRa®PrimeSTAR Max Premix(2×)进行PCR扩增,获得ClWRKY75、CsWRKY75、FmWRKY75和CrWRKY75基因全长cDNA 序列。PCR 扩增程序如下:95 ℃预变性5 min;98 ℃变性10 s,54 ℃退火30 s,72 ℃延伸10 s,29 个循环;72 ℃再延伸5 min;12 ℃保存。分别将PCR 产物进行1.0%琼脂糖凝胶电泳分离,利用DNA 回收试剂盒TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0(TaKaRa,日本)将PCR目的片段回收、纯化,用pClone007 Simple Vector Kit(北京擎科新业生物技术有限公司,中国)试剂盒进行载体连接,转化大肠杆菌感受态细胞DH5α(TIAN‑GEN,中国),进行蓝白斑筛选挑取单菌落。经菌液PCR 鉴定为阳性克隆后取1 mL 菌液送生工生物工程(上海)股份有限公司测序。
1.4 生物信息学分析
根据克隆获得的4 个柑橘WRKY75基因序列,利用ORF Finder 网站(https://www.ncbi.nlm.nih.gov/orf‑finder/)寻找开放阅读框(ORF),并翻译出氨基酸序列。利用NCBI 网站(https://www.ncbi.nlm.nih.gov/)Blast 程序进行氨基酸序列比对查找同源蛋白;利用DNAMAN 软件进行多序列比对;利用MEGA5.0 构建系统发育树;用在线软件ExPASy(https://web.expasy.org/protparam/)对氨基酸序列的分子量、等电点(pI)、不稳定指数和亲水性进行预测;利用在线网站CELLO(http://cello.life.nctu.edu.tw/)和NLS(http://nls-map‑per.iab.keio.ac.jp/cgi-bin/NLS_Mapper_form.cgi)完成亚细胞定位和核定位信号预测,以及通过SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)和SWISS-MODEL(https://swissmodel.expasy.org/interactive)完成蛋白的二级、三级结构预测。
1.5 实时荧光定量PCR
利用BIO-RAD CFX96 实时荧光定量PCR 仪(BIO-RAD,美国)对柑橘进行实时荧光定量PCR 分析。荧光染料为TB GreenTMPremix EX TaqTM(Tli RNaseH Plus)(TaKaRa,日本)。4 个目的基因的扩增引物均为WRKY-F:5'TCTCTCTCTCTCTATCTATCTA 3'、WRKY-R:5'TGCTTGCTAGTTGAGGAG TGAA 3'。以柑橘Actin基因为内参基因,Actin 的扩增引物为Actin-F:5'AGAACTATGAACTGCCTGATGGC 3'、Actin-R:5'GCTTGGAGCAAGTGCT CTGATT 3'。采用20 µL 反应体系,10 µL TB Green Premix EX Taq(Tli RNaseH Plus)、0.5 µL PCR Forward Primer、0.5 µL PCR Reverse Primer、8 µL ddH2O、1 µL cDNA 模板。反应程序如下:95 ℃30 s;95 ℃5 s,60 ℃30 s,39 个循环,95 ℃15 s,65 ℃5 s,95 ℃0.5℃/cycle。每个处理3 次重复。利用2-ΔΔCT方法进行数据分析。
2 结果与分析
2.1 ClWRKY75、CsWRKY75、FmWRKY75和CrWRKY75基因的克隆及序列分析
以柠檬、甜橙、金柑、芦柑4 种柑橘的叶片为材料,提取总RNA,将反转录后的cDNA 作为模板,通过PCR扩增从柠檬、甜橙、金柑、芦柑中克隆得到4个新的WRKY家族基因,经10 g/L琼脂糖凝胶电泳检测,目的条带与预期长度一致,并将其命名为ClWRKY75、CsWRKY75、FmWRKY75、CrWRKY75(图1)。
测序和序列分析结果(表1)表明:ClWRKY75和CsWRKY75的cDNA 全长均为702 bp,含有582 bp 的开放阅读框,编码193 个氨基酸;而FmWRKY75和CrWRKY75的cDNA 全长均为705 bp,含有583 bp 的开放阅读框;这4个基因编码的均为不稳定的亲水性蛋白(表1)。碱基序列比对结果显示,4个基因序列的相似性达99.1%,有16个碱基位点存在差异(图2)。
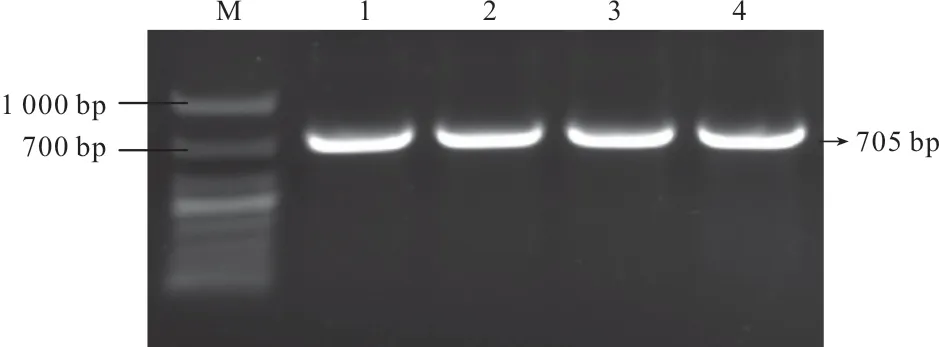
图1 ClWRKY75、CsWRKY75、FmWRKY75和CrWRKY75PCR扩增电泳图片Fig.1 Gel electrophoresis of PCR amplified product of ClWRKY75、CsWRKY75、FmWRKY75 and CrWRKY75
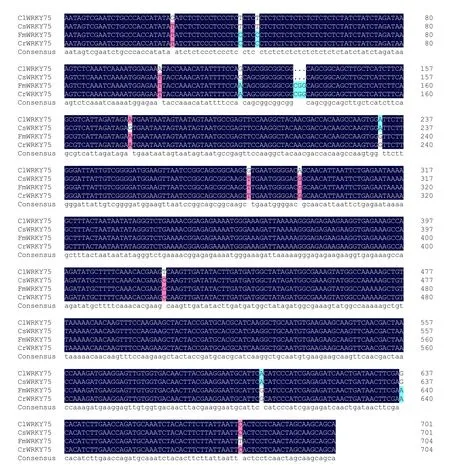
图2 柠檬ClWRKY75、甜橙CsWRKY75、金柑FmWRKY75和芦柑CrWRKY75碱基序列比对Fig.2 Alignment of predicted base sequence of ClWRKY75 from Citrus limon,CsWRKY75 from Citrus sinensis,FmWRKY75 from Fortunella margarita and CrWRKY75 from Citrus reticulata
2.2 ClWRKY75、CsWRKY75、FmWRKY75和CrWRKY75蛋白的同源性及进化分析
通过NCBI 中的ORF Finder 程序将碱基序列翻译成氨基酸序列,利用NCBI 获取多种植物的WRKY75 蛋白序列,再使用DNAMAN 软件进行多序列比对。结果表明ClWRKY75、CsWRKY75、Fm‑WRKY75 和CrWRKY75 蛋白的同源性高达99.23%。与其他物种WRKY75 蛋白进行多重序列比对分析表明,4个新蛋白均有WRKY 家族共有特点,即包含1个WRKY 结构域(序列为WRKYGQK)和1个C2H2型锌指结构域(序列为C-X4-C-X23-H-X1-H)1 个氨基酸同源序列比对发现ClWRKY75、CsWRKY75、FmWRKY75 和CrWRKY75 与其他植物的WRKY 蛋白有较高的相似性(图3),其中4 个蛋白与克莱门柚CcWRKY75、苹果MdWRKY75、可可TcWRKY75、葡萄VvWRKY75的同源性均高于90%。

表1 柑橘WRKY75基因序列分析Tab.1 Sequence analysis of Citrus WKRY75

图3 ClWRKY75、CsWRKY75、FmWRKY75和CrWRKY75氨基酸序列与其他植物WRKY75蛋白的多序列比对Fig.3 Alignment of the ClWRKY75、CsWRKY75、FmWRKY75 and CrWRKY75 amino acid sequences with those in other plants
系统发育树结果表明,ClWRKY75、CsWRKY75、FmWRKY75 和CrWRKY75 与克莱门柚CcWRKY75(XP_006437986.1)的亲缘关系最近,与烟草NtWRKY75(XP_016483103.1)的亲缘关系较远(图4)。
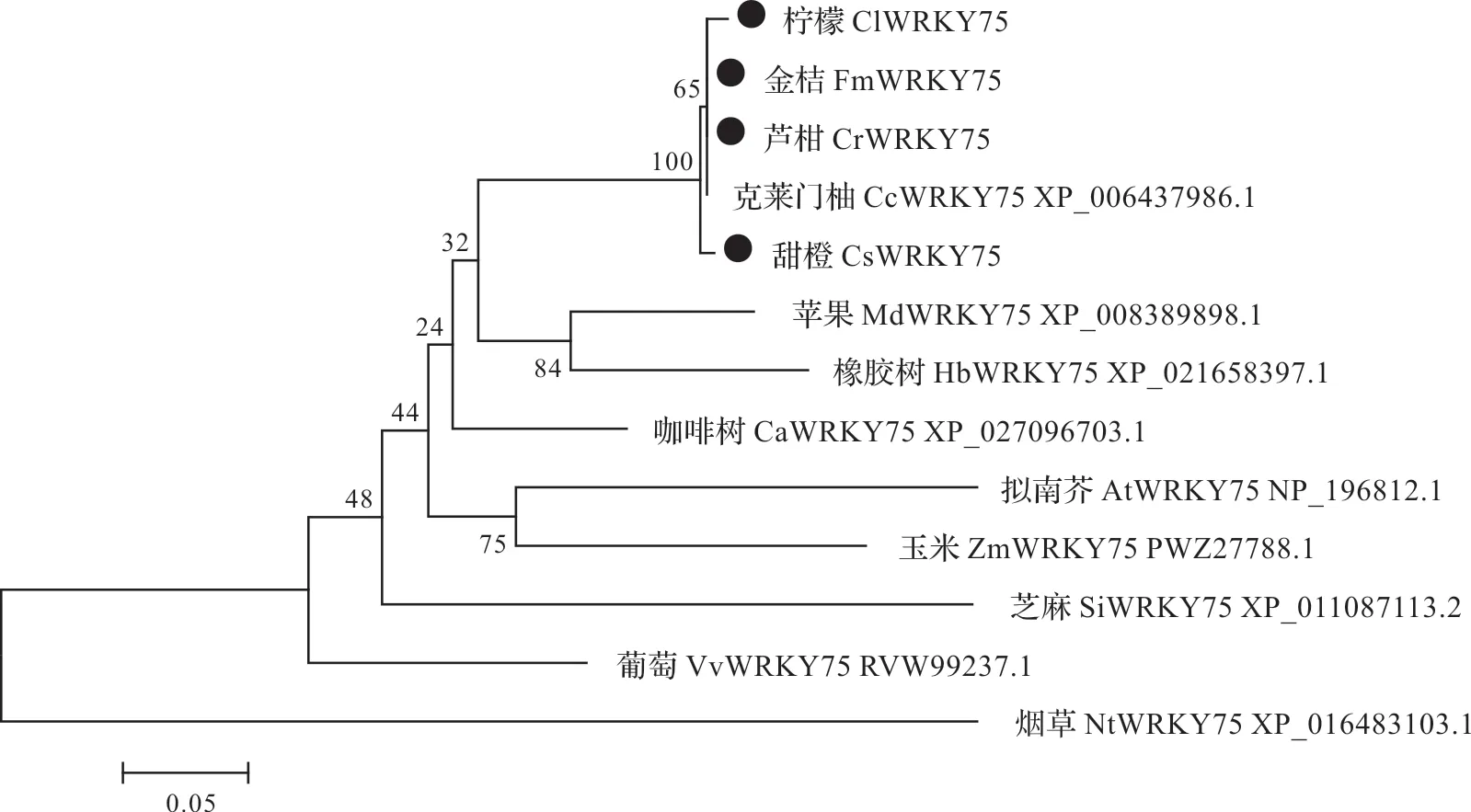
图4 不同植物WRKY75蛋白系统发育分析Fig.4 Phylogenetic analysis of WRKY75 proteins from different plants
2.3 ClWRKY75、CsWRKY75、FmWRKY75和CrWRKY75蛋白的亚细胞定位及核定位信号预测
根据亚细胞定位预测结果显示,4 个WRKY75 蛋白定位于细胞核的预测分值均显著高于其他位置,预测ClWRKY75、CsWRKY75、FmWRKY75 和CrWRKY75 蛋白定位于细胞核。4 个WRKY 蛋白氨基酸序列中的特定位点核定位分值较高,预测这些氨基酸序列为核定位序列(表2)。
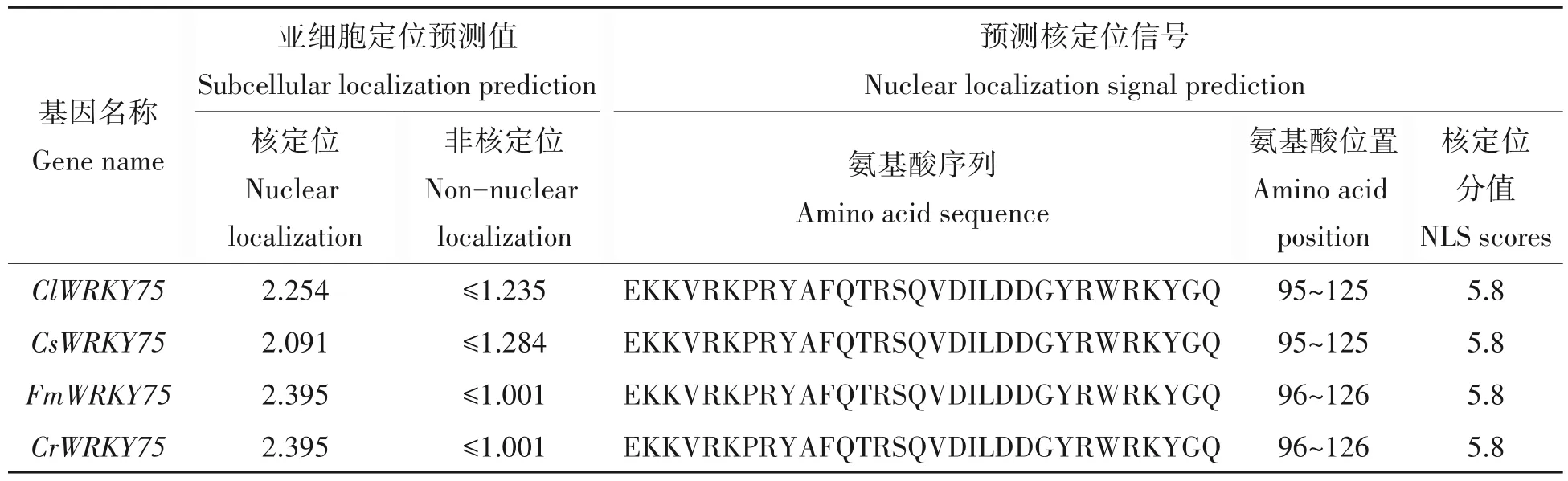
表2 柑橘WRKY75蛋白亚细胞定位及核定位信号预测Tab.2 CELLO and NLS prediction of Citrus WRKY75 proteins
2.4 ClWRKY75、CsWRKY75、FmWRKY75和CrWRKY75蛋白的二级结构及三维结构预测
利用在线网站预测ClWRKY75、CsWRKY75、FmWRKY75和CrWRKY75蛋白的二级结构,结果显示:ClWRKY75 蛋白含无规则卷曲结构47.15%,α-螺旋结构30.57%,延伸链结构13.47%,β-转角结构8.81%;CsWRKY75 蛋白含无规则卷曲结构52.33%,α-螺旋结构29.02%,延伸链结构10.36%,β-转角结构8.29%;FmWRKY75蛋白含无规则卷曲结构39.18%,α-螺旋结构35.05%,延伸链结构13.92%,β-转角结构11.86%;CrWRKY75蛋白含无规则卷曲结构40.72%,α-螺旋结构34.02%,延伸链结构13.40%,β-转角结构11.86%(图5)。预测结果表明4 个蛋白的二级结构极为相似,因此以ClWRKY75 蛋白为例,在线构建ClWRKY75蛋白三维结构模型(图6)。
2.5 ClWRKY75、CsWRKY75、FmWRKY75和CrWRKY75在非生物胁迫处理后的表达分析
通过实时荧光定量技术对柠檬ClWRKY75、甜橙CsWRKY75、金柑FmWRKY75和芦柑CrWRKY75基因在不同组织以及低温(4 ℃)、干旱(20%PEG6000)和高盐(NaCl)胁迫处理不同时间后的表达模式进行了分析(图7)。
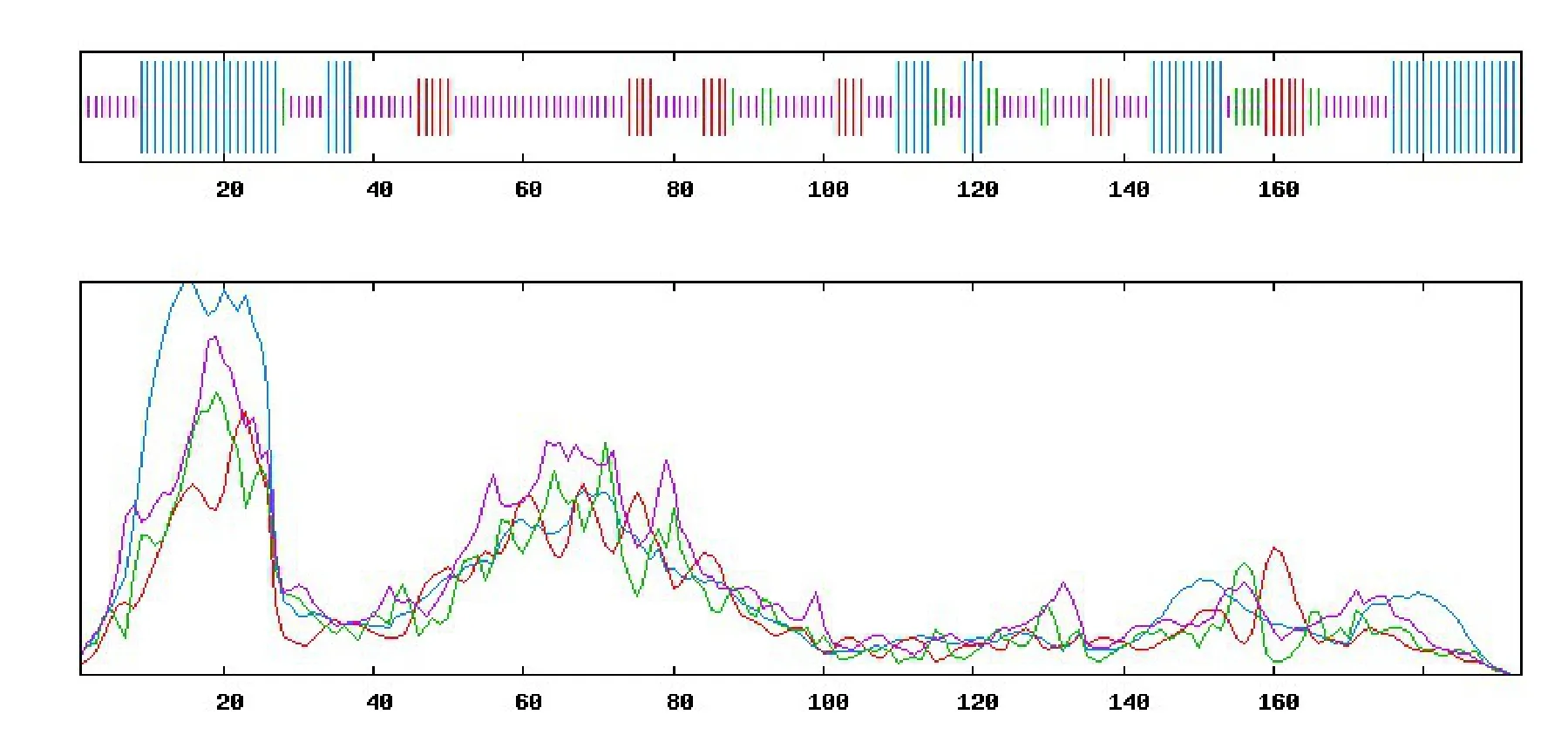
图5 ClWRKY75蛋白的二级结构预测结果Fig.5 Secondary prediction results of protein ClWRKY75
实时荧光定量PCR 分析结果显示,WRKY75基因在柠檬、甜橙、金柑和芦柑的根、茎、叶、果皮、果肉等不同组织中均有表达,且表达量存在差异性,表明柠檬ClWRKY75、甜橙CsWRKY75、金柑FmWRKY75和芦柑CrWRKY75基因具有组织特异性。柠檬和芦柑在叶片中表达量最高,且柠檬ClWRKY75在叶片中的表达量显著高于甜橙CsWRKY75、金柑FmWRKY75和芦柑CrWRKY75;甜橙CsWRKY75和金柑FmWRKY75则在果肉中表达量最高。

图6 ClWRKY75蛋白三维结构预测模型Fig.6 Predicted 3D structure model of ClWRKY75 protein
4 ℃低温胁迫下,柠檬ClWRKY75、甜橙Cs⁃WRKY75、金柑FmWRKY75和芦柑CrWRKY75在叶片中均有表达。4 个基因都呈先下降后上升的趋势。柠檬ClWRKY75、甜橙CsWRKY75和芦柑CrWRKY75在处理24 h时表达量达到最大值,且均高于处理前(0 h)。其中柠檬ClWRKY75的表达量最高,为对照的2倍左右。金柑FmWRKY75的表达量则在12 h时达到最大值,且高于处理前。这个结果说明4个基因均能被低温处理诱导表达。
20%PEG6000 模拟干旱胁迫处理时,4 个基因在叶片中均有表达。胁迫处理后,柠檬ClWRKY75的表达整体呈下降趋势,在6 h 时略有上升,之后缓慢下降。除6 h 外,处理后的各时间点,ClWRKY75的表达量均显著低于处理前;甜橙CsWRKY75基因在胁迫处理3 h后表达量显著下降,并保持这个水平直到处理后12 h。处理后24 h 时,甜橙CsWRKY75的表达量恢复到处理前的水平;金柑FmWRKY75的表达量在胁迫处理1~3 h 时显著下降,在6 h 时显著增加达到最大值,且显著高于处理前,随后迅速下降;CrWRKY75在干旱胁迫处理1~6 h时的表达量显著下降,在处理12~24 h时显著增加,且显著高于处理前。这个结果说明,干旱可以诱导FmWRKY75和CrWRKY75表达。
250 mmol/L NaCl 胁迫处理时,柠檬ClWRKY75、甜橙CsWRKY75、金柑FmWRKY75和芦柑CrWRKY75等4个基因在高盐处理1 h时,均迅速下降,达到其表达水平的最低值,而后在处理3 h时表达均增加。柠檬ClWRKY75在处理3~12 h时表达均显著低于处理前,但在处理后24 h恢复到处理前的水平;CsWRKY75基因在处理3~12 h 时表达量变化较小,24 h 时升高达到最大值,且CsWRKY75基因在24 h 时的表达量显著高于处理前;金柑FmWRKY75和芦柑CrWRKY75在处理6~24 h 时变化幅度较大。相对于处理后3 h,处理6 h 后金柑FmWRKY75表达水平先下降,然后升高,在处理12 h 后达到最大值,且显著高于处理前,随后显著下降;芦柑CrWRKY75在处理后6 h时恢复到处理前水平,随后下降再恢复到处理前水平。这个结果说明,高盐胁迫可以使FmWRKY75和CrWRKY75表达升高。
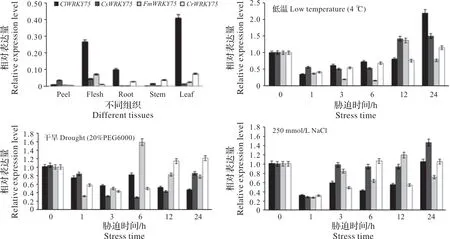
图7 非生物胁迫处理后WRKY75 在柠檬、甜橙、金柑、芦柑叶中的表达Fig.7 Expression patterns of WRKY75 in Citrus limon,Citrus sinensis,Fortunella margarita and Citrus reticulate leaves after abiotic stresses treatments
3 讨论
近年来,转录因子被广泛研究,越来越多的转录因子基因被挖掘出来,通过对其功能的研究为分子植物育种提供了基因资源和理论依据。柑橘类果树属于生长期较长的木本果树,抗逆转录因子的研究对其品种改良具有重要意义。过表达PtrbHLH通过与CAT基因启动子元件结合来调节H2O2水平从而增强柚的耐寒性[27];CsAP2-09基因参与柑橘抗病性和胁迫耐受性[28];CsPIF8基因通过调节超氧化物歧化酶的表达有助于提高柑橘的耐寒性[29]等研究都对柑橘品种改良具有借鉴意义。
WRKY 家族转录因子作为植物中一类重要的转录因子,在植物抵御生物和非生物胁迫中起着重要的调控作用[30]。目前,关于柑橘中WRKY 家族基因的研究较多,包括可以被干旱和低温胁迫诱导表达的枳PtrWRKY1[31],可以增强转基因植物抗旱性的金柑FcWRKY70[32],与柑橘抗病性有关的甜橙Cs⁃WRKY22[33]。另外,Şahin-Çevik 等[34]从枳中克隆出了PtrWRKY3基因,并证明PtrWRKY3基因可以被低温和干旱诱导表达。Ayadi 等[35]从柑橘中鉴定了100 个WRKY家族基因,并进行了系统进化分析和功能预测。周鹏飞等[36]从纽荷尔脐橙中克隆出了CsWRKY22、CsWRKY50、CsWRKY72-1和CsWRKY72-24 个基因。表达分析表明,CsWRKY50在柑橘响应溃疡病中起了一定的作用,CsWRKY22在寄主的感病响应中起了一定的作用。另外,柑橘溃疡病菌能抑制CsWRKY72-1和CsWRKY72-2表达,并且4 个基因均不能响应水杨酸和茉莉酸甲酯调控的抗病反应。Vives-Peris 等[37]研究了柑橘WRKY家族基因在多种激素和渗透胁迫下的表达模式,证明柑橘WRKY家族基因可以响应多种激素和渗透胁迫。但是有关柑橘WRKY75的研究未见报道。本研究从柠檬、甜橙、金柑、芦柑中克隆得到了4 个新的WRKY75同源基因,并对其进行生物信息学分析。氨基酸序列比对结果表明,4 个柑橘WRKY75 蛋白的氨基酸序列与其他物种WRKY75 蛋白的氨基酸序列具有很高的同源性,并且具有相同的保守结构域(1 个WRKY 保守结构域和1个C2H2型锌指结构域)。根据所含保守结构域,WRKY 家族转录因子基因可分为3组:第1组(group I)WRKY 转录因子含有2 个保守的WRKY 结构域和1 个C2H2 型锌指结构域;第2 组(group II)WRKY 转录因子只含有1个保守的WRKY结构域和1个C2H2型锌指结构域;第3组(Group III)WRKY转录因子含有1 个WRKY 结构域和1 个C2HC 型锌指结构域[11]。因此,笔者克隆的4 个柑橘WRKY75 蛋白均属于WRKY转录因子家族中的第2组(group II)。
有研究表明,植物WRKY75基因也具有响应生物和非生物胁迫的功能。例如,陈晓丽等[38]研究表明,巴西橡胶树HbWRKY75基因能够被高盐、低温和干旱等非生物胁迫诱导表达;拟南芥AtWRKY75基因具有响应磷胁迫的功能[15];López‑Galiano 等[39]研究表明,生物胁迫(包括灰霉病原菌和丁香假单胞菌)处理后,番茄SlWRKY75表达显著增加。与前人结果一致,本研究表明,4 ℃低温处理可以提高柠檬ClWRKY75、甜橙CsWRKY75、金柑FmWRKY75和芦柑CrWRKY75基因的表达量。而20%PEG6000模拟干旱处理只能提高金柑FmWRKY75和芦柑CrWRKY75表达量。250 mmol/LNaCl胁迫处理只能提高甜橙Cs⁃WRKY75和金柑FmWRKY75表达量。这可能与植物本身对环境的耐受性差异有关,因此在相同的胁迫条件下会产生不同的胁迫应答响应。相似的结果在其它柑橘WRKY基因中也有发现,例如,干旱和低温处理均可以诱导枳(Poncirus trifoliata)PtrWRKY1表达,但只有干旱可以诱导柚(Citrus grandis)CgWRKY1表达[40]。这个结果说明,WRKY75可能在柑橘响应非生物胁迫过程中起了一定的作用。但不同柑橘种类中,WRKY75基因对非生物胁迫的响应也不同。
因此,选取不同品种的柑橘类物种对WRKY75基因的抗逆性进行研究,为后续研究柑橘WKRY基因响应逆境的功能提供依据。这些研究结果为进一步利用现代分子生物技术手段调控上述基因、改良柑橘品种抗性提供理论参考。比如,通过超量表达和基因沉默进一步研究WRKY75基因在柑橘响应非生物胁迫中的具体功能。通过酵母单(双)杂交、双荧光素酶、免疫共沉淀、凝胶电泳迁移率试验等技术研究柑橘WRKY75转录因子调控下游基因表达的分子机理。

