球形钛酸镍的制备及其电化学性能表征
王慧莹,肖 利,陈 晗,朱裔荣,向楷雄
(湖南工业大学冶金与材料工程学院,湖南株洲412007)
钛酸盐系列的无机材料,特别是钛酸铅、钛酸钡、钛酸锶、钛酸钴和钛酸镍等在现代工业中具有广泛的应用[1]。其中,NiTiO3可被用于清除气体中的有机污染物的光催化剂[2];作为n 型半导体,NiTiO3可广泛用于传感器[3];由于镍和钛之间的无序转变,在低温下,NiTiO3表现出反铁磁性,且具有高居里转变温度(Tc=1 570 K)[4];此外,NiTiO3还是一种新型锂离子电池负极材料,具有易制备、导电性能好、锂离子嵌入/脱嵌过程中结构稳定性好、安全性能高以及理论容量较高等优点[5-7]。已有研究者采用溶胶-凝胶法[3]、熔盐法[4,8]、水热法[5]、聚合物前驱体法[9]、静电纺丝法[10]、硬脂酸凝胶法[11]、煅烧共沉淀法[12]等多种方法成功地合成了NiTiO3。
由于锂离子电池负极材料在锂离子嵌入和脱嵌过程中,材料的体积通常会发生改变,从而影响其循环稳定性。因此研究者通过设计不同的合成工艺制备负极材料,或通过制备不同形貌的负极材料以期提升其循环稳定性[6]。在所有的合成方法中,溶胶-沉淀法工艺简单,均匀性好,反应可控[13-14];且负极材料制备成球形,有利于循环更稳定。目前尚未有溶胶-沉淀法制备球形NiTiO3颗粒并应用于锂离子电池。本文采用溶胶-沉淀法(sol-precipitation methods)制备了球形NiTiO3颗粒,研究了球形NiTiO3的晶体结构、微观形貌及电化学性能;同时研究了通过复合片状石墨改善球形NiTiO3的电化学性能。
1 实验
1.1 实验材料
实验所用主要材料有C4H6O4Ni·4 H2O(分析纯,西陇科学股份有限公司);Ti-(OC4H9)4(化学纯,国药集团化学试剂有限公司);CO(NH2)2(分析纯,广东台山粤桥试剂塑料有限公司);片状石墨;乙炔黑(国药集团化学试剂有限公司);PVDF 粘结剂(国药集团化学试剂有限公司);电解液LiPF6/(EC+DEC)(电池级,广州天赐高新材料股份有限公司);N-甲基吡咯烷酮(NMP)(天津光复精细化工研究所);扣式电池壳(CR2025,广东鹏辉电池有限公司);金属锂片(电池级,武汉鑫思锐科技有限公司)。
1.2 NiTiO3的制备
准备300 mL 乙醇,滴入1 mL KCl 溶液(0.4 mmol/L);量取5 mL Ti-(OC4H9)4,缓慢滴入乙醇溶液中,磁力搅拌2 h 后,离心收集白色悬浮液;再将其分散于200 mL 的蒸馏水中,继续搅拌;称取C4H6O4Ni·4 H2O 和CO(NH2)2[C4H6O4Ni·4 H2O∶CO(NH2)2的摩尔比为1∶3],依次加入直至完全溶解后,水浴加热至80 ℃搅拌6 h,冷却后用乙醇和水依次抽滤、洗涤;放置于60 ℃鼓风干燥箱干燥12 h 后粉末样品呈浅绿色;装入方舟放至马弗炉中升温至750 ℃(升温速度5 ℃/h)保温3 h 得到黄色NiTiO3粉末。
1.3 NiTiO3片状石墨复合材料的制备
按照质量比4∶1 准备实验所制备的黄色NiTiO3粉末和片状石墨,将NiTiO3加入适量乙醇溶液中,磁力搅拌至粉末分散后,将溶液水浴加热至60 ℃,再加入片状石墨继续搅拌10 h,最后,放置于80 ℃鼓风干燥箱,待完全干燥后研磨收集粉末样品。
1.4 电池制备
将制备的NiTiO3粉末作为活性物质,乙炔黑作为导电剂,聚偏二氟乙烯(PVDF)作为粘结剂,三者质量比为7.5∶1.5∶1.0,用N-甲基吡咯烷酮(NMP)混合制成浆料,将浆料均匀涂覆在铜箔上后真空干燥12 h,之后切成直径14 mm 的圆形负极极片,将负极片置于充满高纯氩气的手套箱中,采用单层聚丙烯隔膜(PP,Celgard 2400),以金属锂片为正极,LiPF6/(EC+DEC+EMC,体积比1∶1∶1)为电解液,进行CR2025 扣式电池的组装,组装成半电池;NiTiO3片状石墨复合粉末也按照同样的步骤组装成半电池;将电池常温下静置12 h 后,进行相应的电化学性能测试。
1.5 物性研究及电化学性能检测
选用X 射线衍射仪(XRD,Rigaku Ultima IV)对NiTiO3粉末做物相分析;采用扫描电子显微镜(SEM,FEI QUANTA 400)对NiTiO3做样品形貌分析;采用深圳新威BTS-5V10mA型恒电流充放电测试仪对NiTiO3锂离子电池做充放电测试;采用上海辰华CHI660E 电化学工作站对所制备电池做循环伏安测试(CV)和电化学阻抗测试(EIS)。
2 结果与分析
2.1 NiTiO3的XRD 分析
图1 为不同烧结温度下NiTiO3粉末样品的XRD 谱图。烧结温度650、700、750 和800 ℃,分别对应图1 中的4 个XRD图谱。由图1(2)可以看到,烧结温度为750 ℃的样品,在2 θ为24.36°、33.28°、35.86°、41.02°、49.62°和54.18°等处出现了多个衍射峰,其分别对应于标准谱图NiTiO3(PDF#33-0960)的(012)、(104)、(110)、(113)、(024)、(116)等晶面的衍射峰。各个峰的位置及峰形基本吻合,且衍射峰形状尖而窄,说明所得物质粉体结晶度好,无杂质,可以确定制备的黄色粉末为NiTiO3。对比图1(1)、(3)、(4),当烧结温度较低时,出现NiO 杂质,由此推测温度不够导致反应不能完全进行;随着温度的升高,NiO 杂质特征峰降低,NiTiO3的结晶度增高;而当温度升高到800 ℃时TiO2的特征峰非常明显,NiTiO3的特征峰相对较低,表明样品中TiO2杂质的含量较多。由此可知,750 ℃为NiTiO3的最佳烧结温度。

图1 样品在不同烧结温度下的XRD 图谱
2.2 NiTiO3的SEM 分析
所制备产物NiTiO3的SEM 如图2 所示。图2(a)是产物NiTiO3放大30 000 倍的SEM 图片,(b)和(c)为产物NiTiO3的局部放大图。由图2(a)可以看出,产物NiTiO3呈均匀的球形,直径约为1 μm,边界清晰。结合吴健春等[15]的研究和图2(a)可以推测,产物的形貌在形成中间产物偏钛酸[Ti(OH)4]的时候已经基本团聚成球型,由Ti(OH)4生成NiTiO3,使球形颗粒边界更清晰。图2(b)是产物NiTiO3放大50 000 倍的SEM,图2(c)是2(b)的局部放大图,从图2(c)可看出球形NiTiO3颗粒的表面粗糙。根据反应历程,Ti-(OC4H9)4在乙醇的作用下缓慢水解生成Ti(OH)4沉淀,Ti(OH)4与C4H6O4Ni·4 H2O 高温反应过程中水蒸气从Ti(OH)4内部离开,同时镍离子进入Ti(OH)4内部生成具有粗糙表面NiTiO3,这种粗糙表面一方面保证镍离子嵌入钛酸根附近生成NiTiO3,另一方面有利于NiTiO3具有特殊的性能。

图2 NiTiO3的SEM
2.3 NiTiO3电化学性能测试分析

图3 0.1 C倍率下NiTiO3前两次充放电曲线
将制备的NiTiO3作为负极活性物质组装成电池,在0.01~3.00 V,0.1 C(50 mA/g)倍率下充放电,首次和第二次充放电曲线如图3 所示。从图3 可知,首次放电比容量为720.7 mAh/g,充电比容量为375.6 mAh/g,库仑效率为52.1%,其中,结合放电曲线图(图3)和循环伏安图(图4),首次循环在放电区间1.50~1.00 V、1.00~0.50 V、0.50~0.01 V 都有放电平台,在充电区间0.01~0.50 V、2.00~2.50 V 有明显的充电平台;第二次充电平台变化不大,而放电平台则为1.50~1.00 V 和0.50~0.01 V,中间的1.0~0.5 V 的长放电平台消失。第二次放电比容量为364.4 mAh/g,充电比容量为331.3 mAh/g,库仑效率为90.9%。第一周期不可逆容量的部分原因可能为结构不完全可逆,不能回到NiTiO3的原生晶体结构[5]。还有一部分是由于在首次循环过程中锂离子参与形成SEI膜,消耗了一部分Li+。
图4 为半电池结构中NiTiO3负极不同循环次数下的循环伏安曲线图(CV)。测试范围在0.000~3.000 V,扫描速率为0.1 mV/s。由于电池极化或局部结构变化,第一次(黑色曲线)中的氧化还原过程不同于随后的循环过程(红色曲线)。在第一次中,CV 曲线中在1.077 和0.145 V 有两个还原峰,这些峰分别与Ti 和Ni 的形成相关,导致了非晶Li2O 的形成;氧化峰出现在0.206 和2.157 V,对应于Li2O 的分解,该过程导致Ni和Ti 的氧化[7]。在随后的循环中,还原峰从1. 077~1.323 V的电位偏移可能是由锂离子嵌入引起的激活过程;两个氧化峰出现在0.230 和2.257 V,它们不同于首次循环,但与首次循环氧化峰电位差较小(分别为0.024 和0.100 V),结合充放电曲线说明充电过程较放电过程容量衰减小。
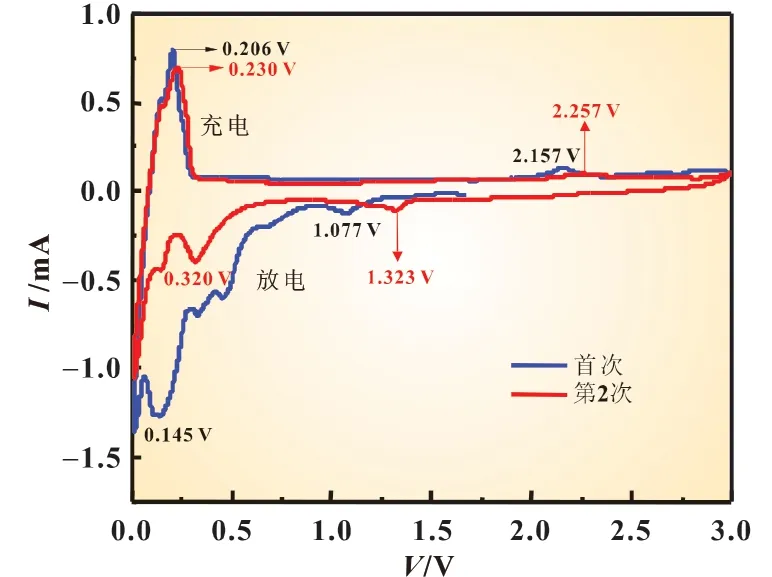
图4 NiTiO3 负极前两次循环的CV曲线
图5 为1.0 C 时NiTiO3电极循环性能图,在前10 个周期容量下降较快,这是由于所制备的NiTiO3逐渐活化,从10~20 次其充电/放电行为趋于稳定[5]。在20 次之后充电比容量为139.06 mAh/g,循环100 次的充电比容量为138.72 mAh/g,容量保持率高达99.7%。

图5 1.0 C时NiTiO3电极循环性能

图6 经20次循环后NiTiO3与循环前的交流阻抗图谱对比
图6 所示为经历20 次循环后与循环前NiTiO3的交流阻抗图谱对比。不同循环次数后所测的交流阻抗图谱都是由一个半圆和一条长低频线组成,其中中频半圆相互重叠。中频范围内的半圆表示电荷转移电阻,与通过电极/电解质界面的电荷转移有关;低频区域的斜线与锂离子在活性材料颗粒内部的固体扩散过程相关。从图6 可以看出,NiTiO3作为负极材料的锂离子电池,在循环前有较小的电荷转移电阻;随着循环的进行,结合图5 的电池容量衰减分析,在0.1 C 倍率下循环20 次后,电荷转移电阻有了很大程度的增加,主要是由于活性颗粒表面SEI 膜的生成和材料的不可逆相变引起的,但是生成稳定的SEI 膜有利于循环性能的稳定。此外,SEI 膜的形成以及活性材料和电解质在锂化初期不可逆的相变,是导致首次库仑效率低的原因。但是后期可以通过预锂化和表面改性这两种途径,通过抑制活性物质和电解质之间的不可逆相变从而提高首次库仑效率[5]。
2.4 NiTiO3片状石墨复合材料的SEM 分析
所制备产物NiTiO3片状石墨复合材料(NiTiO3@C)的SEM如图7 所示。图7(a)和(b)是复合产物放大20 000 倍的SEM 图片,(c)和(d)为复合产物的局部放大图。由图7(a)和(b)可以看出复合产物存在片状石墨,且片状石墨呈“外衣”状贴附于球形NiTiO3上。图7(c)是复合产物放大50 000 倍的SEM 图片,图7(d)是7(c)的局部放大图。从图7(c)和(d)可以看出片状石墨对球形NiTiO3颗粒呈半包裹状态,这种半包裹状态可以有效地防止充放电过程中球形NiTiO3颗粒的开裂和表层剥落,保护材料的原始晶体结构,提升材料的循环性能。

图7 NiTiO3@C的SEM
2.5 NiTiO3片状石墨复合材料电化学性能测试分析
将制备的NiTiO3片状石墨复合材料(NiTiO3@C)作为负极活性物质组装成电池,在0.01~3.00 V,0.1 C 倍率下充放电,首次和第二次充放电曲线如图8 所示。从图8 可知,复合后的NiTiO3首次放电比容量为694.8 mAh/g,充电比容量为416.7 mAh/g,库仑效率为60.0%,比图3 中未作复合处理的NiTiO3的首次库仑效率提高了7.9%;并且,经过复合的NiTiO3充放电平台之间的电压差明显变小,这说明复合后的NiTiO3锂离子电池在充放电过程中极化小,能量损失少,库仑效率高;第二次放电比容量为419.5 mAh/g,充电比容量为398.1 mAh/g,库仑效率为94.9%,提高了4%。通过充放电数据比较可以得到:片状石墨复合能够改善NiTiO3首次充放电过程中结构不完全可逆造成第一周期库仑效率低,并且能够较好地保持后续循环过程中NiTiO3的晶体结构。

图8 0.1 C倍率NiTiO3@C前两次充放电曲线
图9 为1.0 C 时NiTiO3复合前后电极循环性能对比图。从图中可以明显看出,经过片状石墨复合改性后的NiTiO3循环性能明显提高,1 C 倍率下循环100 次后的比容量达226.9 mAh/g,比未复合改性的NiTiO3高88.2 mAh/g,容量保持率提高了29.1%,达到76.1%;与NiTiO3前10 次容量下降快相比,经过片状石墨复合改性后的NiTiO3容量衰减率更低,只在前5 次有稍微明显的减少,活化时间只需要原来的一半,5~10 次充电/放电行为趋于稳定,10 次之后容量保持率高达98.5%。
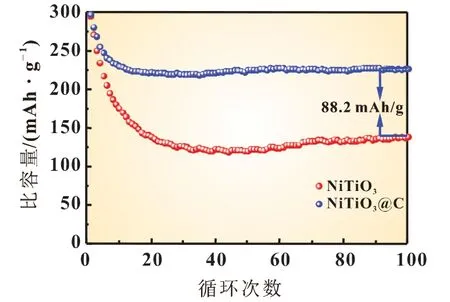
图9 1.0 C时NiTiO3复合前后电极循环性能对比
图10 所示为NiTiO3复合前后的交流阻抗图谱对比。从图中可以看出,通过片状石墨复合后材料的导电性能提高了,在循环20 次之后,电阻从282.7 Ω 降到132.7 Ω,电荷转移电阻的减小,说明复合后的NiTiO3具有更快的电子转移能力, 从而可能具有更高的氧还原催化性能。循环前低频区的斜线斜率变大说明电池极化减小,锂离子在界面扩散的阻抗减小。
3 结论

图10 NiTiO3复合前后的交流阻抗图谱对比
采用溶胶-沉淀法制备了球形NiTiO3颗粒。采用XRD 分析了NiTiO3的晶体结构;SEM 研究发现产物为平均粒径约1 μm 的表面粗糙的球形颗粒。在此基础上进行片状石墨复合NiTiO3实验,通过电化学性能测试结果对比,该球形NiTiO3作为锂离子电池负极材料,在0.1 C 倍率下,首次循环库仑效率为52.1%,第二次循环中库仑效率达90.9%;当充放电倍率为1 C 时,在前10 次循环电池激活后,第20~100 次电池容量基本没有减少,容量保持率高达99.7%;而复合后的NiTiO3首次库仑效率提高了7.9%,1 C 倍率下循环100 次后容量保持率提高29.1%;交流阻抗分析表明,随着循环次数增加,片状石墨复合后的NiTiO3电荷转移电阻比复合前少53%。因此,采用溶胶-沉淀法所制备的球形NiTiO3可作为锂离子电池负极材料;而且,片状石墨复合NiTiO3使材料晶体结构更加稳定,导电性能提高,电池极化减小,材料循环性能提高,有利于NiTiO3锂离子电池负极材料的市场应用。

