兽用疫苗中BVDV、PCV2 和PPV 污染三重荧光定量PCR 检测方法的建立
王 艳,张秋蕾,王英华,俞向前,张 强,文德亮
(1.上海海关,上海 200135;2.青岛海关,山东青岛 226002;3.浦东新区动物疫病预防控制中心,上海 201299)
生物制品的生产通常以微生物或人/动物源的细胞、组织和体液等为起始原材料,其制备过程或制剂中可能添加人或动物来源的原材料或辅料。这些起始原料、原材料或辅料潜在的病毒污染是影响产品安全性的关键因素[1]。理论上,生物制品都存在病毒污染的潜在风险,应对产品病毒污染进行检测[1]。
外源病毒污染会影响疫苗的使用效果,甚至引起生物安全问题[2]。吴华伟等[3]检测发现,国内猪用活疫苗副流感病毒5 型污染率约为16.7%。牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)是疫苗生产中常见的外源性病原之一。美国菌种保藏中心(ATCC)于1994 年调查其细胞库,发现有13 株细胞污染了BVDV[4];日本也曾有报道[5],在5 批麻风腮及风疹疫苗中检出了BVDV核酸。猪圆环病毒(porcine circovirus,PCV)属于圆环病毒科,目前呈世界性流行,2010 年,葛兰素史克和默克两大疫苗生产厂商所生产的轮状病毒疫苗中均检出PCV[6]。猪细小病毒(porcine parvovirus,PPV)属于细小病毒科,能持续感染哺乳动物细胞系,会对以细胞为材料的生物制品生产产生潜在危害[7]。
目前,检测这三种病原的方法主要有RTPCR、ELISA、荧光RT-PCR,但都是多以单一病原的检测为主。与传统PCR 方法相比,荧光定量PCR 检测技术具有灵敏度高、快速简便等优点。本研究拟利用荧光定量PCR 技术探索可同时检测兽用疫苗中BVDV、PCV2 和PPV 3 种外源性病毒的方法,以主要的生物安全因子为关键点,建立可以快速检测相关生物安全因子的检测体系,可以同时检测出3 种外源污染因子,从而为兽用疫苗的生物安全保驾护航。
1 材料与方法
1.1 试剂和仪器
荧光定量PCR 试剂,购自大连(Takara)宝生物公司;焦碳酸二乙酯(DEPC)、感受态细胞(DH5α)以及1×TE buffer,购自上海生工生物技术有限公司;ABI7500 Fast 荧光定量PCR 仪,购自美国ABI 公司;猪瘟病毒(classical swine fever virus,CSFV)质粒、猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome,PRRSV)质粒、伪狂犬病病毒(pseudorabies virus,PRV)质粒、非洲猪瘟病毒(African swine fever virus,ASFV)质粒,均由上海海关动植物与食品检验检疫技术中心保存。
1.2 方法
1.2.1 基因序列比对和合成 参考并下载GeneBank 中登录的BVDV、PCV2 和PPV 的基因序列(登录号分别为U18059.1、HZ797209.1、AY583318.1)信息,送上海生工生物工程有限公司完成相应保守区域基因合成,转化至DH5α 感受态细胞后,扩繁菌液并提取质粒,以制备相应标准品。制备的3 种标准品分别命名为pUC57-BVDV、pUC57-PCV2、pUC57-PPV,3 种标准品分别用1×TE buffer 配制成50 ng/µL 储存液,-20 ℃保存备用。
1.2.2 引物及探针设计与合成 针对BVDV 5'-UTR、PCV2Rep以及PPVNS1基因序列,应用DNAstar 软件设计引物及相应探针(表1)。引物和探针分别由上海翰宇生物科技有限公司和Lifetech 公司合成。
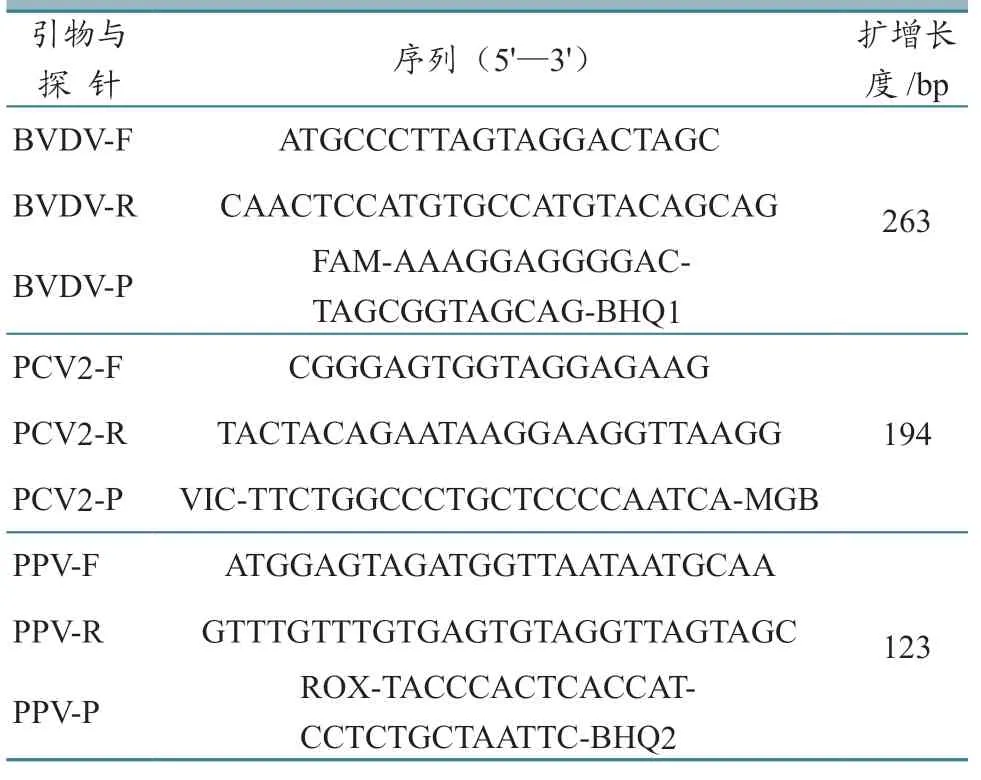
表1 实时荧光PCR 引物与探针
1.2.3 三重荧光定量PCR 方法建立
1.2.3.1 反应条件优化和标准曲线建立 在成功建立单一检测体系的基础上,通过改变引物与探针的浓度以达到最佳扩增效率,获得良好扩增曲线,进而建立三重荧光定量PCR 检测体系。对3种标准品分别进行梯度稀释,使每种标准品浓度为101~105copies/µL,并作为模板进行荧光定量PCR检测,每个浓度做3 个重复。以Ct 值为y轴,标准品的稀释度为x轴,制作标准曲线。
1.2.3.2 特异性试验 利用本试验建立的三重荧光定量PCR 检测方法,对BVDV、PCV2、PPV以及实验室保存备用的CSFV、PRRSV、PRV、ASFV 等其他相关病原质粒进行检测,验证该方法的特异性。
1.2.3.3 敏感性试验 分别将已知浓度的3 种质粒标准品进行梯度稀释,使每种标准品浓度分别为101~106copies/uL,利用建立的三重荧光定量PCR方法进行检测,利用检测阈值判断该方法的敏感性。
2 结果
2.1 质粒浓度测定
3 种标准品质粒的浓度和纯度见表2。
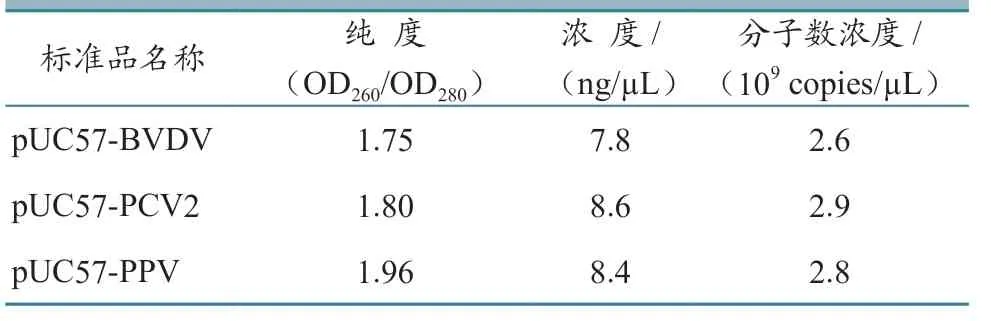
表2 3 种标准品的浓度和纯度
2.2 反应条件优化及标准曲线建立
对三重荧光定量PCR 各条件进行优化后,最终确定反应体系为:TaqMan Mixture(2×)12.5 µL,BVDV、PCV2、PPV 上下游引物各0.5 µL,BVDV、PCV2、PPV 探针各0.4 µL,模板各2.0 µL,用灭菌ddH2O 补足至25.0 µL。体系中所用引物和探针的浓度均配成10 pmol/mL。反应条件为:95 ℃预变性10 min;95 ℃变性20 s,60 ℃退火并延伸32 s,扩增40 个循环;在退火阶段收集荧光信号。
以建立的三重荧光定量PCR 方法对3 种标准品分别检测,以质粒标准品浓度的对数为x轴、Ct值为y轴,绘制标准曲线。结果(图1)显示,3种重组质粒标准品在浓度为10~105copies/µL 时都能检测出荧光信号,扩增曲线圆滑平整,且标准曲线均具有良好的线性关系,R2值均在0.99 以上。

图1 3 种标准品的荧光PCR 标准曲线
2.3 特异性试验
利用所建立的三重荧光定量PCR 体系对BVDV 等7 种病原质粒进行检测。结果(图2)显示,仅BVDV、PCV2、PPV 3 种病原质粒标准品出现相应扩增曲线,而其他病原质粒(CSFV、PRRSV、PRV、ASFV)均未出现扩增曲线,判为阴性,说明该检测方法具有良好的特异性。

图2 三重荧光定量PCR 特异性试验结果
2.4 敏感性试验
分别对已知浓度的3 种质粒标准品进行检测,利用检测阈值判断该方法的敏感性。结果(图3)显示,3 种标准品质粒在10 copies/µL 时仍能检测到荧光信号,表明建立的BVDV、PCV2 和PPV三重荧光定量PCR 方法具有较高的敏感性。
3 讨论
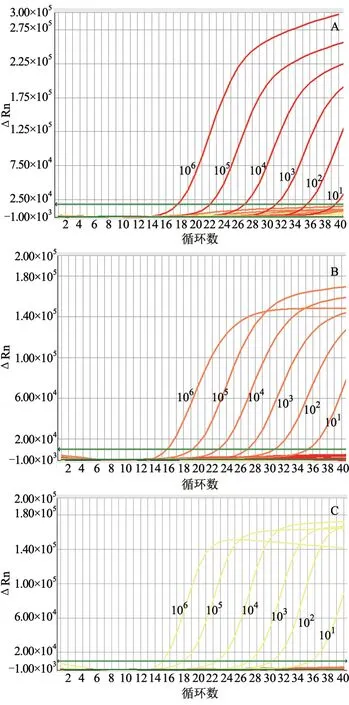
图3 三重荧光定量PCR 检测敏感性试验结果
虽然我国2015 年版兽药典未收录分子生物学检测方法,但是PCR 方法已经在国际贸易中广泛使用。分子生物学方法可同时确定外源病毒的多种病原种类,并根据检测结果,在生产过程中可以采取有效措施进行预防。朱晓玮等[8]曾对2012—2017 年猪瘟疫苗生产过程中所涉及的原辅料、半成品和成品进行BVDV 检测,发现114 批猪瘟疫苗中BVDV 阳性数为2 份,4 089 头新生牛血清中BVDV 阳性数为115 份。近年来,多种针对BVDV、PCV 和PPV 的快速检测方法已经建立,但主要为单一病原检测。钱兴丽等[9]建立了人用疫苗中PCV PCR 检测方法,其最低可检出1.34×104copies/µL 病毒核酸;任亚初[10]利用SYBR Green I检测方法建立了快速检测BVDV 的实时荧光定量PCR 法,其检测灵敏度可达4.87×101copies/µL;本试验建立的方法对BVDV、PCV2 和PPV 3 种病原的最低检测限均为10 copies/µL,说明该方法敏感性较好;除3 种病原外,该方法对CSFV、PRRSV、PRV、ASFV 等4 种其他相关病原均无非特异性扩增。利用本实验建立的检测方法对市售的猪流感H1N1 TJ 株等14 种兽用疫苗进行检测,结果均为阴性,提示所检测疫苗均无上述3 种外源病毒污染。此外,还需运用本方法对更多兽用疫苗开展检测,以进一步验证方法的可靠性。结果表明,建立的三重荧光定量PCR 检测方法能够对BVDV、PCV2、PPV 进行快速、及时、准确诊断,是控制并消灭这3 种外源性病原对生物制品感染的可靠方法,从而为生物制品外源病毒的检测提供了技术储备。

