微尺度下湿含量差异海参体壁的变化规律
林 琳,孙 霄,齐 欣,王伟霞,侯 虎,2*
(1 中国海洋大学食品科学与工程学院 山东青岛266003 2 青岛海洋科学与技术试点国家实验室 山东青岛266237)
海参(Stichopus japonicus)是天然营养的宝库,具有较高的营养价值和药用价值,其属于棘皮动物门,是一种重要的海洋无脊椎动物[1]。据报道,全世界已知的海参品种约1 100 多种,其中可食性的至少有40 种[2]。仿刺参在中国北方有较大范围的养殖,具有很高的营养价值和药用价值,2016年产量达20.43 万t,产值约600 亿元[3]。
新鲜海参具有易自溶、易腐败、易变质特点,给其加工、贮藏和运输过程带来了很大困难[4]。传统海参加工以干制海参为主,加工过程中营养物质损失严重,并且泡发过程繁琐。即食海参具有方便快捷、绿色营养的显著优势。即食海参加工过程中,高温高压处理能灭活微生物和内源酶,营养物质和活性成分流失较少[5]。然而,在贮藏过程中,高温高压海参(HSC)体壁易出现非酶非微生物的自溶现象,其体壁软化变黏,严重影响产品的质量和货架期[6]。贮藏过程中HSC 体壁质构的变化与微观结构的变化密切相关,目前关于微观结构的研究很少。徐志斌等[7]研究发现水发海参的微观结构之间存在明显差异。Zhang 等[8]研究发现低含水量刺参体壁的贮藏稳定性显著性提高,然而微观结构的变化却不清楚。
本文在已有研究的基础上,在微尺度下探讨贮藏过程中不同湿含量的HSC 组织结构的变化规律。通过制备不同湿含量的HSC,研究其在贮藏过程中TPA 参数、水分状态等的变化,探讨胶原纤维束和胶原蛋白分子结构的差异,为干预HSC组织结构的劣化,延长产品的货架期提供试验依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料 鲜活仿刺参,规格(100±10)g,购于青岛市南山水产品市场。
1.1.2 试剂 平板计数琼脂,青岛海博生物技术有限公司;NaCl、戊二醛、无水乙醇,国药集团化学试剂有限公司。
1.2 仪器与设备
扫描电子显微镜(JSM-840),日本JEOL 公司;透射电子显微镜(JEM-2000EX),日本JEOL公司;质构仪(TMS-PRO),美国FTC 公司;智能水分活度测量仪(HD-3A),无锡市华科仪器仪表有限公司;立式压力蒸汽灭菌器(LDZX-50KBS),上海申安医疗器械厂;人工气候箱(HPG-320H),哈尔滨市东联电子技术开发有限公司;台式真空干燥箱(DZF-6050),上海捷呈实验仪器有限公司。
1.3 试验方法
1.3.1 样品处理 选择质量相近、大小均匀的鲜活刺参,在尾部开口2~3 cm,去除内脏,用蒸馏水冲洗干净,于60 ℃水浴加热3 min(m刺参∶m水=1∶20),然后100 ℃加热10 min(m刺参∶m水=1∶20)。将处理后的刺参去头、尾,用刀片进行“十字”4 等分。将刺参置于真空干燥箱中,于60 ℃分别干燥0,4,6,8,11,14 h,依次标记为A,B,C,D,E,F 组。用高温蒸煮袋单独包装,置高压灭菌锅中121 ℃(0.2 MPa)处理15 min。高温高压处理完成后,于37 ℃贮藏30 d,期间取样分析。
1.3.2 菌落总数的测定 HSC 中菌落总数的测定依照GB4789.2-2016《食品安全国家标准 食品微生物学检验菌落总数测定》。
1.3.3 TPA 参数的测定 利用TMS-PRO 质构仪分析样品的硬度、弹性、黏聚性、咀嚼性、恢复性。样品测定时采用直径4 mm 圆柱型探头,下压速度50 mm/min,样品形变量70%,循环操作两次[9-10]。
1.3.4 水分含量的测定 HSC 中水分含量的测定依照恒温干燥法(GB5009.3-2010)[11]。
1.3.5 水分活度的测定 水分活度的测定使用HD-3A 智能水分活度测量仪。用剪刀将样品剪碎处理后置于仪器中测定,样品测定前用过夜放置的饱和NaCl 溶液进行仪器校正,室温下每个HSC样品的测量时间为15 min[12]。
1.3.6 SEM 图像的测定 将HSC 样品用刀片切成1 cm3的方形小块,浸泡在2.5%戊二醛溶液中,于4 ℃固定[13]。用梯度乙醇脱水后,使用临界点干燥法干燥,离子溅射喷金后扫描电子显微镜下观察和拍照。
1.3.7 TEM 图像的测定 HSC 样品处理及固定方式如1.3.6 节所示。包埋后用LKB 超显微仪切片(70 nm),醋酸铀酰和柠檬酸铅染色后在透射电子显微镜下观察和拍照[14]。
1.4 数据处理与统计分析
采用SPSS 19.0 软件处理数据;采用Origin 8.0 进行数据拟合和分析。
2 结果与分析
2.1 贮藏过程中菌落总数的变化
由表1 可知,在0~30 d 贮藏期间,不同湿含量HSC 组织中的菌落总数始终为0,表明HSC 在37 ℃贮藏过程中的结构变化不是由微生物和酶引起的。赵园园等[15]研究发现在类似的灭菌条件处理,仿刺参样品的菌落总数为0。在此基础上,本文分析非酶、非微生物条件下,HSC 体壁微观结构的变化。
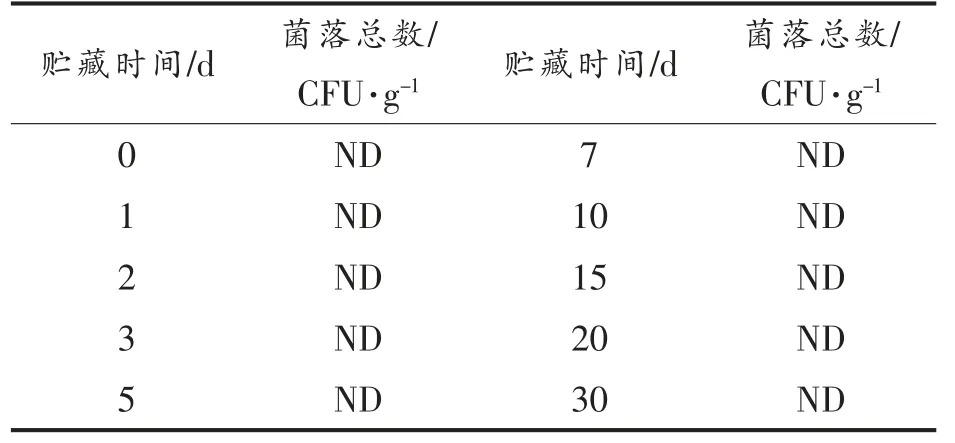
表1 湿含量差异的刺参组织在37 ℃贮藏过程中菌落总数的变化Table 1 Changes of total number of colonies of HSC with different humidity ratio at 37 ℃
2.2 贮藏过程中TPA 参数的变化
由图1a 和1b 可知,贮藏0 d 时,HSC 体壁的硬度和咀嚼性均随湿含量的减小而明显增大,原因可能是湿含量低的胶原纤维束形成逐渐致密的网状结构[16]。Zhang 等[8]研究了刺参组织在热处理8 h 过程中硬度和咀嚼性的变化情况,得出与本文类似的结论。
在37 ℃贮藏30 d 时,A~F 组的硬度和咀嚼性均呈逐渐减小的趋势,原因是HSC 的结构逐渐被破坏和降解[17],表明湿含量差异不能改变HSC 体壁组织劣化的趋势。一阶动力学方程:y=aebx已在组织劣化的动力学研究中被广泛应用[18-19]。本文在对37 ℃贮藏过程中不同湿含量HSC 的硬度和咀嚼性进行方程拟合时同样用此劣化模型[4],拟合结果见表2所示。通过计算半数衰减周期(T50),发现湿含量与硬度和咀嚼性的稳定性呈负相关。这表明湿含量是影响HSC 样品硬度和咀嚼性的重要因素,且湿含量与硬度和咀嚼性下降的速率呈正相关。
由图1c 和1d 可知,当湿含量大于75%时(A和B 组),弹性和黏聚性呈明显的下降趋势。当湿含量小于75%时(C~F 组),弹性和黏聚性呈规律性的变化。Zhang 等[8]研究了湿含量84.92%~62.49%的HSC 组织在37 ℃贮藏过程中弹性和黏聚性的变化规律,得出与本文类似的结论。
以上结果表明湿含量对HSC 质构特性的影响非常关键。为延长HSC 产品的货架期可采用减小湿含量的手段来显著性地减缓硬度与咀嚼性的下降速率。
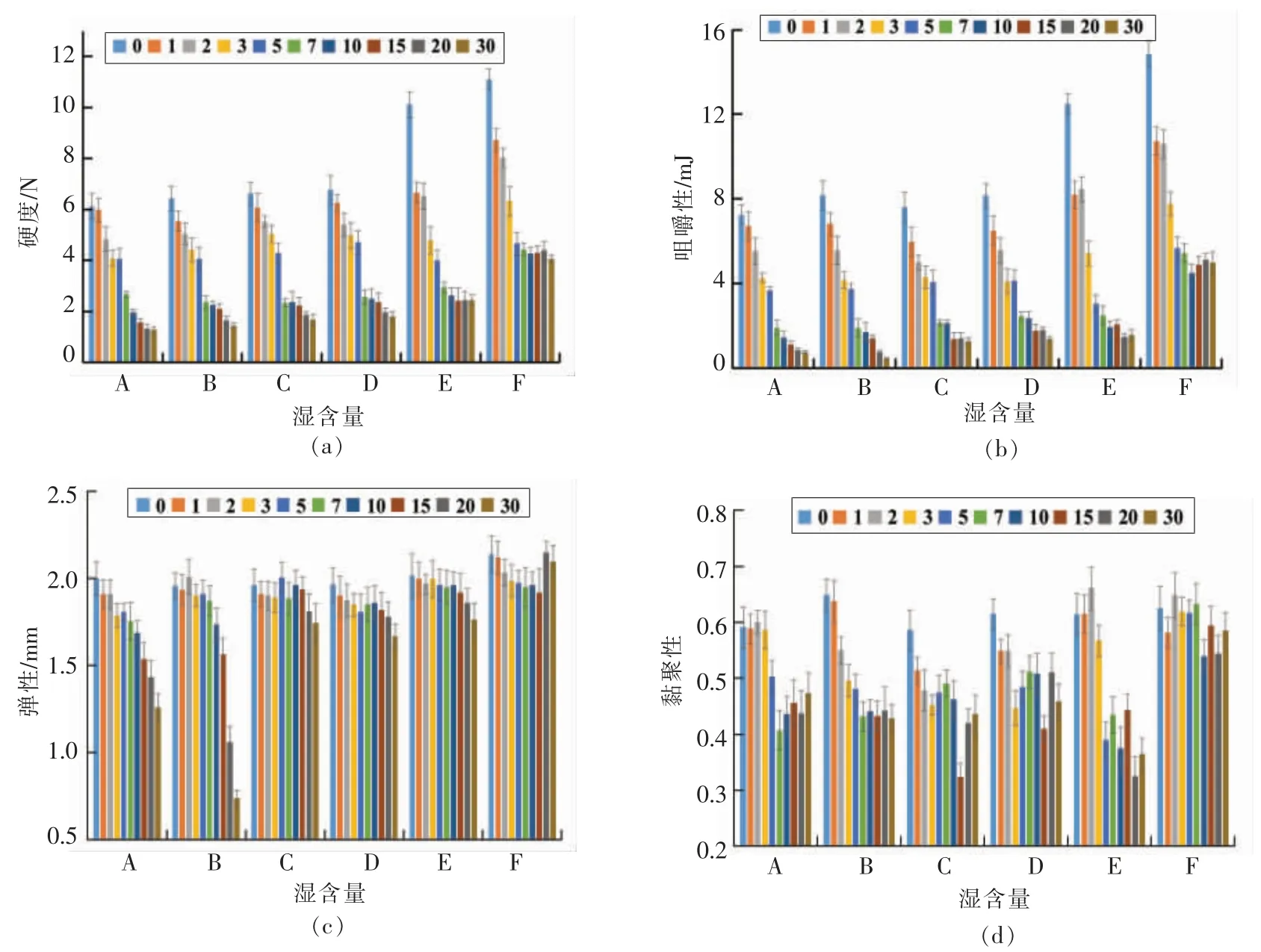
图1 湿含量差异的刺参组织37 ℃贮藏过程中TPA 参数的变化Fig.1 Changes of TPA parameters of HSC body wall with different humidity ratio at 37 ℃

表2 湿含量差异的刺参组织37 ℃贮藏过程中硬度和咀嚼性的拟合结果Table 2 The fitting results of the hardness and chewiness value of HSC with different humidity ratio at 37 ℃
2.3 贮藏过程中水分含量和水分活度的变化
由图2a 可知,成功制备了不同湿含量的HSC样品。当HSC 在真空条件下60 ℃干燥0~14 h,湿含量从78.64%减至50.48%。这可能是由于胶原纤维束发生热收缩,HSC 组织中的大量水分子流失到样品外。Zhang 等[8]将HSC 在相同条件下干燥0~8 h,制备湿含量从84.92%至62.49%的HSC 样品。在30 d 贮藏过程中,不同湿含量HSC 组织的水分含量均呈先增大后基本不变的趋势,这可能是因为存在于高温蒸煮袋中的样品由于高温高压处理失去的水分子在贮藏前期被HSC 重新回吸到胶原纤维束中[20]。Peng 等[4]研究了正常湿含量的HSC 组织在37 ℃贮藏过程中水分含量的变化情况,得到与本研究近似的结果。

图2 湿含量差异的刺参组织37 ℃贮藏过程中水分含量(a)和水分活度(b)的变化Fig.2 Changes of moisture content(a)and water activity(b)of HSC body wall with different humidity ratio at 37 ℃
水分子在HSC 样品中的存在状态可通过水分活度的变化来反映[21]。由图2b 可知,贮藏0 d时,水分活度随湿含量的减小而明显减小,原因是胶原纤维束发生热收缩,损失大量自由水。Zhang等[22]研究了刺参组织在热处理过程中水分活度的变化情况,得出类似的结论。在37 ℃贮藏30 d 过程中,湿含量差异的HSC 的水分活度均呈增大的趋势,原因是HSC 组织不断地从包装袋内吸收水分。另一方面,HSC 的组织结构逐渐劣化,部分机械水和结合水转化为自由水[23]。Zhang 等[8]研究了湿含量差异的HSC 组织在37 ℃贮藏过程中水分活度的变化情况,同样发现水分活度呈上升的趋势。
2.4 贮藏过程中SEM 图像的变化情况
由图3 可知,贮藏0 d 时,胶原纤维束的排列较为致密,且纤维束的直径较粗。随着湿含量的减小,胶原纤维束的直径均明显减小,并逐渐形成致密的网状结构。胶原纤维束直径的减少造成水分含量的显著性降低,而形成的致密网状结构导致硬度和咀嚼性显著性增大。
在37 ℃贮藏20 d 后,胶原纤维束发生大规模的断裂,从SEM 图像中观察到明显的孔状结构,这是导致硬度和咀嚼性显著性减小的关键因素。湿含量较高的组(A 和B 组)开始呈现多孔状结构,而较低的湿含量组(C~F 组)显著减小贮藏过程中HSC 体壁微观结构的破坏程度。
以上结果表明:在37 ℃贮藏过程中胶原纤维束的结构逐渐被破坏,其程度与HSC 样品的湿含量呈正相关,而湿含量差异并不能改变劣化的过程。Zhang 等[8]采用VG 染色法研究了37 ℃贮藏过程中湿含量差异的HSC 组织胶原纤维束结构的变化情况,胶原纤维束结构在贮藏过程中逐渐被破坏,其程度与湿含量呈正相关。赵园园等[15]研究了不同处理的HSC 组织37 ℃贮藏过程中组织结构的变化情况,也发现减小湿含量可以减小HSC体壁组织结构的被破坏程度。
2.5 贮藏过程中TEM 图像的变化
新鲜的仿刺参组织在透射电镜下呈明、暗相间的D-周期结构,这是胶原纤维最具代表性的特征,由胶原纤维内胶原分子的1/4 错位排列而引起[24]。由图4 可知,贮藏0 d 时,在TEM 图像中均未观察到标志性的D-周期结构,仅观察到条带状结构,表明胶原纤维束的结构已被破坏,胶原蛋白的三螺旋结构发生解螺旋[25]。随着湿含量的减小,条带状结构变得模糊不清,表明制备湿含量差异的HSC 组织过程中胶原纤维束的微观结构被破坏,其程度与热处理强度呈显著正相关。

图3 湿含量差异的刺参组织37 ℃贮藏时SEM 图像的变化Fig.3 Changes of SEM images of HSC with different humidity ratio at 37 ℃
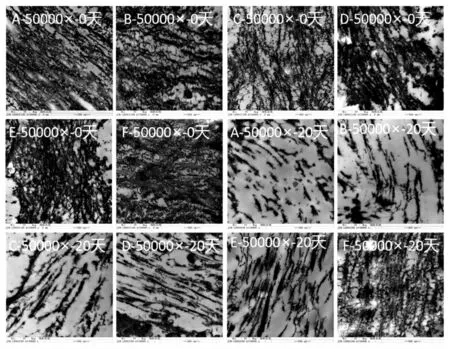
图4 湿含量差异的刺参组织37 ℃贮藏时TEM 图像的变化Fig.4 Changes of TEM images of HSC with different humidity ratio at 37 ℃
在37 ℃贮藏20 d 后,胶原纤维束的结构进一步断裂,胶原蛋白的三螺旋结构发生解螺旋和降解。湿含量较高的组(A 和B 组)出现明显的片段化结构,造成HSC 组织的水分活度较高,表明水分活度值与自降解的速率呈正比;而较低的湿含量组(C~F 组)可较好地维持条带状结构,说明降低湿含量可极大地减少HSC 体壁结构被破坏的程度。
以上结果表明在37 ℃贮藏过程中HSC 组织的结构发生明显的劣化,劣化速率与湿含量呈正相关,而湿含量差异不能改变劣化的过程。其原因可能是:水分子可作为质子传递的介质,对分子间肽键及其它化学键的转移起关键性的作用[26]。湿含量较高组的质子传递速率较快,组织结构被破坏的程度较大;而较低湿含量组显著抑制了质子传递的速率。
3 结论
湿含量差异的HSC 组织在37 ℃贮藏过程中,发生非酶、非微生物因素引起的劣化现象。微观结构的破坏程度与湿含量呈显著正相关,可通过减少湿含量而降低HSC 体壁结构的破坏程度,从而延长HSC 产品的货架期。

