基于人工智能术前预测乳腺导管内癌微浸润的价值
吴林永,赵羽佳,林鹏,李昕,杨红,何云*
1.广西医科大学第一附属医院超声科,广西南宁 530021;2.通用电气医疗保健公司,上海 210000;
乳腺导管内癌(ductal carcinomainsitu,DCIS)属于原位癌,局限于乳腺导管的基底膜内的上皮组织恶性增生,发病率占乳腺癌的20%~30%,10年生存率可达 88%[1-2]。乳腺导管内癌微浸润(ductal carcinomainsituwith microinvasion,DCIS-MI)是DCIS突破基底膜,且浸润灶最长直径<1 mm,发病率不足乳腺癌的 1%[3]。DCIS-MI的检出率随着影像技术的发展而升高[4]。DCIS-MI是DCIS向乳腺浸润性癌进展的中间阶段[5],较DCIS表现出更高的侵袭性生物学行为,与手术方案的选择、术后需辅助化疗以及患者预后较差密切相关[6-8]。
影像组学作为人工智能的子领域,将医学图像转换为高通量成像特征,并选择与肿瘤密切相关的特征,以建立基于影像组学特征的预测模型,提供准确的肿瘤表型分析信息和临床决策模型[9-10]。影像组学的步骤主要包括图像分割、特征提取、数据分组与标准化、特征选择、模型构建与评估。影像组学不仅将主观视觉的图像提取成客观的数据,并可提取到图像深处的肉眼无法观察到的信息[11]。
因此,本研究基于超声图像的影像组学特征构建术前预测DCIS-MI的鉴别模型,探索影像组学特征术前预测DCIS-MI的价值,为临床快速有效决策提供依据。
1 资料与方法
1.1 研究对象 回顾性分析2015年1月—2020年6月广西医科大学第一附属医院经外科手术或穿刺活检病理证实的400例DCIS占位性病变。纳入标准:①乳腺原发占位性病变;②经病理证实为DCIS或DCIS-MI;③病理证实前1个月内行超声检查。排除标准:①继发性或术后复发的DCIS或DCIS-MI;②病变超声图像分辨不清或存在边界争议;③病理证实前未行放疗、化疗、中药治疗等。最终纳入103例DCIS占位性病变,其中DCIS 80例,DCISMI 23例。
1.2 仪器与方法 采用迈瑞、百胜、GE、日立超声彩色多普勒诊断仪,探头频率7~14 MHz,扫查范围包括双侧乳腺及腋窝淋巴结,记录病灶的超声特征,包括部位、大小、形态、边界、内部回声、有无钙化、导管是否扩张、内部及周边血流分布等。选取病灶最大且清晰的图像导入 ITKSNAP 3.80软件(http://www.itksnap.org)。
1.3 图像分割 在ITKSNAP软件中,由1位具有5年超声诊断工作经验的主治医师沿病变边缘手工勾勒病变感兴趣区(ROI);并由1位具有10年超声诊断工作经验的副主任及以上医师对ROI再次确认。2位医师均采用盲法评估。若评估意见不同,则重新勾勒;若意见相同,则保存ROI图像并导入GE Intelligence Foundry 1.3软件用于后续分析。
1.4 特征提取 在Intelligence Foundry软件对5234项影像组学特征进行提取(图1E)。
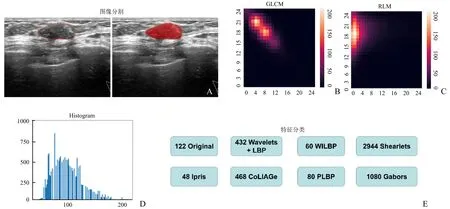
图1 特征提取量化过程。A.ROI的勾画;B~D.通过ROI分别提取灰度共生矩阵、游程长度矩阵和灰度直方图特征;E.上述特征经过小波转换等衍生的特征分类
1.5 数据分组和标准化 对生成的数据集按7∶3分成训练组和验证组[12]。最大最小值标准化方法采用线性化方法转换原始数据到[0,1]的范围,归一化公式为:y=(x-最小值)/(最大值-最小值)。该方法实现对原始数据的等比例缩放,其中 x、y分别为转换前后的值[13]。
1.6 特征选择 通过Spearman相关系数以0.95为阈值去除高相关性特征;再使用统计检验联合随机森林以1.25倍重要性均值为阈值的方法选择特征[14-15];最终选择的特征用于后续模型的构建。
1.7 模型构建和评估 本研究依据决策树机器学习算法(ID3算法)开发的代码,基于Python软件实现构建DCIS-MI的预测模型[16]。训练组用于构建预测模型,同时采用 5倍交叉验证方法,即训练组分为5份:4份用于训练,1份用于验证,将频率最优作为预测结果。独立的验证组用于验证预测模型的稳定性和可靠性。采用受试者工作特征(ROC)曲线及曲线下面积(AUC)、准确度、敏感度和特异度评估或验证模型的效能及可靠性,AUC越接近 1,效能越高。
1.8 诊断标准及结果判定 Ki-67以<14%和≥14%分为低表达和高表达[17]。雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人类表皮生长因子受体-2(human epidermal growth factor receptor 2,HER-2)均分为阴性及阳性,符合广西医科大学第一附属医院病理科免疫组化阳性标准。
1.9 统计学方法 应用SPSS 23.0软件,符合正态分布的计量资料以±s表示,组间比较采用t检验或校正t检验,不符合正态分布的计量资料采用 Mann-WhitneyU检验。计数资料组间比较采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 训练组与验证组临床资料比较 训练组纳入72例,其中DCIS 56例,DCIS-MI 16例;验证组纳入31例,其中DCIS 24例,DCIS-MI 7例。两组病灶大小差异有统计学意义(P<0.05),患者年龄、免疫组化指标(ER、PR、HER-2、Ki-67)和超声表现(形态、边界、回声、纵横比、钙化、病灶内及周边血流)组间差异均无统计学意义(P>0.05,表1)。
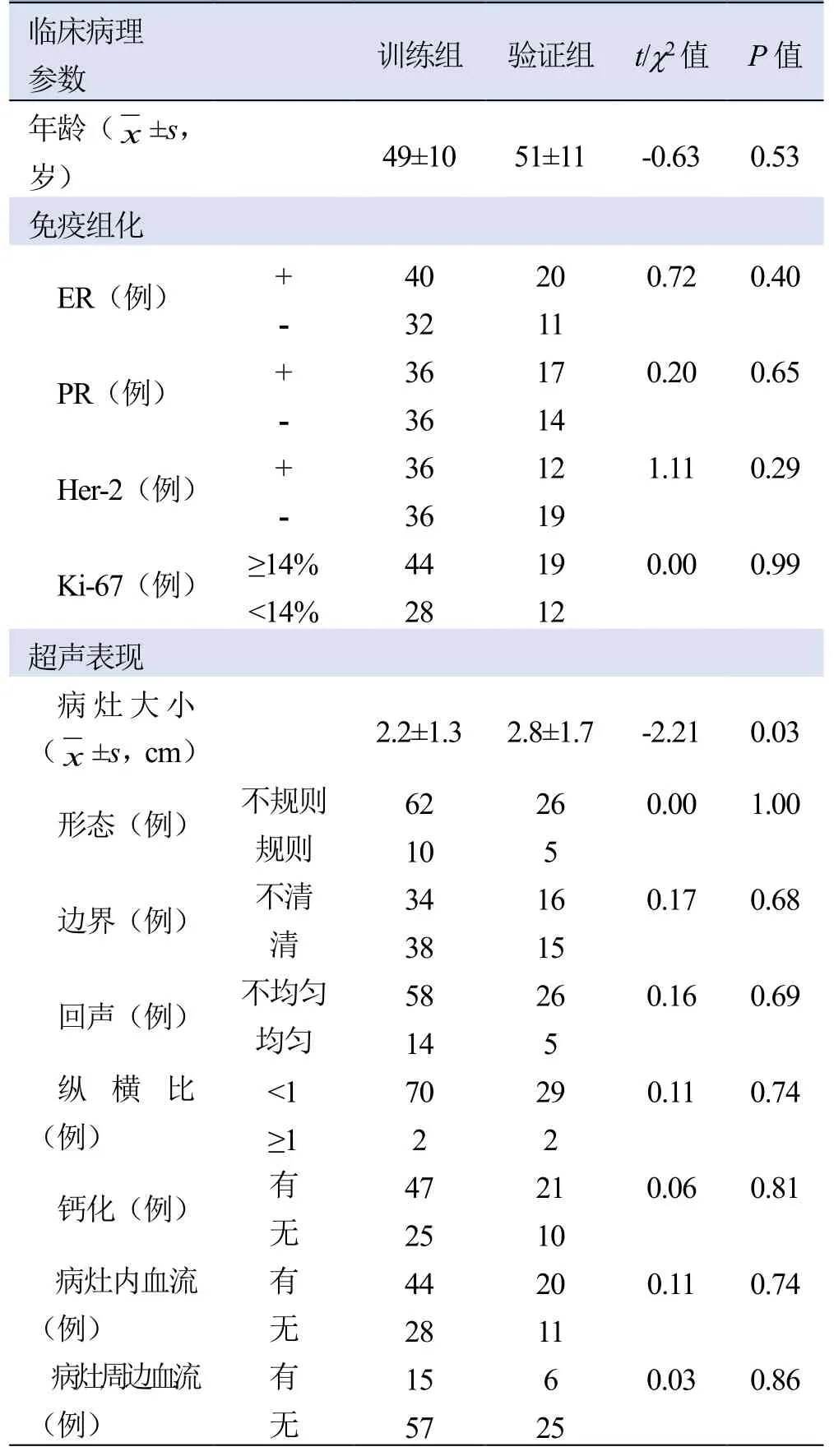
表1 训练组和验证组患者临床病理资料比较
2.2 特征选择 通过多种方法联合对特征进行降维,最终选择 27项特征用于后续预测模型构建(图 2、表2)。

图2 27项构建DCIS-MI预测模型的影像组学特征的热图。A为训练组热图,B为验证组热图
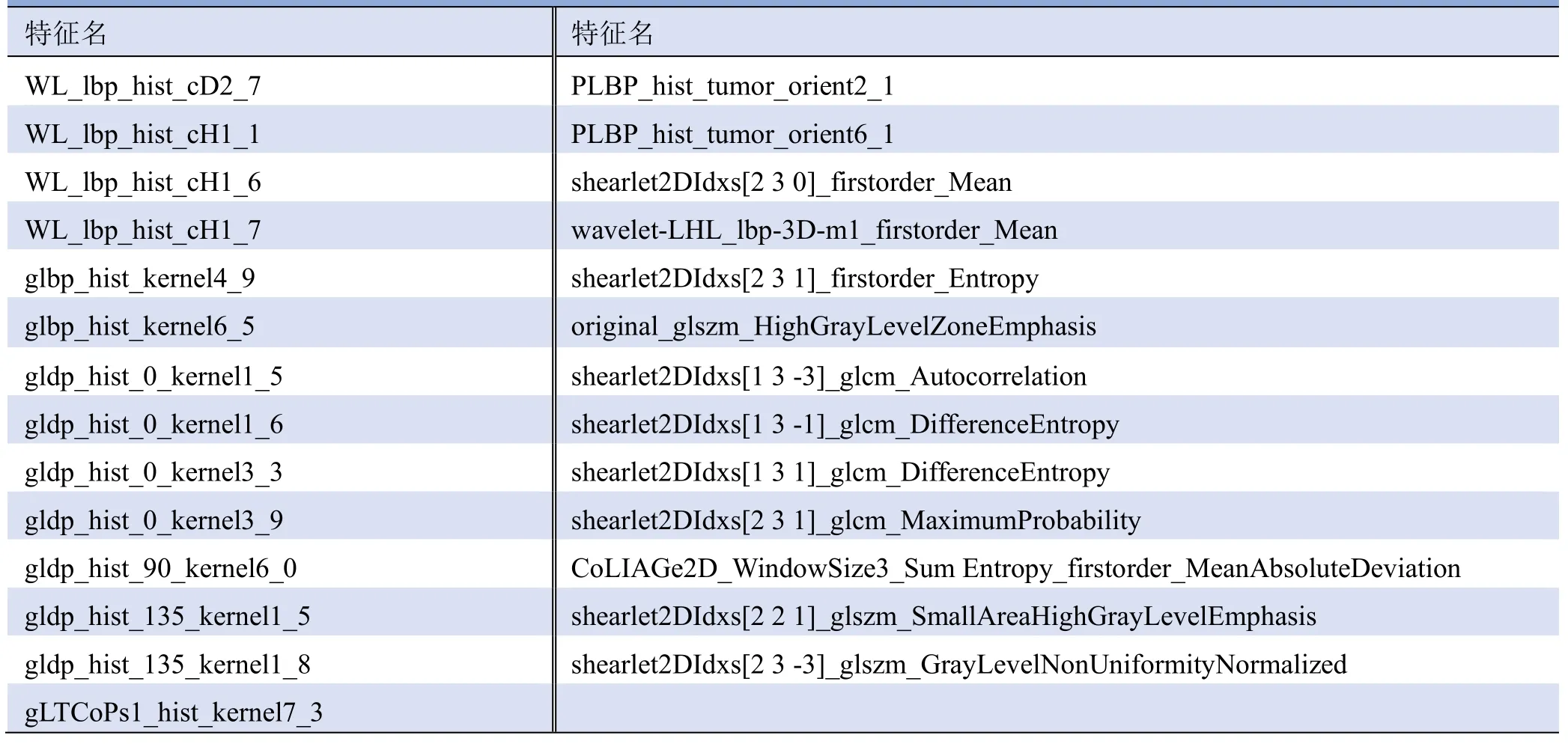
表2 构建DCIS-MI预测模型的27项影像组学特征
2.3 模型构建和评估 通过决策树机器学习算法构建模型,训练组和验证组预测模型的AUC分别为0.90(95%CI0.81~0.99)和0.73(95%CI0.51~0.95)(图3),准确度、敏感度及特异度分别为0.79、0.94、0.75和0.74、0.71、0.75。
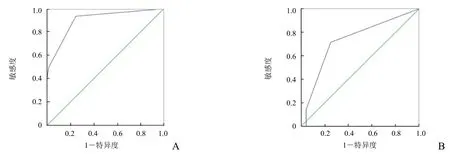
图3 训练组模型(A)与验证组模型(B)的ROC曲线
2.4 影像组学评分在不同临床病理参数亚组中的价值评估 通过不同亚组间比较,在ER(-/+)、病灶大小(<2.5 cm/≥2.5 cm)和病灶内钙化(无/有)亚组中,ER(-)、病灶大小(<2.5 cm)、病灶内钙化(无)亚组的AUC提示具有更高的诊断效能;而在PR(-/+)、HER-2(-/+)、Ki-67(低表达/高表达)和年龄(<55岁/≥55岁)亚组中,PR(+)、HER-2(+)、Ki-67高表达和年龄≥55岁亚组的AUC提示具有更高的诊断效能(表3)。
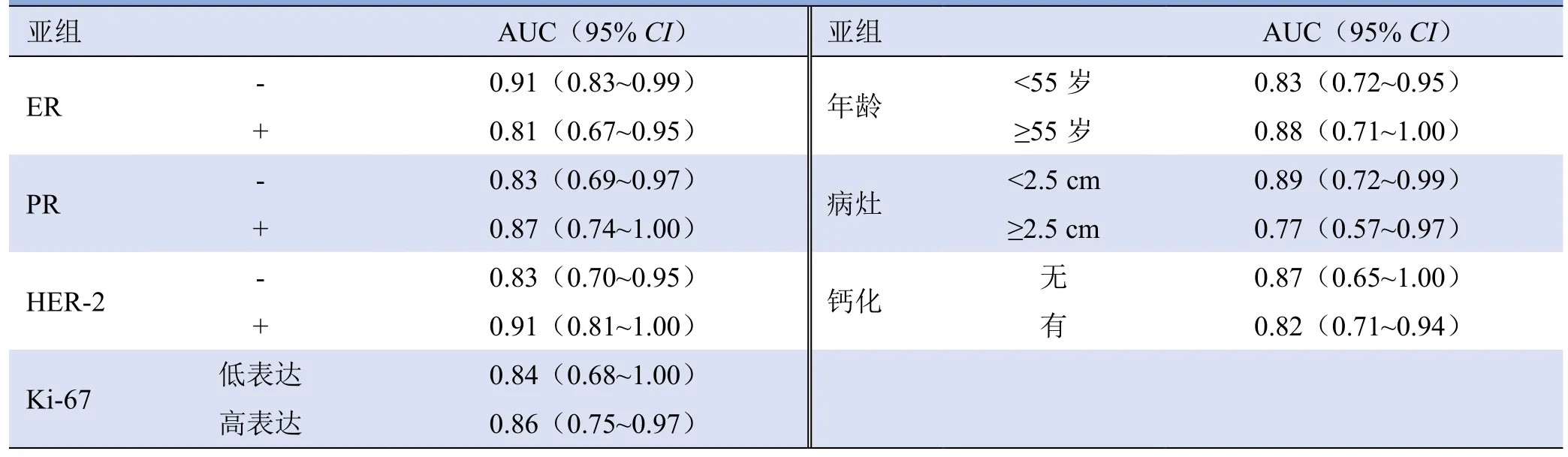
表3 影像组学评分在不同临床病理参数的分析
3 讨论
随着超声技术的发展,DCIS和DCIS-MI的检出率越来越高,并在临床和影像表现上具有一定程度的相似性[18-19],两者大多表现为形态多不规则,边界不清,多数纵横比<1,后方回声多无衰减,微小钙化多见,病灶内部和周边可见彩色血流。美国癌症联合委员会指出DCIS-MI病变是乳腺癌T1期的亚型之一,归为T1mic期管理[20]。陈擎等[21]报道,有恶性肿瘤家族史、未绝经的DCIS患者更容易发生微浸润。DCIS-MI较DCIS在临床上触及肿块的机会更大,比DCIS更容易出现淋巴血管浸润及腋窝淋巴结转移,预后较差[22-23]。《中国抗癌协会乳腺癌诊治指南与规范(2017年版)》建议在DCIS行乳房切除术时进行前哨淋巴结活检术[24],然而对于术前决定采用保乳手术的DCIS,评估微浸润对手术方案的选择仍有重要价值。DCIS-MI多在术前被诊断为DCIS,术后充分病理评估最终诊断[25]。
影像组学是人工智能应用于医学影像领域的热门学科,在一定程度上提高图像信息的利用度,可在更细微的层面进行疾病的鉴别诊断。影像组学主要利用各种机器学习算法,提取训练组具有意义的信息,通过对信息的深入解读优化,以产生对研究内容的准确预测。一个独立的数据集来验证模型的广泛性,并作为进一步优化模型的反馈[26]。影像组学已广泛应用于疾病的诊断、预后、生物学行为判断等。Liu等[27]根据MR图像提取的放射组学特征预测晚期直肠癌新辅助放化疗疗效,验证组的AUC达到0.98。Park等[28]基于术前 MRI图像开发影像组学模型,评估浸润性乳腺癌患者的无病生存期,在训练组和验证组中较高的影像组学评分与较差的 DFS显著相关。以上研究结果提示影像组学是鉴别乳腺病变和判断生物学行为的重要方法。
本研究基于超声图像,提取5234项影像组学特征,采用Spearman相关系数以0.95为阈值去除高相关性特征,经统计检验联合随机森林以1.25倍重要性均值为阈值的方法,选择27项特征用于预测模型构建。通过决策树机器学习算法构建预测模型。训练组和验证组预测模型AUC分别为0.90和0.73,且影像组学评分在不同临床病理参数亚组分析中同样具有良好的诊断效能,提示基于超声图像的影像组学特征术前预测DCIS-MI具有一定的价值。
本研究的局限性:①样本量较少,且是单中心研究;②ROI的手工勾画主观性较强;③本研究仅对病灶的最大层面进行研究,未对病灶整体进行研究。
总之,本研究基于超声图像的影像组学特征,构建术前 DCIS-MI的预测分类模型,经验证组验证具有良好的预测效能,可在一定程度上术前辅助诊断DCIS-MI,为临床快速有效决策提供依据。

