通过生物信息学分析鉴定干燥综合征的关键基因
郭俊恺 赵承磊 赵兴旺 王 娟 葛 兰 宋志强 游 弋
陆军军医大学第一附属医院皮肤科,重庆,400038
干燥综合征(Sjogren’s syndrome, SS)是一种慢性自身免疫性疾病,中年女性好发,发病率为0.1%~0.6%[1,2]。其临床表现可分为两类:外分泌腺表现和腺体外表现。外分泌腺主要累及泪腺和唾液腺,常引起眼、口干燥。腺体外可累及皮肤、关节、肺、胃、肾等脏器[3,4]。SS的病因目前尚不明确,可能与遗传和环境因素的复杂相互作用有关,目前认为SS与自身抗原Ro/SSA和La/SSB导致的异常免疫反应有关[5-7]。
随着高通量测序和微阵列技术的发展,生物信息学已用于筛选各种疾病中的差异表达基因(differentially expressed genes,DEGs)[8]。为了深入探讨SS的发病机制,本研究对基因数据库中下载的GSE23117和GSE127952的基因表达谱进行了分析,鉴定关键DEGs,分析它们在SS发病过程中的潜在途径,为研究SS的发生和发展提供一些新的思路。
1 材料与方法
1.1 芯片数据信息 从基因数据库(NCBI-GEO)(http://www.ncbi.nlm.nih.gov/geo/)获得GSE23117和GSE127952的基因表达谱。GSE23117的数据来自GPL570平台[Affymetrix Human Genome U133 Plus 2.0 Array]的芯片,用于研究SS和非SS患者不同炎症程度的小唾液腺的基因表达,我们分析其中10个SS小唾液腺标本和4个健康对照小唾液腺样本;GSE127952来自GPL20995平台[Agilent-019415 Human and Custom Viral Transcript Array 1.2]的芯片,用于研究SS患者和健康志愿者在小唾液腺中基因表达谱的差异,包括8个SS小唾液腺样本和6个健康对照小唾液腺样本。NCBI-GEO属于国际公共公开的基因表达数据库,用于帮助科研工作者们查询和下载实验以及精选的基因表达谱。
1.2 DEGs的数据提取 SS和健康对照腺体样本的DEGs均来自GEO2R网站,取|logFC|>2,P值<0.05。logFC>2的DEGs被视为上调基因,而logFC<-2的DEGs被视为下调基因。用Venn在线工具(http://bioinformatics.psb.ugent.be/webtools/Venn/)筛选出GSE23117和GSE127952中共同的上调和下调DEGs,并用Heml 1.0软件分别绘制GSE23117和GSE127952共同DEGs的热图。
1.3 PPI图谱和关键基因的获取 使用在线工具STRING (https://string-db.org/)用于评估PPI网络信息。然后通过下载Cytoscape软件研究DEGs之间的潜在关系,利用Cytoscape软件的MCODE(Degree Cutoff=2,Max. Depth=100, K-Core=2, Node Score cutoff=0.2)应用程序来获得关键的候选基因。最后应用David Gene(http://david.abcc.ncifcrf.gov)功能分类工具分析GO和KEGG途径。
2 结果
2.1 SS小唾液腺样本中DEGs的鉴定 在这项研究中,我们分别对GSE23117(10个SS小唾液腺样本和4个健康对照小唾液腺样本)和GSE127952(8个SS小唾液腺样本和6个健康对照小唾液腺样本)的数据集进行了分析。通过GEO2R在线工具,我们分别从GSE23117和GSE127952中提取了658和155个DEGs。利用Venn图分析了31个重叠的DEGs,这些重叠基因包括28个上调基因和3个下调基因,并用Heml 1.0软件绘制重叠DEGs热图(表1,图1、2)。
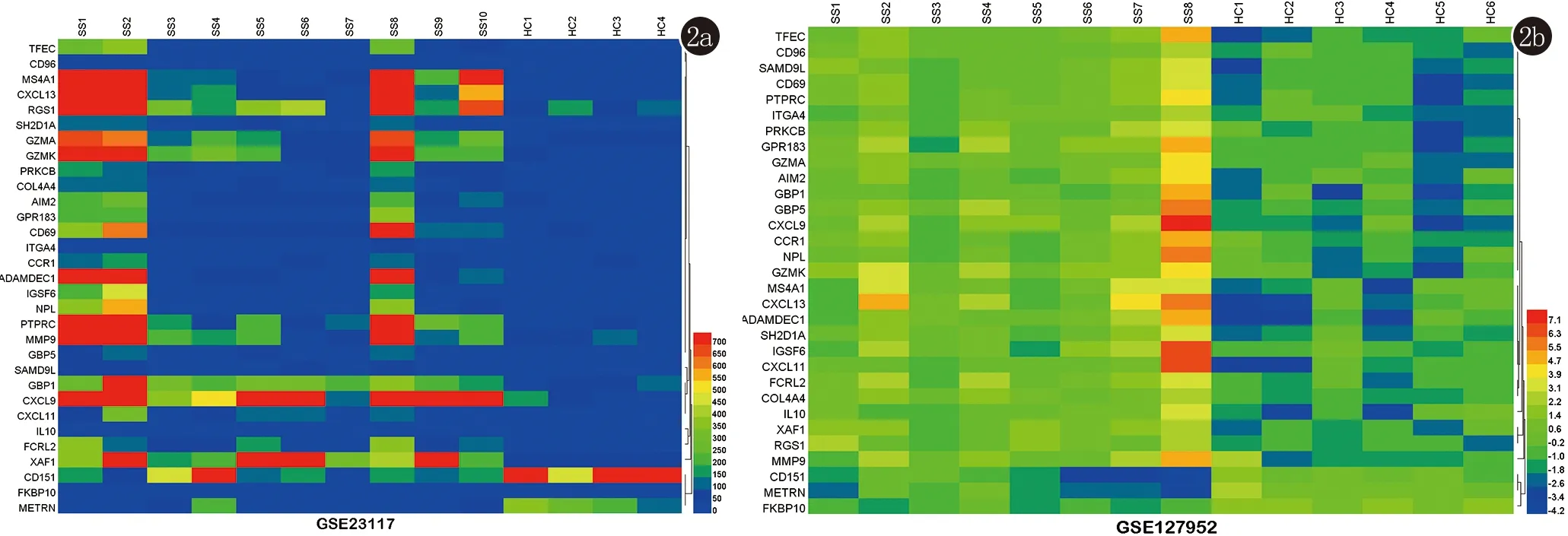
纵轴代表基因,横轴中SS为病例组,HC为对照组
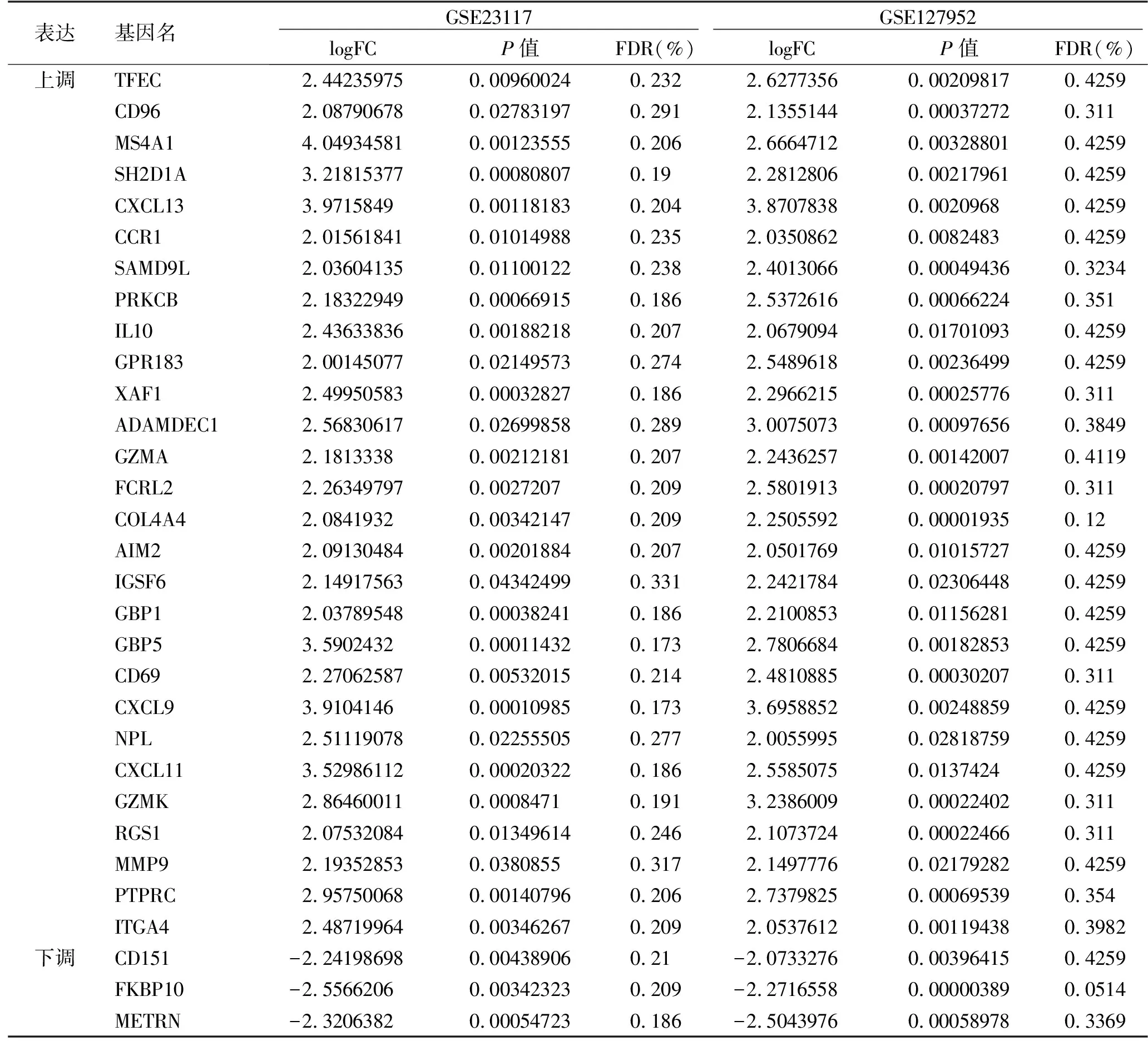
表1 重叠的DEGs
2.2 功能和途径的基因分析 使用David软件探索31个DEGs的功能和途径。功能分析的结果表明,在生物学过程(BP)中,上调的DEGs在炎症反应、免疫反应、脂多糖反应、白细胞趋化性正向调节、趋化因子介导的信号通路、细胞-细胞信号传导、cAMP代谢过程正向调节、cAMP介导的信号传递正向调节、细胞增殖调节和干扰素-γ负向调节中聚集。在细胞成分(CC)分析中,上调的DEGs聚集在质膜的外部和细胞外区域。在分子功能(MF)分析中,上调的DEGs在丝氨酸型内肽酶活性、趋化因子活性和CXCR趋化因子受体结合中富集(表2)。
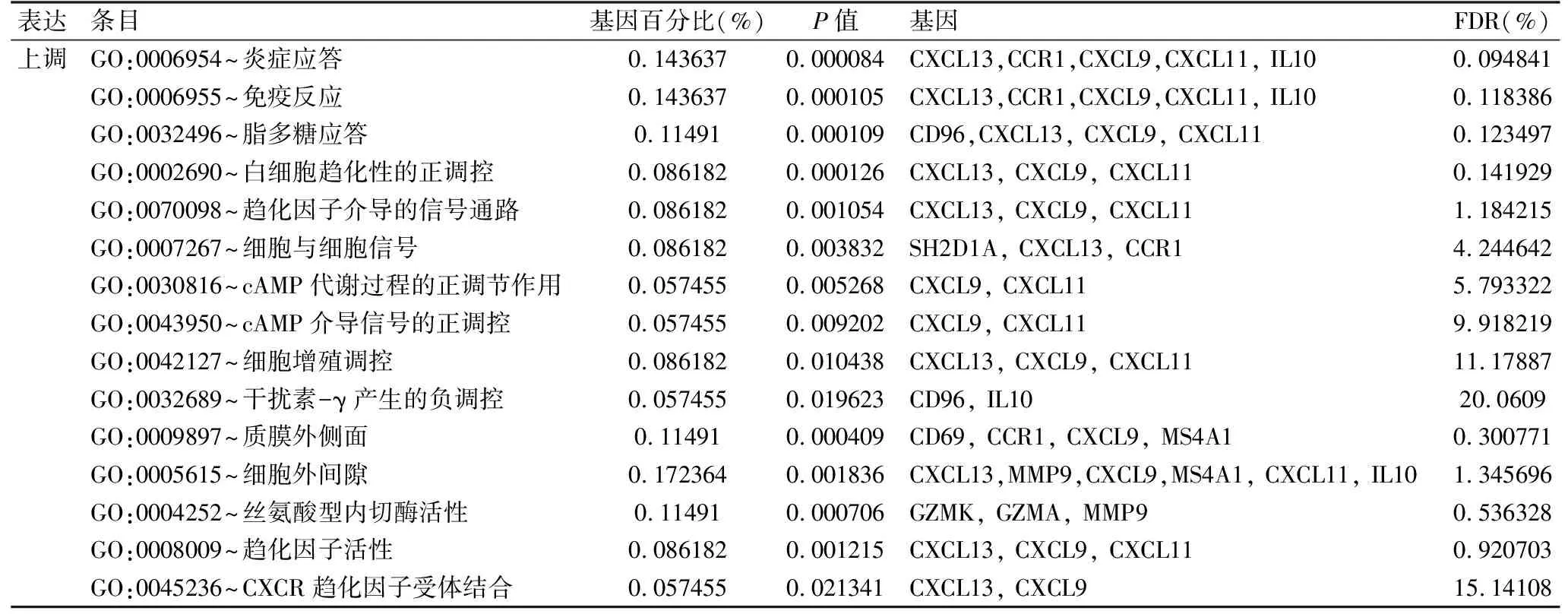
表2 干燥综合征功能的基因分析
2.3 KEGG分析的结果 分析结果提示在细胞因子-细胞因子受体相互作用,趋化因子信号传导途径,阿米巴病和白细胞跨内皮迁移等通路明显富集(表3)。
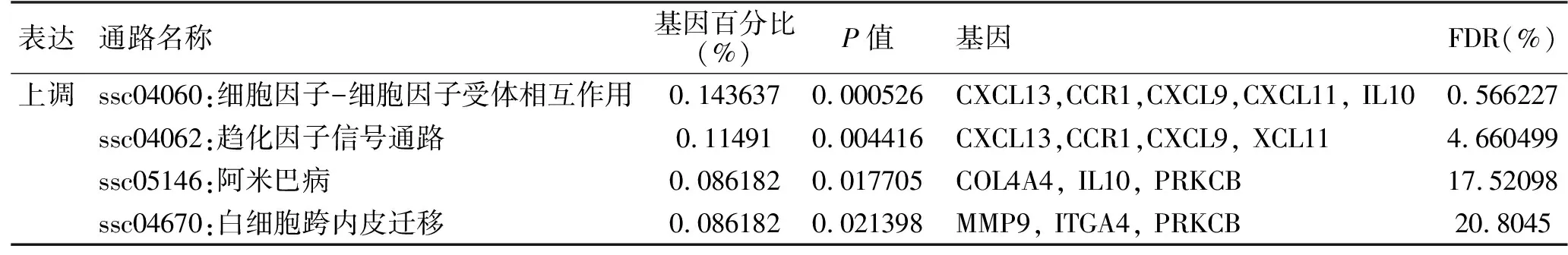
表3 干燥综合征差异表达基因的KEGG分析
2.4 PPI和模块化图片 建立DEGs的PPI网络(图3)。使用Cytoscape软件MCODE应用程序来显示9个中心节点(CXCL9,CXCL11,CXCL13,CCR1,CD69,PTPRC,GPR183,MMP9和IL10)的结果(图4)。
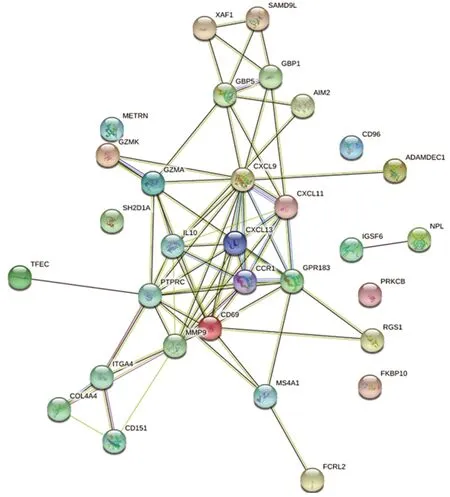
圆圈代表基因,线代表基因之间的PPI,圆圈内的结果代表蛋白质结构
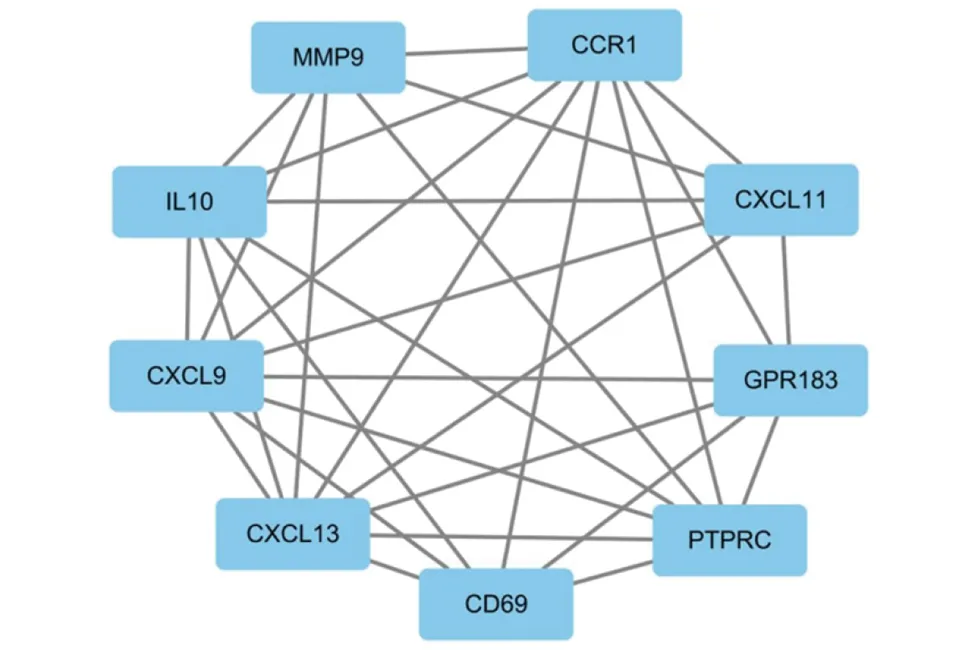
方块代表基因,结果显示9个关键基因
3 讨论
在本研究中,对BP的GO功能分析显示,上调的DEGs主要集中在炎症、免疫、对脂多糖(LPS)的反应、白细胞趋化性的正调节和趋化因子介导的信号通路等方面。SS是一种与炎症介质、细胞浸润密切相关的自身免疫性疾病[9]。既往研究中LPS刺激唾液细胞可上调TLR 4的表达和免疫调节分子的表达,这在SS的唾液腺炎症反应中起着重要的作用[10]。SS患者唾液中细胞因子/趋化因子的浓度明显高于对照组[11]。这与我们分析的结果类似。CC分析中,DEGs主要集中在细胞质膜外区域和细胞外间隙。MF分析中,丝氨酸型内肽酶活性、趋化因子活性和CXCR趋化因子受体结合中富集。KEGG分析提示DEGs通路与细胞因子-细胞因子受体相互作用、趋化因子信号通路、白细胞跨内皮迁移和阿米巴病有关。SS发病机制的研究表明,T淋巴细胞和B淋巴细胞对自身抗原的异常反应导致细胞因子和趋化因子水平升高,引起腺泡慢性炎症并最终导致其生理功能的丧失[7]。阿米巴滋养体可以诱导IL-10的产生[12]。IL-10的表达在抵抗阿米巴病侵袭的黏膜屏障中发挥重要的作用[13]。同时作为一种具有重要免疫调节功能的抗炎细胞因子,IL-10在SS患者的唾液腺中高表达,通过释放免疫介质和抗原呈递来抑制单核细胞和巨噬细胞的免疫功能[14,15]。
PPI和模块分析表明,CXCL9、CXCL11、CXCL13、CCR1、CD69、PTPRC、GPR183、MMP9和IL10基因显著富集。这9个关键基因主要可以分为三大类:一是细胞因子及趋化因子基因,包括IL10、CXCL9、CXCL11、CXCL13、CCR1。IL10作为重要的抗炎细胞因子,在自身免疫疾病的发生和发展中起着重要作用[16],IL-10的rs3024505变体是干燥综合征的易感等位基因[17]。CXCL9、CXCL11、CXCL13属于趋化因子配体家族,在SS患者唾液中浓度高出正常人,提示与唾液腺的大量淋巴细胞聚集密切相关[11]。CCR1是一种趋化因子受体,与细胞浸润、活化、组织损伤和炎症有关。SS患者B淋巴细胞中CCR1的表达上调,可能与B淋巴细胞的干扰素信号有关[18]。在KEGG分析中,我们发现IL10、CXCL9、CXCL11、CXCL13和CCR1主要参与细胞因子与胞嘧啶受体的相互作用和趋化因子信号通路,这可能提示趋化因子在SS中的异常表达使外分泌细胞浸润,导致外分泌腺功能障碍[19]。二是免疫相关基因,包括CD69,MMP9。CD69是II型跨膜糖蛋白,与其交联可产生细胞内信号传导及多种免疫反应,与血液系统疾病及免疫性相关疾病的发病机理有关。SS患者中活化的CD3/CD69T细胞百分比增加,在组织的炎性级联中起重要作用[20]。MMP9也称为明胶酶B,属于基质金属蛋白酶家族。MMP9基因被证明与自身免疫的病理生理过程有关[21]。MMP9的增加或许与唾液腺结构完整性的退化有关,导致唾液生成减少[22]。三是其它基因,包括PTPRC,GPR183。PTPRC的蛋白质产物是蛋白质酪氨酸磷酸酶(PTP)家族的成员,在细胞生长、分化、有丝分裂和致癌转化中起着重要作用[23]。PTPRC基因与SS有关,可能参与基因甲基化[24]。GPR183又称EB病毒诱导分子2(EBI 2),GPR183主要在B细胞中表达并诱导细胞迁移和增殖[25]。在SS患者腺上皮曾发现EB病毒颗粒,在SS患者血清中也发现过EB病毒抗体[26]。我们的研究一定程度上支持病毒感染可能是SS的激发因素。
综上所述,DEGs主要通过细胞因子-细胞因子受体相互作用、趋化因子信号通路等调控炎症、免疫参与SS的发病机制。我们推测筛选的9个关键DEGs在SS的发生和发展中起着重要作用,可能为研究SS的表面靶点和生物学机制提供一些新思路和方向。

