2型糖尿病患者红细胞变形能力改变与RBC能量代谢相关
孙明玥,李旭妍,萨如拉,李晶晶,梁 浩,闫朝丽*,苏 燕*
(1.包头医学院 生物化学与分子生物学教研室, 内蒙古 包头 014000;2.内蒙古医科大学第一附属医院 内分泌科,内蒙古 呼和浩特 010000; 3.包头医学院 2017级临床医学专业本科13班, 内蒙古 包头 014000)
糖尿病(diabetes mellitus,DM)作为一种慢性多发疾病逐渐成为全球关注的重点公共卫生问题。根据最新的流行病学调查,中国糖尿病发病率为10.3%,其中2型糖尿病(type 2 diabetes mellitus,T2DM)占90%左右[1]。T2DM是一类由于胰岛素生物作用受损引起的以慢性高血糖为特征的终身代谢性疾病。临床研究发现,糖尿病患者机体内紊乱的代谢环境引起红细胞(red blood cells,RBCs)形态改变和变形能力降低,这是引发血液微循环障碍的重要原因,也是糖尿病微血管并发症发生发展的重要病理基础[2]。其中红细胞变形能力(red cell deformability,RCD)的改变对微血管并发症的发生发展起到关键性作用。RCD与细胞内能量代谢密切相关,能量代谢是决定RBCs结构和功能的关键因素[3]。以往的研究中,关于糖尿病患者红细胞能量代谢改变的报道各不相同[4-5]。针对红细胞糖酵解反应及关键酶活性改变的论文更是少之又少。因此,本研究拟通过对比T2DM患者和健康人的RCD及红细胞能量代谢之间的不同,检测观察临床糖尿病患者红细胞中的关键酶活性和ATP含量的改变,以及红细胞能量代谢的改变是否与糖尿病患者红细胞变形能力受损相关,明确糖尿病患者红细胞能量代谢的改变及其与红细胞变形能力受损的相关性,为糖尿病及其并发症发生发展的治疗和预防提供新的思路。
1 材料与方法
1.1 材料
1.1.1 研究对象:本研究由包头医学院伦理委员会审核批准(包医伦审2018第1024号),选取内蒙古医科大学第一附属医院内分泌科2018年5月至2019年7月住院的T2DM患者80例为病例组,同期在包头医学院第一附属医院体检的健康人50例为对照组,采集血液前均与研究对象签署知情同意书。
1)入组标准:选择对象年龄40~70岁,男女各半。病例组符合1999年WHO 2型糖尿病诊断标准;对照组:经系统询问病史、体格检查、空腹血糖、餐后两小时血糖、肾功能等理化检查均正常的体检者。
2)排除标准:a.其他类型糖尿病;b.合并恶性肿瘤、放疗以及器官移植、化疗,有血液系统疾病及结缔组织病史;c.近3 个月合并严重心脑血管、肝、肾或其他严重原发性疾病;d.近1个月合并糖尿病酮症酸中毒等急性代谢紊乱及合并感染者;e.资料不全者。
1.1.2 实验试剂:ATP检测试剂盒(S0027)、ROS检测试剂盒(s0033,碧云天生物技术公司);Hexokinase Activity Assay试剂盒(ab136957)、Pyruvate Activity Assay试剂盒(ab83432,Abcam公司);PBS缓冲液(p854529-10EA,麦克林生化科技有限公司);0.9%氯化钠注射液,其他化学试剂均为国产分析纯。
1.2 研究方法
1.2.1 临床资料收集:记录研究对象一般资料及病历信息,包括姓名、性别、身高、体质量、BMI及血常规、血流变、血液生化、尿常规等临床检测结果。
1.2.2 血液采集与处理:清晨采集空腹8 h以上的静脉血5 mL,肝素抗凝。2 000 r/min离心5 min,分离去掉血浆和白细胞,加入PBS缓冲液洗3遍得到RBC备用。
1.2.3 ATP浓度的检测:取红细胞10 μL,用ATP检测试剂盒利用多功能酶标仪测定RBCs内ATP水平的变化。
1.2.4 HK活性的检测:取红细胞20 μL,采用Hexokinase Activity Assay试剂盒利用多功能酶标仪检测RBCs内HK的活性。
1.2.5 PK活性的检测:取红细胞20 μL,采用Pyruvatekinase Activity Assay试剂盒利用多功能酶标仪检测RBCs内PK的活性。
1.2.6 ROS的检测:取红细胞1μL,采ROS检测试剂盒利用流式细胞仪检测RBCs内ROS水平。
1.3 统计学分析
2 结果
2.1 两组间一般资料比较
T2DM组的BMI值、DBP、SBP高于对照组(P<0.05)。
2.2 两组间RCD指标RCD指标、RDW及MCV的比较
与对照组相比,T2DM组IR值与TK值增高,(P<0.05);T2DM组与对照组相比,T2DM的RDW值、MCV值增高(P<0.05)(表1)。
2.3 T2DM组RCD改变与各指标相关性分析
IR与ATP、HK及PK呈负相关(P<0.05);TK与 ATP及HK值呈负相关(P<0.05);ATP与PK呈正相关(P<0.05)(表2)。
2.4 两组间RBC能量代谢比较
与对照组相比,T2DM组RBCs内ATP含量及PK活性增高,而HK活性降低(P<0.05)(表3)。
2.5 T2DM患者HbA1c分组中RCD指标、RBC能量代谢及ROS比较
与A组相比,C组TK值增高(P<0.05);与A组相比,C组的ATP、PK及HK增高(P<0.05);与A组相比,C组的ROS增高(P<0.05)(表4)。
3 讨论
在血液循环尤其是微循环中,良好的RCD可以保证RBCs自由穿过微血管系统、毛细血管及小于其自身直径的血管,并随后向身体组织输送氧气是至关重要的[6]。本研究中采用了临床最常用的血流变检测结果中的红细胞变形指数、刚性指数,评价红细胞变形能力。随着红细胞变形能力的降低,TK及IR值会随之增高。本研究结果可以看出,T2DM组IR及TK值都高于对照组,说明T2DM组RCD降低。这一结果与报道一致[7-8]。在本研究中,糖尿病患者体内循环RBCs的RDW和平均体积均增加,呈异常状态。那么导致糖尿病患者RCD降低的因素是什么?为此,本研究中针对RCD做了相关性分析。结果分析可见,TK值、IR值与ATP含量、HK活性和PK活性均呈负相关,与HbA1c呈正相关。说明糖尿病长期的高血糖则可能会直接损伤RCD,这也与国内外研究结果一致[9-10]。而RBCs内的ATP含量、HK活性和PK活性对维持RCD起关键作用。
表1 T2DM组与对照组间RCD指标、RDW及MCV比较Table 1 Comparison of RCD, RDW and MCV between T2DM and
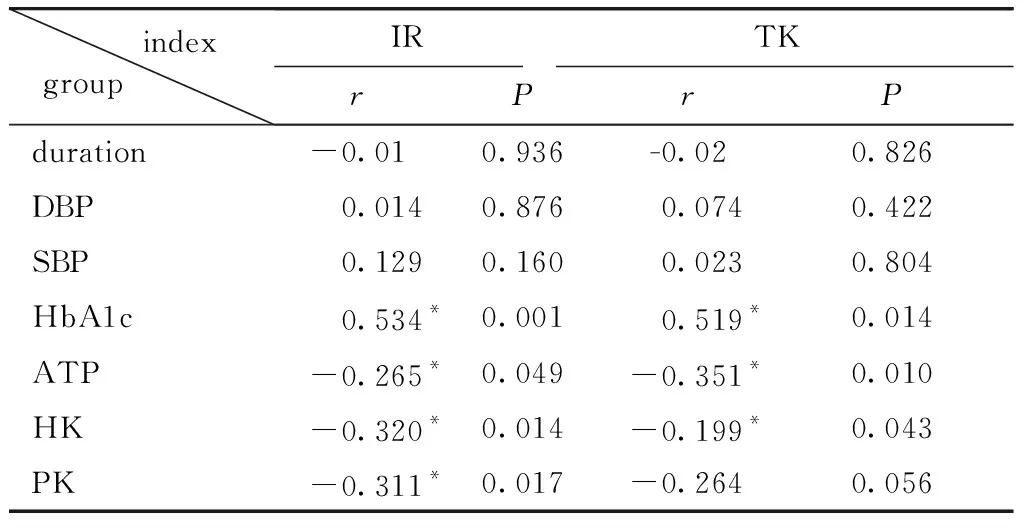
表2 T2DM组RCD改变与各指标相关性分析
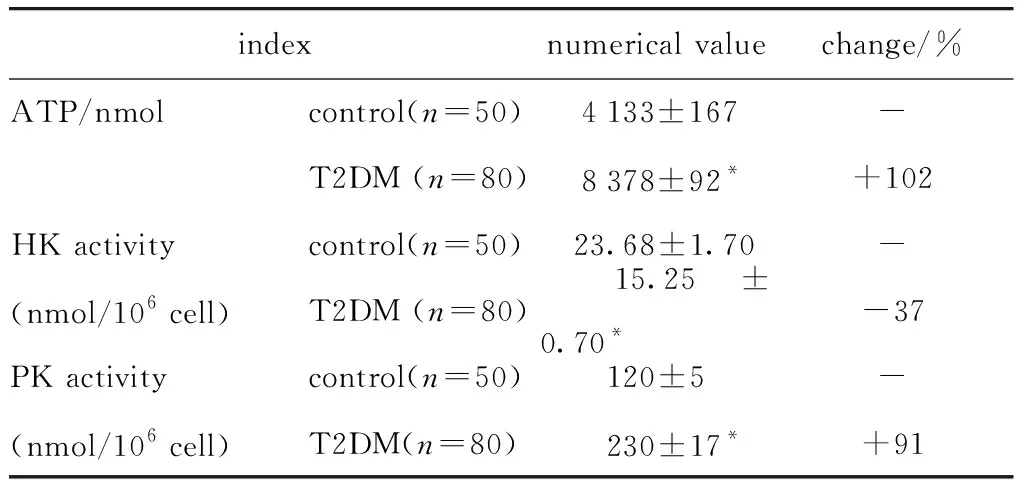
表3 T2DM组红细胞糖酵解关键酶活性及ATP含量的改变

表4 T2DM患者HbA1c分组中RCD指标、RBC能量代谢及ROS比较Table 4 Comparison of RCD index, RBC energy metabolism and ROS in HbA1c group of T2DM
本研究结果中,T2DM组RBCs内ATP含量与对照组相比增高了约一倍,说明T2DM组RBCs内的糖酵解反应比对照组旺盛。T2DM组RBCs内PK活性与对照组相比增高约91%,但HK活性较对照组降低37%。这说明T2DM组RBCs糖酵解反应可以正常发生,甚至可能会比正常细胞内反应旺盛。本研究结果中,糖尿病患者HK活性与PK活性的变化规律不同,糖尿病患者HK活性明显低于对照组,下降约40%,这与RBCs内ATP生成增多的趋势相矛盾。另外,有研究发现糖尿病患者HK活性增高[9-10]。从本研究检测结果可以看出HK的活性不论在正常人还是患者都非常低,是PK的10%左右。作为糖酵解反应中的限速酶,HK本身活性低,且只降低了40%,但此时红细胞内葡萄糖的含量却增高一倍,因此HK活性的有限降低可能并没有真正有效降低进入糖酵解的葡萄糖数量,增高的葡萄糖激活了PK的反应效率,使得ATP含量成倍增高。另一方面,RBCs内HK的正常活性状态下,进入糖酵解反应中的葡萄糖数量可能是充足状态,PK正常活性无法完全消耗这部分葡萄糖,在糖尿病患者体内,PK受某些机制影响后活性增高,使过剩的葡萄糖也加入了反应中,ATP生成增高。所以,PK活性的改变可能才是决定红细胞ATP产量的主要原因。此外不同研究团队所采集的病例和对照的来源和标准不同、病例纳入数量不同、检测方法不同等原因也可能导致实验结果的不一致。
本研究按HbA1c水平将T2DM组分成血糖高中、低3组。结果显示,随HbA1c水平增高IR值、TK值及ROS浓度均呈增高趋势,说明RCD随血糖的升高而受损严重,可能与氧化应激增高相关。随HbA1c增高,ATP含量、HK活性及PK活性均呈增高趋势。说明在糖尿病患者体内,当高糖达到某一水平状态下,反而会进一步增加RBC内的糖酵解关键酶活性,进而降低进入红细胞的葡萄糖,同时生成更多ATP以供RBC变形所需。那为何糖尿病患者RBC内糖酵解反应旺盛,产能增加,也并没有改善和扭转糖尿病患者RCD降低的趋势呢?本研究分析这可能是由于长期高糖环境下,RBCs机能已经处于“超负荷”状态,在RBCs行使变形能力中起关键作用的膜蛋白和相关酶的功能已经受损,因此虽然细胞内产生了高水平的ATP,但已经无法使受损的“引擎”正常运转,导致T2DM患者RCD进一步降低。
综上所述,本研究发现糖尿病患者RCD受损与HbA1c密切相关,RBC能量代谢对维持RCD起重要作用。糖尿病红细胞ATP产量增加,PK活性增高,能量代谢反应旺盛,但这并没有改善由于高糖引起的RCD降低状态。

