C1orf194基因Ile122Asn突变致腓骨肌萎缩症的病理机制
陈诗恺,陈韭铭,孙顺昌
(上海交通大学医学院附属瑞金医院北院 检验科,上海 201801)
腓骨肌萎缩症是由法国学者及英国学者于1886年同时报道,故称Charcot-Marie-Tooth(CMT)病。CMT是一组临床和遗传均具异质性的遗传性周围神经病,发病率约为1/2 500[1]。目前已发现的CMT依据遗传模式和神经病理特征分为7类40多型[2]。CMT首发临床表现一般为远端肌无力和肌萎缩,进而引起运动障碍。CMT诊断主要依据临床表现、神经电生理检查及家系资料分析等,其分型主要依据遗传模式和神经病理特征。1号染色体开放读码框194(chromosome 1 open reading frame 194, C1orf194)基因编码产物为169个氨基酸的c1orf194蛋白,其分子质量约为19.35 ku。前期研究发现C1orf194基因突变可导致常染色体显性遗传CMT,其发病机制与葡萄糖调节蛋白75(glucose-regulated protein 75, GRP75)介导的线粒体-内质网间Ca2+流相关,c1orf194蛋白突变体阻断了线粒体-内质网间Ca2+流,导致患者表现为CMT,但具体机制仍不清楚[3]。本研究拟通过蛋白相互作用分析探讨C1orf194基因Ile122Asn突变致CMT机制。
1 材料与方法
1.1 材料
DMEM培养基、0.25%胰蛋白酶、胎牛血清(Hyclone公司);稳定同位素标记氨基酸(stable isotope labeling with amino acids in cell culture, SILAC) DMEM(Life Technologies公司);抗flag M2磁珠、抗flag M2抗体、抗flag tag鼠源单抗及Polybrene试剂(Sigma-Aldrich公司);pCDNA3.1-myc-C和pCDNA3.1-flag-C质粒(Invitrogen公司);pLL3.7-CMV-IRES-puro质粒、pMDLg/pRRE质粒、pVSV-G质粒及pRSV-Rev质粒(广州辉骏生物技术公司);Strep-Tactin琼脂糖珠、抗鼠IgG抗体(美国GE Healthcare公司);引物、BamHⅠ、XhoⅠ、HindⅢ及ApaⅠ核酸内切酶(生工生物有限公司);PCR扩增试剂(Promega公司);PolyFect转染试剂(QIAGEN公司);人神经母细胞瘤细胞系(SH-SY5Y)细胞和人胚胎肾上皮细胞系HEK-293T(中国科学院典型培养物保藏委员会细胞库)。
1.2 方法
1.2.1 表达载体的构建:通过PCR克隆方法构建表达载体,使用引物C1orf194-F:5′-AGAGAATTCG GATCCATGCCTCCCACCCGGGACC-3′和C1orf194-R:5′-CTTCCATGGCTCGAGCTAGGTGGAGAAGAAG CCACC-3′分别扩增正常和携带Ile122Asn突变的人cDNA模板(实验室自备),再用BamHⅠ和XhoⅠ核酸内切酶双切扩增产物及pLL3.7-CMV-IRES-puro质粒,然后连接成表达野生和携带Ile122Asn突变的pLL3.7-CMV-C1orf194W-IRES-puro和pLL3.7-CMV-C1orf194M-IRES-puro表达载体。
1.2.2 蛋白的表达及鉴定:将HEK-293T细胞接种于6孔细胞培养板上,接种密度为4×105个/孔,再将pLL3.7-CMV-C1orf194W-IRES-puro和pLL3.7-CMV-C1orf194M-IRES-puro表达载体在转染试剂PolyFect作用下,依据说明书分别与pMDLg/pRRE质粒、pVSV-G质粒、pRSV-Rev质粒共转染6孔板中HEK-293T细胞,转染30 h后更换新鲜培养液,继续于32 ℃培养42 h,1 500 r/min离心5 min收集上清液,最后经45 μm孔径膜过滤,收集组装的慢病毒颗粒。将收集的慢病毒颗粒,在8 μg/mL的Polybrene作用下转染6孔板中SH-SY5Y细胞,32 ℃培养24 h,使慢病毒感染SH-SY5Y细胞。感染后的SH-SY5Y细胞继续培养72 h,收集细胞并洗涤细胞,用细胞裂解液(50 mmol/L Tris-HCl,pH 7.4,14 mmol/L β-巯基乙醇,250 mmol/L蔗糖,1 mmol/L钒酸钠,10 mmol/L氟化钠,10 μg/mL亮抑酶肽,0.2 mmol/L苯甲基磺酰氟,1%曲拉通)裂解细胞,通过4%~10%梯度SDS-聚丙烯酰胺凝胶电泳分离蛋白,分离后的蛋白通过电转移到聚偏氟乙烯膜上。使用抗flag M2抗体和抗flag tag 鼠源二抗进行蛋白条带显影。
1.2.3 相互作用蛋白的筛选:将慢病毒感染的SH-SY5Y细胞在冰浴中裂解30 min,然后于12 000 r/min离心15 min,使用抗flag M2抗体结合的磁珠免疫沉淀带有flag-标记的c1orf194蛋白。使用细胞裂解液洗涤磁珠3次,洗脱的蛋白溶液通过胰蛋白酶消化,作为液相质谱上样品。使用MaxQuant软件(1.3.0.5版)计算质谱仪获得的数据,质谱数据通过TPP’s ProteinProphet检索UniProtKB人类蛋白质数据库(2019年10月15日版;20365条目),比对上的蛋白质上传到Ingenuity在线路径分析软件进行路径分析,以搜寻c1orf194蛋白候选相互作用蛋白可能参与的功能网络。
1.2.4 相互作用蛋白的验证:对可能性较大的候选相互作用蛋白通过免疫印迹进行验证。验证方法如下。先通过核酸内切酶HindⅢ和ApaⅠ酶切pCDNA3.1-myc-C质粒构建捕获蛋白表达载体。通过酶切pCDNA3.1-flag-C质粒和上述构建的野生C1orf194基因和携带Ile122Asn突变的C1orf194基因,构建诱饵蛋白表达载体。在polyethylenimine作用下,将捕获蛋白表达载体和诱饵蛋白表达载体共转染SH-SY5Y细胞,培养5 h后更换培养液培养48 h,收获细胞。用冰预冷的磷酸盐缓冲液洗涤收获SH-SY5Y细胞3次,再用含蛋白酶和磷酸酶抑制剂的Nonidet P40细胞裂解液裂解SH-SY5Y细胞。细胞裂解液于12 000 r/min离心15 min,取上清液-80 ℃保存备用。用抗flag抗体标记的磁珠与标记诱饵蛋白的c1orf194蛋白或携带Ile122Asn突变的c1orf194蛋白于4 ℃作用过夜,用裂解液洗涤磁珠3次,再用含β-巯基乙醇的3×标本缓冲液洗脱磁珠上的蛋白,洗脱的蛋白上样于5%~10%梯度的SDS-聚丙烯酰胺凝胶电泳分离蛋白,分离后的蛋白通过电转移到聚偏氟乙烯膜上,然后用抗myc抗体和抗flag抗体与膜上蛋白杂交,最后通过辣根过氧化物酶标记的二抗显色。
2 结果
2.1 候选相互作用的蛋白
野生C1orf194基因和携带Ile122Asn突变的C1orf194基因在SH-SY5Y细胞内均成功表达,携带Ile122Asn突变的C1orf194基因表达产物明显高于野生C1orf194基因(图1)。质谱分析在野生c1orf194蛋白池中检测240种蛋白,在携带Ile122Asn突变的c1orf194蛋白池中检测到20种蛋白。在野生c1orf194蛋白池中的240种蛋白的功能饼图如图2。在野生c1orf194蛋白拉下的240种蛋白中,43.15%蛋白参与体内压力反应,其次是信号传导、生物合成、解剖结构发育、氮类分子代谢等。分子功能分析显示这些蛋白主要功能为结合酶、离子、肽酶、细胞骨架蛋白,或作为结构分子(图3)。在含240种蛋白的野生c1orf194蛋白拉下池中共发现32种可能与野生c1orf194蛋白相互作用的蛋白(表1)。在含20种蛋白的突变c1orf194蛋白拉下池中,仅发现THSD1和EIF4A1等2种可能与突变c1orf194蛋白存在相互作用的蛋白。
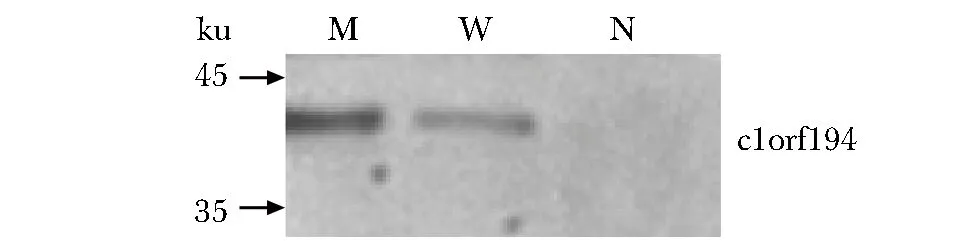
M.SH-SY5Y cells infected with plasmids encoding a fusion protein of mutation p.I122N c1orf194; W.SH-SY5Y cells infected with plasmids encoding a fusion protein of wild c1orf194; N.SH-SY5Y cells infected with negative control plasmids图1 SH-SY5Y细胞中c1orf194蛋白表达Fig 1 Expression of c1orf194 protein in SH-SY5Y cells

表1 SH-SY5Y细胞中可能与野生c1orf194蛋白相互作用的蛋白
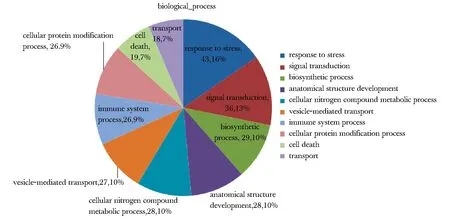
图2 SH-SY5Y细胞中与野生c1orf194蛋白可能存在相互作用蛋白的聚类分析Fig 2 Analysis of relative proportion of candidate c1orf194-interacting proteins and functional classes in SH-SY5Y cells

Lines connecting the proteins indicate molecular relationships; there are two line styles; thick lines indicate direct interactions and thin lines indicate indirect interactions图3 SH-SY5Y细胞中与野生c1orf194蛋白可能存在相互作用蛋白的分子功能分析Fig 3 Pathway analysis of proteins associated with candidate c1orf194-interacting proteins in SH-SY5Y cells
2.2 相互作用蛋白的验证
免疫印迹结果显示在高表达野生c1orf194蛋白的SH-SY5Y 细胞中,通过诱饵蛋白拉下了微管蛋白α1链(tubulin alpha 1 chain, TBA1C)、α1抗糜蛋白酶(alpha1-antichymotrypsin, AACT)及热休克70 ku蛋白4样蛋白(heat shock 70 ku protein 4-like, HSPA4L)等3种蛋白,而LMNA、ENOA、HSPB1和HSPH1等4种蛋白没有被诱饵蛋白拉下(图4)。在高表达突变c1orf194蛋白的SH-SY5Y 细胞中,通过诱饵蛋白没拉下THSD1和EIF4A1两种蛋白。
3 讨论
蛋白相互作用研究有助探讨分子功能、细胞结构、信号通路、疾病发病机制及疾病治疗靶点[4]。已发现可导致CMT的致病基因有80多个[5]。GRP75参与细胞压力反应、细胞增殖及线粒体维护等功能[6]。最近研究显示通过IP3R-GRP75-VDAC1-MCU路径介导的内质网-线粒体间Ca2+运输紊乱会导致神经元线粒体内Ca2+浓度升高,进而引起神经元发生退行性改变[7]。在以前研究中,发现在SH-SY5Y细胞内c1orf194与GRP75蛋白存在相互作用,Ile122Asn突变使c1orf194蛋白失去与GRP75蛋白的相互作用,引起胞质内Ca2+升高,导致神经元坏死,这是引起一种常染色体显性遗传CMT的分子机制[3]。

A.LMNA; B.ENOA; C.HSPB1; D.TBA1C; E.AACT; F.HSPH1; G.HSPA4L; 1.prey protein; 2.Flag-c1orf194图4 SH-SY5Y细胞中与野生c1orf194蛋白相互作用的验证Fig 4 Validation of identified c1orf194-interacting proteins by Western blot
本研究发现野生c1orf194蛋白与TBA1C、AACT和HSPA4L等3种蛋白存在相互作用,Ile122Asn突变影响其与这3种蛋白间的相互作用,这可能是CMT致病机制之一。TBA1C是微管蛋白家族成员,参与微管装配,形成细胞骨架系统[8]。神经纤维丝轻链多肽(neurofilament light chain polypeptide, NEFL)是神经元细胞骨架的主要组成成分,NEFL基因突变可导致CMT2E和CMT1F[9]。细胞骨架组成蛋白改变是CMT发病的一种机制。本研究发现TBA1C和c1orf194是相互作用蛋白,而C1orf194基因Ile122Asn和Lys28Ile突变可导致常染色体显性遗传CMT,但患者临床表现有较大异质性[3]。这种临床异质性可能是c1orf194蛋白不同肽段突变通过影响不同的相互作用蛋白而产生的,C1orf194基因的Ile122Asn突变导致CMT机制之一可能是影响神经元的细胞骨架功能。
AACT是一种急性时相反应蛋白,研究显示它可促进β-淀粉样蛋白纤维化和聚集,进而引起阿尔茨海默病的发病[10]。CMT与阿尔茨海默病一样,同属于神经退行性疾病,其发病机制类似[11]。本研究结果显示在SH-SY5Y细胞中AACT与c1orf194蛋白存在相互作用,提示C1orf194基因的Ile122Asn突变导致CMT或许与AACT蛋白功能有关,其参与机制有待进一步探讨。
HSPA4L是HSP110热休克蛋白家族成员,在人体内广泛表达,以睾丸组织表达最丰富[12]。有研究显示HSPA4L参与细胞自噬和Cvt路径中膜的运输[13]。尚未有研究提示HSPA4L蛋白与神经系统疾病的发病相关。研究发现在SH-SY5Y细胞中HSPA4L与c1orf194蛋白存在相互作用,HSPA4L蛋白是否与C1orf194基因突变导致CMT,有待继续研究。本研究显示野生c1orf194蛋白可与TBA1C、AACT及HSPA4L等3种蛋白相互作用,但携带Ile122Asn突变的c1orf194蛋白不能与这3种蛋白作用,这显示Ile122Asn突变可导致c1orf194蛋白失去蛋白间相互作用,进而引起CMT,蛋白间相互作用改变可能是CMT致病机制之一。

