沉默CXCL12抑制ox-LDL诱导小鼠巨噬细胞系RAW264.7泡沫化和凋亡
庄 红,张苏川,刘慧地,徐亚宁,黄 璐,代 天,蒋 品
(江汉大学附属医院(武汉市第六医院) 心血管内科, 湖北 武汉 430015)
动脉粥样硬化(atherosclerosis,AS)是严重危害人类健康和生活质量的疾病之一,揭示AS发生发展的关键因素,对有效预防和治疗AS具有重要意义[1]。巨噬细胞参与的脂质代谢障碍是AS的病变基础;巨噬细胞泡沫化和凋亡是导致AS斑块不稳定的重要因素;干预巨噬细胞泡沫化和凋亡可对阻止AS进展、防治心脑血管病的发生具有重要意义[2]。氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)是AS的重要危险因子,其可以结合巨噬细胞表面的清道夫受体,促进巨噬细胞吞噬ox-LDL,造成脂质积聚,进而形成泡沫细胞[3]。CXC趋化因子配体 12(CXC chemokine ligand 12,CXCL12)是CXC趋化因子家族的成员,又称基质细胞衍生因子-1(stromal cell-derived factor-1,SDF-1),稳定和不稳定的颈动脉粥样斑块中CXCL12的表达增加,且定位在巨噬细胞中[4]。p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinases,p38MAPK)是调控免疫炎性反应最主要的MAPK家族成员之一,可通过调节炎性反应影响AS的进展[5]。本实验旨在研究CXCL12对ox-LDL诱导巨噬细胞泡沫化和凋亡作用及其机制是否与p38MAPK信号通路有关。
1 材料与方法
1.1 材料
小鼠腹腔巨噬细胞系RAW264.7(上海北诺生物科技有限公司);胎牛血清和RPMI-1640培养基(Gibco公司);氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)(广州奕源生物科技有限公司);油红O(Sigma-Aldrich公司);苏木精(上海源叶生物科技有限公司);异丙醇(天津市化学试剂三厂);蛋白提取试剂盒、二辛可宁酸(bicinchoninic acid,BCA)试剂盒和十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)试剂盒(碧云天生物技术研究所);抗体(Cell Signaling Technology 公司);膜联蛋白V-异硫氰酸荧光素(annexin V-FITC)和碘化丙锭(PI)试剂盒(南京凯基生物科技发展有限公司);Trizol试剂、反转录试剂盒和荧光定量试剂盒(Progema公司);载体质粒(北京普瑞金科技有限公司);LipofectamineTM2000转染试剂(Invitrogen公司)。
1.2 方法
1.2.1 细胞的培养与分组:用含10%胎牛血清的RPMI-1640培养液在37 ℃、5% CO2条件下培养RAW264.7细胞,待细胞汇合至90%左右时,进行传代,取对数增殖期RAW264.7细胞,接种于6孔板,培养24 h后用60 mg/L的ox-LDL处理24 h诱导巨噬细胞泡沫化,记为ox-LDL组,不添加ox-LDL的作为对照(NC)组;将si-con、si-CXCL12转染至RAW264.7细胞中再用60 mg/L的ox-LDL处理,分别记为ox-LDL+si-con组、ox-LDL+si-CXCL12组。
1.2.2 油红O染色观察细胞形态:细胞去上清后用PBS洗涤3次,10%甲醛固定30 min,再用PBS洗涤2次,用60%异丙醇浸洗5 min,吸去异丙醇,加入油红O,置于60 ℃烤箱中染色30 min,蒸馏水清洗3次,苏木精染色5 min,蒸馏水洗蓝化1~3 min,控干,荧光显微镜下观察拍照。
1.2.3 Western blot检测三磷酸腺苷结合盒转运蛋白A1(ABCA-1)、B类1型清道夫受体(SRB-1)、活化的半胱氨酸天冬氨酸蛋白酶3(cleaved caspase-3)、活化的半胱氨酸天冬氨酸蛋白酶9(cleaved caspase-9)、CXCL12、p38丝裂原活化蛋白激酶(p38MAPK)和磷酸化p38MAPK(p-p38MAPK)蛋白表达:培养细胞48 h后提取总蛋白,BCA试剂盒测定蛋白浓度。将蛋白样品进行SDS-PAGE后转至聚偏二氟乙烯膜上,用5%脱脂奶粉室温封闭1 h,再分别加入一抗(1∶1 000),4 ℃孵育过夜,TBST洗膜;加入二抗(1∶2 000)室温孵育90 min,TBST洗涤,用ECL发光液显影,用ChemiDoc XRS+系统成像,用Quantity One凝胶分析软件测定各组蛋白条带的吸光度值,蛋白相对表达水平=目的条带吸光度值/β-actin条带吸光度值。每个蛋白样品设3个重复。
1.2.4 流式细胞计量术检测细胞凋亡:培养细胞48 h后用预冷的PBS漂洗2次,与500 μL的结合缓冲液混匀。先加入10 μL的annexin V-FITC,再加入5 μL的PI,混匀后避光孵育10 min。用流式细胞仪检测细胞凋亡率。每组设3个复孔,实验重复3次。
1.2.5 RT-qPCR检测CXCL12 mRNA表达水平:培养细胞48 h后提取细胞总RNA,将RNA反转录成cDNA,CXCL12以β-actin为内参进行PCR扩增,每个样品重复3次,循环条件为95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环;60 ℃延长5 min。相对表达量采用2-△△Ct法计算。CXCL12上游引物序列:5′-TTCCATTTGCAAGGGAAAAG-3′,下游引物序列:5′-ACACACAGCCAGTCAACGAG-3′;β-actin上游引物序列:5′-CTCCATCCTGGCCTCGCTGT-3′,下游引物序列:5′-GCTGTCACCTTCACCGTTCC-3′。
1.3 统计学分析
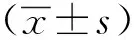
2 结果
2.1 ox-LDL诱导巨噬细胞RAW264.7泡沫化
对照组大部分细胞内未见红染脂滴,仅少数细胞内有少量脂滴;ox-LDL组细胞体积增大,形状变为圆形,胞质中可明显见到大量红色脂滴(图1A)。与对照组相比,ox-LDL组ABCA-1和SRB-1表达水平均显著升高(P<0.05)(图1B,表1)。

A.Oil red O staining diagram(×200); B.ABCA-1 and SRB-1 protein expression图1 RAW264.7细胞油红O染色观察和Western blot检测巨噬细胞ABCA-1和SRB-1蛋白表达

表1 ox-LDL诱导巨噬细胞对ABCA-1和SRB-1蛋白表达的影响
2.2 ox-LDL诱导巨噬细胞RAW264.7凋亡
与对照组相比,ox-LDL组cleaved caspase-3、cleaved caspase-9表达水平显著升高,细胞凋亡率显著升高(P<0.05)(图2,表2)。
2.3 ox-LDL对RAW264.7细胞CXCL12基因表达的影响
与对照组相比,ox-LDL组CXCL12 mRNA和蛋白表达水平显著升高(P<0.05)(图3,表3)。

A.fow cytometry detection of RAW264.7 cell apoptosis; B.Western blot detection of RAW264.7 cell cleaved caspase-3 and cleaved caspase-9 protein expression

表2 ox-LDL诱导RAW264.7细胞对细胞凋亡及cleaved caspase-3和cleaved caspase-9蛋白表达的影响

图3 Western blot检测RAW264.7细胞CXCL12蛋白表达Fig 3 Western blot detection of CXCL12 protein expression in RAW264.7 cells

表3 ox-LDL诱导RAW264.7细胞对CXCL12表达的影响
2.4 沉默CXCL12基因对巨噬细胞RAW264.7泡沫化和凋亡的影响
ox-LDL+si-con组大部分细胞形状为圆形,胞质中明显有大量红色脂滴;而ox-LDL+si-con-CXCL12组大部分细胞内未见红染脂滴,仅少数细胞内有部分脂滴(图4A)。与ox-LDL+si-con组相比,ox-LDL+si-CXCL12组CXCL12表达水平显著降低,ABCA-1、SRB-1表达水平显著降低,cleaved caspase-3、cleaved caspase-9表达水平显著降低,细胞凋亡率显著降低(P<0.05)(图4B~C,表4)。
2.5 沉默CXCL12基因对巨噬细胞RAW264.7 p38MAPK信号通路的影响
与对照组相比,ox-LDL组p-p38MAPK表达水平显著升高(P<0.05);与ox-LDL+si-con组相比,ox-LDL+si-CXCL12组p-p38MAPK表达水平显著降低(P<0.05)(图5,表5)。
3 讨论
AS是由脂质代谢失衡和动脉壁中含有胆固醇的巨噬细胞积聚驱动引起的一种慢性炎性疾病,发病率和致死率高,对人体健康危害极大[6]。巨噬细胞是机体免疫系统的重要一员,其泡沫化可导致AS病变,与AS形成和发展密切相关[7]。本实验用ox-LDL诱导巨噬细胞泡沫化,结果表明ox-LDL处理可致巨噬细胞泡沫化,且可诱导巨噬细胞凋亡。患有动脉粥样硬化相关疾病的患者血清CXCL12水平显著增加[8]。CXCL12与CXCR4相互作用,激活糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)/β-连环蛋白(β-catenin)T120/转录因子21(transcription factor 21,TCF21)信号通路,以抑制巨噬细胞ABCA-1依赖性胆固醇外流并加重动脉粥样硬化[9]。本实验结果显示,ox-LDL处理的巨噬细胞中CXCL12表达水平显著升高,沉默CXCL12可抑制巨噬细胞泡沫化和细胞凋亡。表明CXCL12可能与AS进展有关。

图4 RAW264.7细胞油红O染色观察(A)和流式细胞计量术检测RAW264.7细胞凋亡(B)及Western blot检测CXCL12、ABCA-1和SRB-1蛋白表达(C)

表4 沉默CXCL12基因抑制ox-LDL诱导RAW264.7细胞泡沫化和凋亡Table 4 Silencing CXCL12 gene inhibits ox-LDL-induced foaming and apoptosis of RAW264.7

图5 Western blot检测RAW264.7细胞p38MAPK和p-p38MAPK蛋白表达Fig 5 Western blot detection of p38MAPK and p-p38 MAPK protein expression in RAW264.7 cells

表5 沉默CXCL12基因对RAW264.7细胞p38MAPK信号通路的影响
纤维脂肪动脉粥样硬化病变中p-p38MAPK表达增加[10];绿茶多酚可通过阻断p38MAPK通路的活化延缓AS斑块进展[11]。沉默CXCL12通过下调MAPK/磷脂酰肌醇3激酶(phosphoinositide 3 kinese,PI3K)/活化蛋白1(activating protein 1,AP-1)信号通路显著抑制结肠癌细胞的增殖、侵袭和血管生成能力[12]。本实验结果显示,ox-LDL处理的巨噬细胞RAW264.7中p-p38MAPK表达水平显著升高,说明ox-LDL可能诱导p38 MAPK信号通路激活。且本实验还发现沉默CXCL12可抑制p38 MAPK信号通路激活。提示,CXCL12可能通过p38 MAPK信号通路影响巨噬细胞RAW264.7泡沫化和细胞凋亡。
综上所述,沉默CXCL12抑制ox-LDL诱导小鼠巨噬细胞RAW264.7泡沫化和细胞凋亡,其可能与p38MAPK信号通路有关。

