奶山羊DDX3Y蛋白多克隆抗体的制备
杜伟伟,代邦国,钟玉玲,史怀平
(西北农林科技大学 动物科技学院,动物遗传育种与繁殖重点实验室,陕西 杨凌712100)
H-Y雄性特异性抗原(Y-chromosomal histocompatibility antigens)是雄性动物特有的物质,在小鼠移植物排斥实验中首次被发现。H-Y抗原属于一类次要组织相容性复合物[1]。随着研究的深入,人们发现H-Y抗原在哺乳动物中存在于含有Y染色体的细胞表面,其化学本质是结合在细胞表面的糖蛋白[2-3]。H-Y抗原的编码基因位于Y染色体上,是含Y染色体的细胞中特有的一类基因,H-Y抗原编码基因参与性腺向雄性方向发育的过程,同时对精子发生具有明显的影响[4]。同期发情和人工授精技术已成为山羊良种繁育和改良最有效的手段之一,显著提升了种公羊在现代山羊育种中的优势地位,尤其是在奶山羊产业中,种公羊的质量直接决定奶山羊的养殖效益。而在人工授精技术中,精液品质是受精成败的关键因素之一[5],影响精液品质的因素包括种公羊年龄、利用年限、温度、日照、湿度、营养水平以及采精技术和卫生措施等;同时Y染色体上H-Y抗原编码基因对精子发生也起着重要的作用,对精液品质有明显的影响。
H-Y抗原编码基因包括赖氨酸特异性去甲基化酶基因5D(lysine(K)-specificdemethylase5D,KDM5D)、Y连锁DEAD解旋酶因子(DEAD-boxhelicase3Y-linked,DDX3Y)、Y连锁核糖体蛋白基因S4(ribosomalproteinS4Y-linked,RPS4Y)等,X染色体上有其同源基因,如赖氨酸特异性去甲基化酶基因5C(lysine(K)-specificdemethylase5C,KDM5C)、X连锁DEAD解旋酶因子(DEAD-boxhelicase3X-linked,DDX3X)、X连锁核糖体蛋白基因S4(ribosomalproteinS4X-linked,RPS4X)等[6-8]。DDX3Y是精子发生中起关键性作用的基因之一,编码ATP依赖性RNA解螺旋酶,其属于DEAD-box蛋白家族成员,参与细胞的多种生理过程,包括RNA剪接、RNA 降解和核糖体合成等[9-10]。DDX3Y缺失可导致生精细胞生长障碍、数量减少甚至完全缺乏[11-12]。DDX3Y的相关研究目前在人和鼠上报道相对较多,但在山羊上较少,尤其是专门针对山羊DDX3Y蛋白抗体的研究尚未见报道。本研究选取山羊H-Y抗原编码基因DDX3Y进行了原核表达,并将蛋白纯化后免疫新西兰大耳兔,制备高特异性的DDX3Y多克隆抗体,以期为进一步研究DDX3Y在奶山羊精子发生中的功能机制提供重要的试验材料。
1 材料与方法
1.1 试验材料
Primer Star Max DNA聚合酶、LA-TaqDNA聚合酶、DNA限制性内切酶EcoR Ⅰ和Hind Ⅲ、T4 DNA连接酶、Prime Script RT Reagent Kit RNA反转录试剂盒、DNA Marker、pMD19-T 载体试剂盒,购自大连宝生物公司;琼脂糖凝胶DNA回收试剂盒、高纯质粒小提中量试剂盒、大肠杆菌Top10感受态菌株,购自天根生化科技有限公司;大肠杆菌BL21菌株购自北京全式金生物技术有限公司;原核表达载体pET32a (+)购自Solarbio科技有限公司;蛋白Marker购自Genstar及BIO-RAD;Ni-NTA Resin购自南京金斯瑞生物科技有限公司;Anti-His tag鼠单克隆抗体、β-actin鼠单克隆抗体、山羊抗鼠IgG HRP、山羊抗兔IgG HRP,购自CWBIO公司;TMB底物显色试剂由天根生物有限公司购置;弗氏完全佐剂、弗氏不完全佐剂,购自北京博奥龙免疫技术有限公司。其余化学试剂均为国产分析纯试剂。试验所用引物的合成及片段测序均由杨凌奥科公司完成。健康成年公羊睾丸组织,由本实验室保存。3月龄雌性新西兰大耳兔,购自成都达硕实验动物中心。
1.2 方 法
1.2.1DDX3Y基因的克隆及测序 取液氮中保存的健康成年公羊睾丸组织,经液氮研磨后,采用Trizol法提取总RNA,经浓度和纯度测定(OD260/OD280≈1.8)合格后,按照Prime Script RT Reagent Kit RNA反转录试剂盒说明书,将RNA反转录为cDNA。以牛(Bostaurus)DDX3YCDs区为模板,采用Premier 5.0软件设计PCR引物(上游5′-ATGAGTCATGAGGCGGTGAA-3′,下游5′-TCAG-TTGCCCCACCAGTCA-3′),进行山羊DDX3YCDs全长的PCR扩增,反应体系为:cDNA模板0.5 μL,2×Primer Star Max DNA聚合酶10.0 μL,上、下游引物各1.0 μL,加ddH2O补齐至20.0 μL。PCR反应程序:98 ℃预变性3 min;98 ℃变性10 s,59 ℃退火10 s,72 ℃延伸30 s,33个循环;最后72 ℃延伸5 min。PCR产物经1%的琼脂糖凝胶电泳(120 V恒压电泳35 min)检测后,用琼脂糖DNA回收试剂盒回收目的序列。对回收的目的序列进行LA-TaqDNA酶加A尾,反应体系为:目的序列15.8 μL,10×LATaqBuffer Ⅱ 2.0 μL,dNTP Mixture 2.0 μL,LA-TaqDNA酶0.2 μL。反应程序:95 ℃预变性 3 min,72 ℃加尾 10 min,12 ℃保存。对加尾反应产物进行1%的琼脂糖凝胶电泳(120 V恒压电泳35 min)检测后,用琼脂糖DNA回收试剂盒回收。将回收产物与pMD19-T载体连接构建pMD19-T-DDX3Y 克隆载体,步骤参考pMD19-T载体试剂盒说明书,反应体系:Solution Ⅰ 5.0 μL,pMD19-T载体0.5 μL,回收的DNA 7.0 μL。参考大肠杆菌Top10感受态菌株转化说明书,将pMD19-T-DDX3Y克隆载体转化入大肠杆菌Top10感受态菌株后,接种于含50 μg/mL氨苄青霉素的LB固体培养基上,37 ℃倒置过夜培养。次日挑取单克隆菌落于10 mL含100 μg/mL氨苄青霉素的LB液体培养基中,37 ℃、200 r/min振荡培养12 h,取培养后菌液200 μL送杨凌奥科公司测序。
1.2.2 抗原基因序列的构建 (1)抗原的确定。 首先用DNAMAN软件比对山羊DDX3Y与山羊DDX3X、兔DDX3X氨基酸序列的同源性。然后用DNASTAR软件及在线分析网站http://www.cbs.dtu.dk/services/TMHMM对山羊DDX3Y蛋白的非跨膜区、亲水性、灵活性、抗原性、表面可及性进行预测。综合以上分析结果,确定适合作为抗原进行原核表达的DDX3Y蛋白区段,该蛋白区段须同时符合以下要求:与山羊DDX3X、兔DDX3X氨基酸序列同源性相对较低且为非跨膜区,亲水性、灵活性、抗原性、表面可及性均良好。山羊DDX3Y、山羊DDX3X和兔DDX3X氨基酸序列同源性的DNAMAN比对结果见图1,综合DNASTAR软件及在线分析网站http://www.cbs.dtu.dk/services/TMHMM的预测结果,选取DDX3Y蛋白N端1-120氨基酸,C端570-660氨基酸为抗原片段。

图1 山羊DDX3Y、DDX3X和兔DDX3X氨基酸序列同源性的DNAMAN比对结果
(2)抗原基因片段的扩增。 以山羊DDX3Y基因CDs序列为模板,用Premier 5.0软件设计引物,用PCR扩增所选氨基酸区段对应的基因片段。DDX3Y蛋白N端1-120氨基酸对应基因(DDX3Y基因CDs区5′端1-360 bp,共360 bp,即第一段抗原基因)的引物序列为:上游5′-ATGAGTCATGAGGCGGTGAA-3′,下游5′-CCATGTTTTCCAACTCATATCTGCCAAAGCCAGT-3′,DDX3Y蛋白C端570-660氨基酸对应基因(DDX3Y基因CDs区3′端1 710-1 983 bp,共273 bp,即第二段抗原基因)的引物序列为:上游5′-TGGCAGATATGAGTTGGAAAACATGGCCTAT-GAAC-3′,下游5′-TCAGTTGCCCCACCAGTCA-3′。
两段基因的PCR反应体系同1.2.1,PCR反应程序均为:98 ℃预变性3 min;98 ℃变性10 s,58 ℃退火10 s,72 ℃延伸15 s,33个循环;72 ℃延伸5 min。PCR产物电泳、回收及测序同1.2.1。
PCR扩增得到的第一段抗原基因3′端人为添加了第二段抗原基因5′端的13对碱基,第二段抗原基因5′端人为添加了第一段抗原基因3′端的13对碱基,通过给两段抗原基因添加互补碱基为后续进行两段基因的搭桥PCR连接提供模板。
(3)DDX3Y截短抗原基因序列的构建。 通过搭桥PCR将克隆得到的不同抗原基因片段进行连接,得到DDX3Y截短抗原基因序列。搭桥PCR上、下游引物分别为第一段抗原基因的上游引物和第二段抗原基因的下游引物(见1.2.2(2))。搭桥PCR反应体系为:第一段抗原基因和第二段抗原基因(DNA模板)各0.5 μL,2×Primer Star Max DNA聚合酶10.0 μL,上、下游引物各1.0 μL,加ddH2O补齐至20.0 μL。PCR反应程序同1.2.2(2)。分析DDX3Y截短抗原基因序列及pET32a (+)原核表达载体的酶切位点,采用Premier 5.0软件设计带酶切位点的引物:上游 5′-CCGGAATTCATGAGTCATGAGGCGGTGAA-3′(下划线碱基为EcoR Ⅰ酶切位点),下游5′-CCCAAGCTTTCAG-TTGCCCCACCAGTCA-3′(下划线碱基为Hind Ⅲ酶切位点)。以DDX3Y截短抗原基因序列为模板,用PCR扩增带酶切位点的DDX3Y截短抗原基因序列,预期该基因编码的DDX3Y截短抗原蛋白含210氨基酸,分子质量为23 ku。PCR反应体系同1.2.1,PCR反应程序同1.2.2(2),PCR产物电泳检测及回收同1.2.1。
1.2.3 原核表达载体的构建 将带酶切位点的DDX3Y截短抗原基因序列及pET32a (+)原核表达载体分别经EcoR Ⅰ和Hind Ⅲ双酶切后连接,构建重组质粒pET32a (+)-DDX3Y,双酶切反应体系为:EcoR Ⅰ 0.5 μL,Hind Ⅲ 0.5 μL,10×H Buffer 1.0 μL,pET32a (+)或DDX3Y截短抗原基因6.0 μL,ddH2O 2.0 μL;反应程序为37 ℃水浴酶切4 h。连接反应体系为:DDX3Y截短抗原基因片段5.0 μL,线性pET32a (+)载体3.5 μL,10×Ligation Buffer 1.0 μL,T4 DNA连接酶 0.5 μL;反应程序为16 ℃过夜连接。将重组载体转化大肠杆菌Top10感受态菌株,转化及培养过程同1.2.1。将培养后的菌液用高纯质粒小提中量试剂盒提取质粒,并经EcoR Ⅰ、Hind Ⅲ双酶切鉴定,将双酶切鉴定正确后的质粒送杨凌奥科公司测序。
1.2.4 DDX3Y截短抗原蛋白的诱导表达及鉴定 将测序正确的pET32a(+)-DDX3Y质粒和pET32a (+)空质粒分别转化感受态大肠杆菌BL21,接种于含50 μg/mL氨苄青霉素的LB固体培养基上。当菌落长至刚能够用白枪头挑取时,挑取单克隆菌落于10 mL含100 μg/mL氨苄青霉素的LB液体培养基中,37 ℃、200 r/min振荡培养12 h。取上述2种菌液各150 μL,分别接种于15 mL含100 μg/mL氨苄青霉素的LB液体培养基中,37 ℃、200 r/min振荡培养至对数期(600 nm处吸光值为0.4~0.6),取pET32a (+)-DDX3Y菌液1 mL作为诱导前对照备用,剩余菌液加入终浓度1 mmol/L的IPTG,37 ℃、180 r/min振荡诱导表达6 h。分别取诱导表达后的2种菌液2 mL,6 000 r/min离心10 min后收集沉淀,各用1 mL缓冲液重悬,超声破碎(输出功率30 W工作3 s停4 s)5 min,对破碎后的菌液进行SDS-PAGE检测,用考马斯亮蓝染色判断有无目的条带。使用Anti-His tag鼠单克隆抗体作为一抗,山羊抗鼠IgG HRP作为二抗,用Western blot鉴定DDX3Y截短抗原蛋白是否正确表达,即表达产物是否具有组氨酸标签。
1.2.5 DDX3Y截短抗原蛋白表达形式的探索 培养并诱导表达DDX3Y截短抗原蛋白菌液200 mL,6 000 r/min离心10 min收集菌体沉淀,用20 mL超声缓冲液重悬菌体沉淀,超声破碎(输出功率60 W,工作5 s停7 s)45 min,超声破碎过程中样品全程冰浴。超声破碎结束后将样品于6 000 r/min离心5 min,分别取上清液和沉淀进行SDS-PAGE电泳分析,以诱导后的菌体为阳性对照,判断重组蛋白在沉淀和上清液中的表达情况。若重组蛋白以沉淀的形式大量表达,说明重组蛋白形成无活性的包涵体,需对包涵体蛋白进行高浓度尿素或盐酸胍变性及透析复性。
1.2.6 DDX3Y截短抗原蛋白的大量诱导表达及纯化 培养并诱导表达pET32a(+)和DDX3Y截短抗原蛋白菌液各1 L,6 000 r/min离心10 min收集菌体沉淀,用45 mL超声缓冲液重悬菌体沉淀,超声破碎(输出功率60 W,工作5 s停7 s)60 min,超声破碎过程中样品全程冰浴。超声结束后将样品于6 000 r/min离心10 min收集包涵体沉淀,用含8 mol/L尿素的超声缓冲液溶解包涵体,6 000 r/min离心10 min后弃沉淀得到变性蛋白溶液。
参考金斯瑞Ni-NTA亲和层析介质纯化说明书纯化溶解在超声缓冲液中的粗蛋白,并收集过Ni-NTA Resin流穿液、过Ni-NTA Resin蛋白洗涤液、过Ni-NTA Resin蛋白洗脱液进行SDS-PAGE,分析纯化效果,对纯度在95%以上的蛋白洗脱液进行透析复性,并用BCA法测定蛋白质量浓度。
1.2.7 DDX3Y截短抗原蛋白多克隆抗体的制备 将DDX3Y截短抗原蛋白样品与等体积的弗氏完全佐剂混合均匀,皮下多点免疫3月龄雌性新西兰大耳兔,初次免疫16 d后使用弗氏不完全佐剂乳化的抗原进行二免,之后每隔10 d用弗氏不完全佐剂乳化的抗原加强免疫1次,各次免疫剂量均为0.8 mg/只,每次加强免疫后的第7天耳缘静脉少量采血,通过间接ELISA(iELISA)法检测血清抗体效价,当抗血清效价达到1∶64 000时,再加强免疫一次(共加强免疫4次),之后心脏采全血,收集析出的血清,离心后-80 ℃保存。对照组兔使用不含目的蛋白的洗脱液进行免疫,免疫流程与饲养条件与试验组一致。
1.2.8 DDX3Y截短抗原蛋白多克隆抗体效价与特异性检测 采用iELISA法测定抗体效价,用包被液稀释抗原质量浓度至10 μg/L,96孔板每孔加100 μL,4 ℃过夜包被,每孔加150 μL封闭液37 ℃封闭1.5 h,将免疫兔血清及对照兔血清(阴性对照)按1∶102,1∶103,1∶104,1∶105,1∶106稀释度稀释后,按每孔100 μL的量加入封闭后的96孔板,37 ℃反应2 h,洗涤后每孔加入1∶2 000稀释后的山羊抗兔IgGHRP 100 μL反应1 h,洗涤后37 ℃避光用TMB显色25 min,加入终止液,于450 nm处测吸光值(OD450),当对照兔血清1∶102稀释度对应的OD450介于免疫兔血清两个相邻稀释度对应的OD450之间时,将此免疫兔血清两个稀释度中对应吸光值大的稀释度确定为抗血清效价。
取原核表达得到的DDX3Y重组蛋白进行SDS-PAGE电泳,半干转膜仪16 V恒压转膜30 min。用50 g/L脱脂奶粉室温封闭2 h,TBST洗涤3次,抗血清用封闭液1∶500稀释后作为一抗与转上蛋白的PVDF膜4 ℃过夜杂交,TBST洗膜3次后用1∶2 000稀释后的山羊抗兔IgGHRP作为二抗杂交2 h,TBST洗膜3次后曝光,分析抗体特异性。同时,分别提取山羊睾丸和卵巢组织蛋白进行Western blot试验,以β-actin为内参,检测抗体是否能特异性识别雄性组织蛋白。
2 结果与分析
2.1 山羊DDX3Y基因的克隆及测序
PCR反应扩增得到山羊1 983 bp的DDX3Y基因CDs区全长(图2)。测序结果显示也得到了1 983 bp的CDs区全长基因序列(图3)。
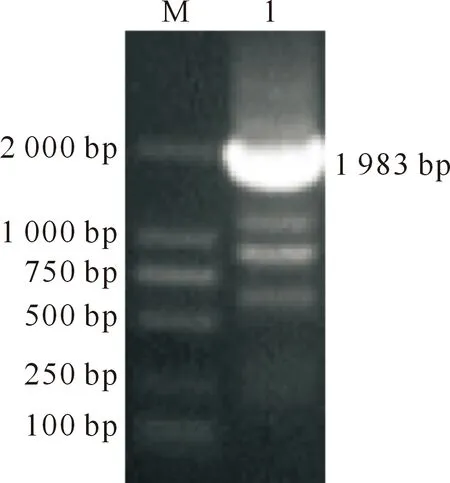
M.DNA DL2000 Marker;1.DDX3Y基因CDs区全长
2.2 DDX3Y截短抗原基因序列的构建
PCR扩增得到了山羊DDX3YCDs区5′端360 bp(1-360 bp)序列(图4-A)和3′端273 bp(1 710-1 983 bp)序列(图4-B),分别编码DDX3Y蛋白N端1-120氨基酸和C端570-660氨基酸。搭桥PCR扩增得到了633 bp的DDX3Y截短抗原基因序列(图5)。
2.3 重组原核表达载体pET32a(+)-DDX3Y的构建
重组质粒pET32a (+)-DDX3Y经EcoR Ⅰ、Hind Ⅲ双酶切鉴定,获得了5 900 bp的pET32a(+)载体片段和633 bp的DDX3Y截短抗原基因片段(图6),与预测结果一致。测序结果表明,633 bp的DDX3Y截短抗原基因序列已正确连接到pET32a (+)载体上。

图3 山羊DDX3Y基因CDs区全长序列

A.DDX3Y CDs区5′端360 bp(1-360 bp)序列的PCR扩增产物;B.DDX3Y CDs区3′端273 bp(1 710-1 983 bp)序列的PCR扩增产物;M.DNA DL2000 Marker;1~2和3~4.目的片段

M.DNA DL2000 Marker;1~2.DDX3Y截短抗原基因搭桥PCR扩增结果
2.4 DDX3Y截短抗原蛋白的表达及鉴定
SDS-PAGE表明,pET32a(+)-DDX3Y菌液诱导表达出约42 ku的重组蛋白,而pET32a(+)菌液于相应位置无重组蛋白条带,仅出现19 ku大小的标签蛋白条带(图 7)。Western blot检测结果(图8)表明,DDX3Y截短抗原蛋白在原核体系中正确表达。

M.BIO-RAD Precision Plus蛋白Marker;1.诱导后pET32a(+)菌液;2.诱导前pET32a(+)-DDX3Y菌液;3~6.诱导后pET32a(+)-DDX3Y菌液
2.5 DDX3Y截短抗原蛋白表达形式的探索及抗原蛋白的纯化
超声破碎后的菌液SDS-PAGE检测发现,DDX3Y截短抗原蛋白主要存在于沉淀中,以无活性的包涵体形式存在,可溶形式较少(图9)。用含8 mol/L尿素的超声缓冲液将包涵体溶解,使用Ni-NTA亲和层析介质进行蛋白纯化发现,在42 ku处出现一条明显的目的蛋白条带(图10),纯化效果良好,测定蛋白质量浓度 ≥2.5 mg/mL。

M.GenStar Color Prestained 蛋白Marker;1.阳性对照(pET32a(+)-DDX3Y诱导后菌体);2~3.pET32a(+)-DDX3Y菌液诱导后超声破碎上清液;4.pET32a(+)-DDX3Y菌液诱导后超声破碎沉淀
2.6 DDX3Y截短抗原蛋白多克隆抗体效价及特异性检测
用iELISA法分析抗血清效价,结果显示DDX3Y抗血清效价达1∶105(图11),蛋白免疫效果良好。用原核表达的DDX3Y截短抗原蛋白与制备的DDX3Y抗血清进行Western blot检测(图12-A),在蛋白分子质量42 ku处出现了明显的条带,表明制备的抗体具有很好的特异性。对山羊睾丸及卵巢组织提取的蛋白进行Western blot检测,结果表明DDX3Y抗血清可以特异性识别山羊雄性组织蛋白(图12-B)。
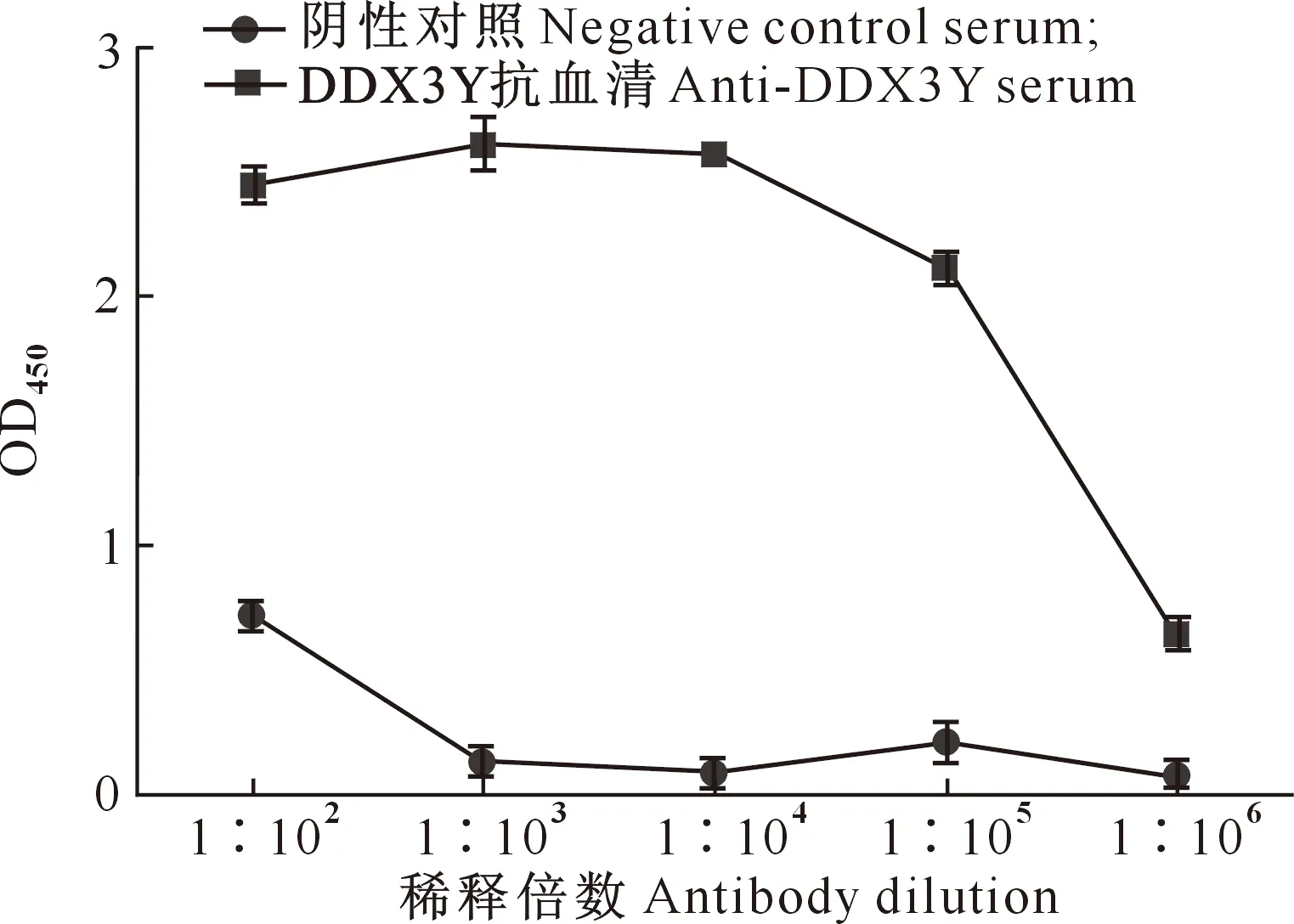
图11 山羊DDX3Y截短抗原蛋白多克隆抗体效价的测定

A.DDX3Y截短抗原蛋白多克隆抗体对原核表达抗原的特异性检测;B.DDX3Y截短抗原蛋白多克隆抗体对雄性组织抗原的特异性检测;M.GenStar Color Prestained 蛋白Marker;1~4.DDX3Y截短抗原蛋白;5~6.睾丸组织蛋白;7~8.卵巢组织蛋白
3 讨 论
DDX3Y基因定位于Y染色体长臂AZF区,编码660个氨基酸的ATP依赖性RNA解螺旋酶,在雄性组织中广泛表达,且在精子发生中具有重要作用,但在精子中编码的蛋白仅存在于减数分裂前期的精原细胞中[13-14]。当DDX3Y基因缺失时,男性表现为不育[15]。研究表明,DDX3YmRNA存在于多种哺乳动物成熟精子中,并伴随着受精过程进入受精卵,认为DDX3Y可能与精子获能、受精和雄性胚胎发育有关[16]。另外Kobayashi等[17]研究表明,小鼠雄性胚胎附植前的发育速度明显快于雌性胚胎,同时测序发现雄性胚胎中DDX3Y表达量较高,说明DDX3Y可能影响雄性胚胎的发育速度。其他相关研究表明,DDX3Y缺失会导致小鼠精子发生障碍[18]。但迄今为止,DDX3Y基因在山羊精子发生及雄性胚胎发育中的生物学功能还不清楚。
本研究基于生物信息学分析,对DDX3Y蛋白序列进行了全面的分析和预测,结果表明,山羊DDX3Y蛋白N端1-120氨基酸、C端570-660氨基酸序列与山羊DDX3X及兔DDX3X蛋白相应区段差异较大,且抗原指数、亲水性、表面可及性、灵活性等均良好,通过PCR及搭桥PCR克隆得到DDX3Y截短抗原基因序列,为进一步表达抗原制备抗体提供了材料,也为制备其他基因的蛋白抗体提供了思路。
本研究得到的DDX3Y截短抗原蛋白主要以包涵体形式存在,产生包涵体的可能原因为原核表达系统中帮助蛋白正确折叠的分子伴侣数量有限,但重组蛋白表达速率快、产量高,使得原核表达系统来不及正确折叠重组蛋白,重组蛋白疏水区暴露并相互聚集形成包涵体[19-20]。
本研究用睾丸和卵巢组织提取的蛋白对制备的DDX3Y截短抗原蛋白多克隆抗体进行特异性检测,发现在卵巢组织蛋白泳道只能隐约看到目的条带的痕迹,这可能是由于DDX3Y原核表达区段与DDX3X相应区段虽然同源性相对较低,但有相同序列,有部分抗原决定簇位于DDX3Y与DDX3X相同序列处,导致DDX3Y截短抗原蛋白多克隆抗体也可以识别DDX3X蛋白,但相比内参蛋白β-actin,DDX3Y条带显著亮于DDX3X,表明制备的DDX3Y截短抗原蛋白多克隆抗体可以特异性识别山羊雄性组织蛋白。

