外周血NLR、HCT、SCC、CA125在宫颈癌诊疗中的应用
万惠敏,魏修奇,师 维,王 晖
华中科技大学同济医学院附属协和医院:1.肿瘤中心检验科,2.检验科,湖北武汉 430021
中性粒细胞与淋巴细胞比值(NLR)近年来备受关注,越来越多的研究者探讨了NLR在宫颈癌中的应用[1],有研究表明NLR与宫颈癌的FIGO分期、肿瘤大小及淋巴结转移等临床特征相关[2-3]。肿瘤与慢性炎症相关的假设中认为肿瘤是由原癌基因或抑癌基因突变引起的,而炎症形成的微环境对于肿瘤的发生、发展起触发、支持和促进作用[4-6]。贫血是宫颈癌常见的合并症,宫颈癌相关性贫血以小细胞低色素性贫血为主[7-8],而血细胞比容(HCT)降低是贫血的主要表现之一。鳞状上皮细胞癌抗原(SCC)和糖类抗原125(CA125)是宫颈癌辅助诊断、疗效监测常用的血清标志物[9-10],但NLR、HCT、SCC、CA125联合检测在宫颈癌的辅助诊断、临床分期及疗效监测中的意义的研究较少。本研究回顾性分析了宫颈癌患者外周血中的NLR、HCT、SCC、CA125水平及联合检测的意义,并进一步分析了联合检测HCT、SCC、CA125对人乳头瘤病毒(HPV)阴性宫颈癌患者的检出率及对宫颈癌放、化疗疗效评估的价值,旨在为临床提供宫颈癌辅助诊断与放、化疗疗效评估的新途径。
1 资料与方法
1.1一般资料 将本院2014年1月9日至2019年11月19日经病理检查确诊的291例宫颈癌初诊患者(已排除合并其他疾病者)作为宫颈癌组。另外,将2019年10月28日至2019年12月12日于本院体检的200例健康女性体检者作为对照组。宫颈癌组中,患者年龄(52.93±9.73)岁;临床分期Ⅰ~Ⅱ期的患者164例(占56.36%),Ⅲ~Ⅳ期的患者127例(占43.64%);鳞癌257例(占88.32%),腺癌24例(占8.25%),其他癌10例(占3.43%),其他癌包括腺鳞癌、小细胞癌、透明细胞癌、神经内分泌癌、高级别浆液性癌;行HPV检测者共81例,阳性71例(占87.65%)、阴性10例(占12.35%)。对照组年龄(51.26±10.79)岁,与宫颈癌组比较差异无统计学意义(P>0.05)。
1.2方法 NLR、HCT使用EDTA-K2抗凝真空采血管采血2 mL,上下颠倒混匀8~10次,采用贝克曼LH750血球分析仪进行全血检测,CA125、SCC使用不含添加剂的红色真空采血管采血3~5 mL,待血液凝固后使用白洋BY-300A离心机以3 000 r/min离心10 min,并采用雅培i2000免疫分析仪进行检测。以上项目均在本院检验科进行检测,所用试剂、耗材均为原厂产品。

2 结 果
2.1NLR、HCT、SCC、CA125用于宫颈癌诊断的效能 NLR在宫颈癌组中的水平显著升高(P<0.05),见图1A;以≥2.07作为标准诊断宫颈癌的曲线下面积(AUC)为71.93%,灵敏度为58.42%,特异度79.00%,见图2A、表1。HCT在宫颈癌组中的水平显著降低(P<0.05),见图1B;以<37.7%作为标准诊断宫颈癌的AUC为86.28%,灵敏度为77.66%,特异度为82.50%,见图2B、表1。SCC在宫颈癌组中的水平显著升高(P<0.05),见图1C;以≥1.6 ng/mL作为标准诊断宫颈癌的AUC为88.16%,灵敏度为69.37%,特异度为97.37%,见图2C、表1。CA125在宫颈癌组中的水平显著升高(P<0.05),见图1D;以≥18.5 U/mL为标准诊断宫颈癌的AUC为66.62%,灵敏度为46.19%,特异度为82.63%,见图2D、表1。HCT、SCC、CA125联合检测以HCT<37.5%、SCC≥1.4 ng/mL且CA125≥14.6 U/mL为标准用于诊断宫颈癌的AUC为95.26%,灵敏度为89.06%,特异度为92.63%;灵敏度较单一指标诊断时显著增高(P<0.05),见图2E、表1。
2.2NLR、HCT、SCC、CA125在宫颈癌不同分期、不同肿瘤类型中的差异 NLR在Ⅲ~Ⅳ期宫颈癌中较Ⅰ~Ⅱ期显著升高(P<0.05),见图3A;在鳞癌、腺癌间比较差异无统计学意义(P>0.05),见图4A。HCT在Ⅲ~Ⅳ期中较Ⅰ~Ⅱ期显著降低(P<0.05),见图3B;在鳞癌、腺癌间比较差异无统计学意义(P>0.05),见图4B。SCC在Ⅲ~Ⅳ期宫颈癌中较Ⅰ~Ⅱ期显著升高(P<0.05),见图3C;在鳞癌、腺癌间比较差异有统计学意义(P<0.05),见图4C。CA125在Ⅲ~Ⅳ期中较Ⅰ~Ⅱ期显著升高(P<0.05),见图3D;在鳞癌、腺癌间比较差异无统计学意义(P>0.05),见图4D。

注:****表示P<0.000 1;***表示P<0.001;**表示P<0.01;A、B、C、D分别为NLR、HCT、SCC、CA125水平在宫颈癌Ⅰ~Ⅱ期与Ⅲ~Ⅳ期间的比较。

注:****表示P<0.000 1;ns表示P>0.05;A、B、C、D分别为NLR、HCT、SCC、CA125水平在腺癌和鳞癌间的比较。
2.3联合HCT、SCC、CA125对HPV阴性宫颈癌患者的诊断 以HCT<37.5 %、SCC≥1.4 ng/mL且CA125≥14.6 U/mL为诊断标准时,诊断HPV阴性的宫颈癌患者的灵敏度为40.00%(4/10),联合检测HCT、SCC、CA125有助于提高宫颈癌患者的检出率。
2.4SCC、CA125对宫颈癌患者放、化疗疗效监测的价值 SCC水平在治疗后显著降低(P<0.05),见图5A;CA125水平在治疗后显著降低(P<0.05),见图5B。
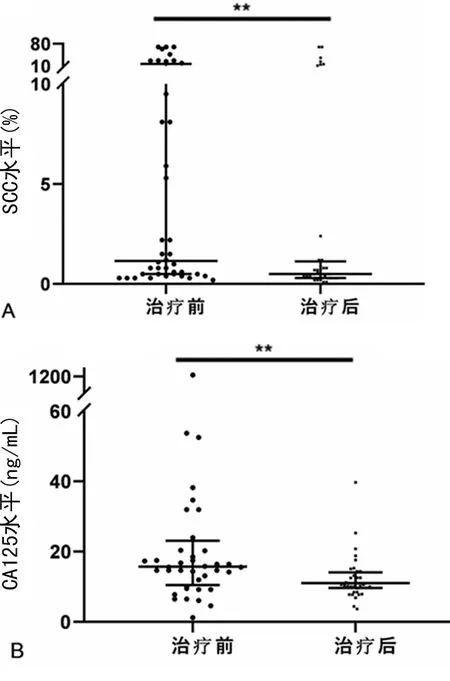
注:**表示P<0.01;A、B分别为SCC、CA125水平在治疗前后的比较。
3 讨 论
宫颈癌是常见的妇科恶性肿瘤,大量研究发现,宫颈癌患者的年龄段正朝着年轻化趋势发展[11-12]。自宫颈癌筛查普及以来,宫颈癌患者的病死率已大幅度降低,目前薄层液基细胞学检查、高危性HPV检测、阴道镜检查已经广泛应用于宫颈癌的筛查中,且有较好的应用效果[13]。2018年美国预防服务工作组颁布了新的宫颈癌筛查指南,指南中指出年龄不同所筛查的频率也不同,例如30~65岁的女性可每3年行1次单纯宫颈细胞学检查,每5年行1次高危性HPV检测,或者每5年进行1次两者的联合检测[14-15],然而在筛查的间隙及HPV检测阴性的患者也有宫颈癌发生的风险。有研究表明,HPV阴性患者宫颈癌的首发症状不典型,发现时已是中晚期,腺癌所占比例较大且患者预后较差[16-19]。因此,研究能够用于宫颈癌及HPV阴性宫颈癌患者的辅助诊断的指标尤为重要。宫颈癌的发生、发展过程中会导致血液中的NLR、HCT、SCC、CA125结果异常。在肿瘤发生发展的早期,血液中的某些肿瘤标志物会有不同程度的升高,检测这些标志物可作为早期发现肿瘤的一个重要方法[20]。
本研究中NLR的AUC为71.93%,最佳截断值2.07,灵敏度58.42%,特异度79.00%,在宫颈癌中水平显著升高,Ⅲ~Ⅳ期中水平比Ⅰ~Ⅱ期显著升高,鳞癌、腺癌间比较,差异无统计学意义(P>0.05),与已有的研究结果相符合[6,21]。HCT是指红细胞在全血中所占的体积百分比,在各种原因所引起的贫血患者中水平降低,宫颈癌患者中HCT水平显著降低,Ⅲ~Ⅳ期患者水平比Ⅰ~Ⅱ期患者降低,AUC为86.28%,最佳截断值为37.7%,灵敏度为77.66%,特异度为82.5%。SCC是糖蛋白的一种,主要表达于子宫、肺及头颈等鳞状上皮细胞胞质内,当这些细胞出现癌变后,SCC释放到血液导致其水平增高,SCC是宫颈癌的首选肿瘤标志物,还可以对宫颈癌患者进行辅助分期[22-23]。本研究中SCC诊断宫颈癌的AUC为88.16%灵敏度69.37%,特异度97.37%,与暴晓琳等[24]的研究相符,该研究指出SCC水平随临床分期的增加而增加,诊断的灵敏度为68.08%,特异度为89.22%。CA125是从卵巢囊腺癌细胞中筛选的抗原,有研究显示宫颈腺癌中CA125水平比鳞癌显著升高[9-10],本研究中显示腺癌中CA125水平与鳞癌比较差异无统计学意义(P>0.05),可能与腺癌样本量较少有关。本研究发现HCT、SCC、CA125三者联合检测诊断宫颈癌的AUC为95.26 %,灵敏度为89.06%,特异度为92.63%,与单独应用各项指标比较诊断效能得到了较大的提高。HCT、SCC、CA125联合检测能提高HPV阴性的宫颈癌患者的检出率,这对于HPV检测阴性的人群是宫颈癌筛查的一个很好的补充项目。对于宫颈癌的治疗,原则上早期宫颈癌以手术治疗为主,中晚期宫颈癌以放疗为主,化疗为辅[25]。化疗药物采用以铂类(主要是顺铂,顺铂不耐受者可采用卡铂)为基础的单药或联合化疗,放疗采用远距离体外照射(体外照射)和近距离腔内照射(后装治疗),根据分期不同宫颈癌的放疗剂量也不同,对于早期Ⅰ、ⅡA期宫颈局部肿瘤小的患者,A点总剂量为75~80 Gy,局部肿瘤大或晚期(Ⅲ期以上)患者A点总剂量≥85 Gy(A点总剂量为盆腔体外照射联合后装治疗换算后的总的生物等效剂量)[26]。本研究中宫颈癌的治疗以盆腔调强放疗联合奈达铂化疗(每周1次,奈达铂不耐受者采用顺铂)为主。SCC、CA125的水平在患者进行放疗、化疗后显著降低,说明其可以作为宫颈癌患者放、化疗疗效观察的指标。
本研究通过将HCT、SCC、CA125联合检测应用于宫颈癌的诊断、治疗及肿瘤分期、病理类型判断,发现其具有很高的实用价值,且这3项指标均为临床常用的检查项目,应用起来简单便捷,适合在临床推广,从而有助于宫颈癌的早期诊断,提高HPV阴性宫颈癌的检出率,并能够辅助病理分期及作为放化疗疗效评估的有效指标。

