HLA-DRB1*04位点下IL-34和CSF-1表达水平对广西肝癌家族聚集性的影响*
李晓晴,李国坚,吴健林,彭金林,劳晓洁
(广西医科大学第一附属医院,南宁 530021)
原发性肝细胞癌(hepatocellular carcinoma,HCC)是我国肿瘤致死病因第2 位[1]。广西是HCC高发区之一,HCC 高发的同时存在明显的家庭聚集现象,发生2 例及以上HCC 的家庭占HCC 家庭的33.9%[2]。本课题前期研究结果表明,机体的遗传因素(HLA-DRB 等位基因)[3-5]和机体的免疫状态[6-8]等因素与广西HCC 发病密切相关,携带HLA-DRB1*04可能与广西HCC 高发区HCC 家族聚集性存在相关性,而HLA-DRB1*04 等位基因与乙肝病毒(HBV)的感染并无明显相关[3-5]。有研究报道,白细胞介素-34(interleukin-34,IL-34)和集落刺激因子-1(colony stimulating factor-1,CSF-1)可能与HCC 的发生发展密切相关[9-13]。IL-34 和CSF-1 均可以与集落刺激因子-1受体(colony stimulating factor-1 recep‐tor,CSF-1R)相结合而激活不同的信号通路并调控巨噬细胞功能[9]。本研究以HLA-DRB1*04 基因位点对广西HCC 家族聚集性作用研究为基础[3],进一步探讨CSF-1 和IL-34 表达水平以及HLA-DRB1*04 基因位点下CSF-1 和IL-34 表达水平对广西HCC家族聚集性的影响,现将结果报道如下。
1 对象与方法
1.1 研究对象
从已完成HLA-DRB1*04 基因位点检测的研究对象中收集HCC 高发家族无癌成员51 名作为高发家族成员组。选取广西地区未发生过任何肿瘤的家族成员49 名作为无癌家族成员组。高发家族成员组纳入标准:(1)直系血亲中发生过2例及以上肝癌患者的HCC 家族成员;(2)本身未发生过任何肿瘤;(3)已完成HLA-DRB1*04 基因位点检测。排除标准:(1)有丙型肝炎病毒、甲型肝炎病毒、丁型肝炎病毒和戊型肝炎病毒感染史;(2)有酒精性肝炎、脂肪肝、自身免疫性肝病等肝病病史。(3)不能配合本研究者。两组一般资料相比较,差异无统计学意义,具有可比性,见表1。本研究通过本院伦理委员会批准,所有研究对象均签署知情同意书。
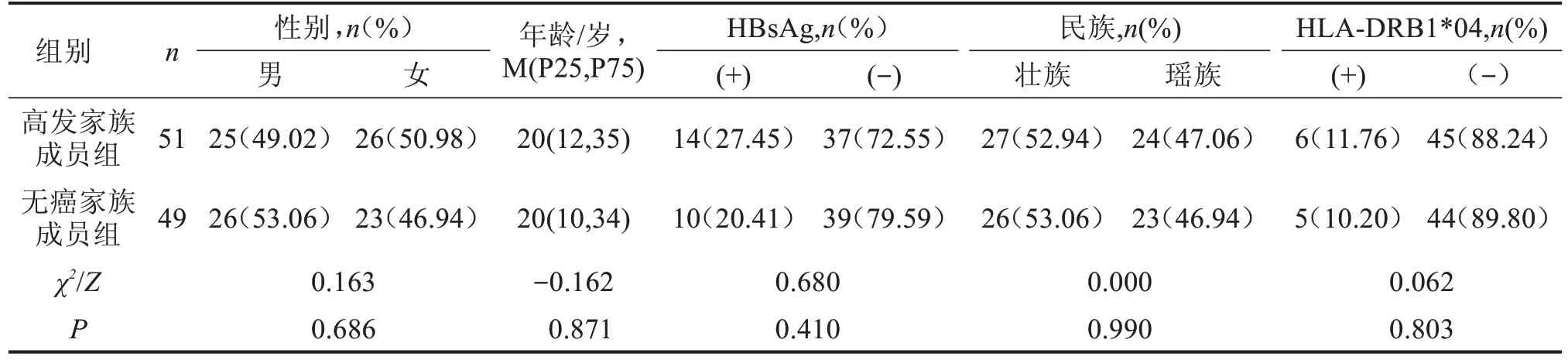
表1 两组一般资料比较
1.2 方法
1.2.1 样本采集及处理方法 采集研究对象空腹外周静脉血液标本3 mL置于普通干燥无菌试管内,室温血液自然凝固10~20 min,4 °C 离心20 min(2 000~3 000 r/min)。仔细收集上层血清并转移至无菌EP 管进行分装、编号,并置于−80 ℃超低温冰箱冰冻保存待测。
1.2.2 IL-34 和CSF-1 表达水平的检测 应用酶联免疫吸附试验(ELISA)技术测定所有受检标本外周血IL-34和CSF-1水平。严格按照ELISA 试剂盒(江苏酶免生物技术有限公司) 使用操作方法进行操作:准备试剂,样品和标准品,在酶标包被板上加入准备好的样品和标准品,37 °C 反应30 min,洗板5次,加入酶标试剂,37°C 反应30 min,洗板5次,加入显色液A、B,37°C 显色30 min,加入终止液。15 min 内通过美国伯乐Bio-Rad i Mark 全自动酶标仪测定被测标本吸光度(optical density,OD)值,严格按照全自动酶标仪说明书操作。绘制标准曲线,计算样品浓度。
1.3 统计学方法
采用SPSS22.0 软件处理数据,偏态分布计量资料以中位数(四分位数)[M(P25,P75)]表示,组间比较采用两独立样本Mann-WhitneyU检验;计数资料以百分率(%)表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组IL-34和CSF-1表达水平比较
高发家族成员组IL-34 表达水平显著高于无癌家族成员组(P<0.05);高发家族成员组和无癌家族成员组的CSF-1 表达水平相比较,差异无统计学意义(P>0.05),见表2。
2.2 HLA-DRB1*04 基因位点阳性组和阴性组IL-34和CSF-1的表达水平比较
HLA-DRB1*04基因位点阳性组IL-34和CSF-1表达水平均显著高于阴性组(P<0.05)。见表3。
2.3 HBsAg阳性组和阴性组IL-34和CSF-1表达水平比较
HBsAg 阳性组IL-34 和CSF-1 表达水平显著低于HBsAg阴性组(P<0.05),见表4。

表2 两组IL-34 和CSF-1表达水平比较 pg/mL,M(P25,P75)
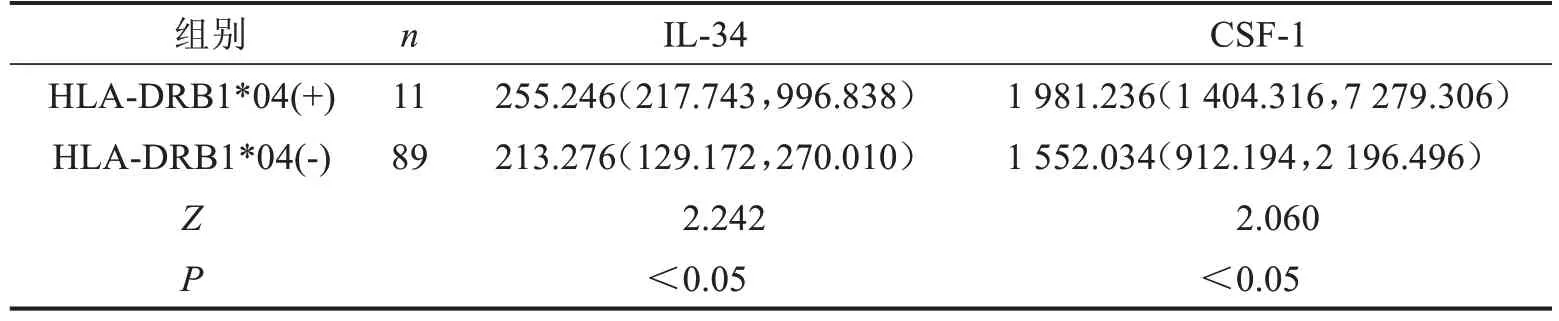
表3 HLA-DRB1*04基因位点阳性组和阴性组IL-34和CSF-1的表达水平比较 pg/mL,M(P25,P75)

表4 HBsAg阳性组和阴性组IL-34和CSF-1表达水平比较 pg/mL,M(P25,P75)
3 讨论
HCC 是常见的消化系统恶性肿瘤之一,其高危因素包括HBV 感染、HCC 家族史等[14]。此外,多种Th1/Th2细胞相关因子亦与广西HCC的家族聚集性密切相关[15]。IL-34 和CSF-1 可通过调控肿瘤相关巨噬细胞的极化和功能,继而影响肿瘤免疫微环境[16]。本课题组前期研究表明,免疫失衡对广西HCC的家族聚集性也起到一定作用[15],IL-34 和CSF-1 表达水平在广西HCC 高发区中HCC 家庭聚集性的作用如何,以及HLA-DRB1*04 等位基因位点是否通过对细胞因子IL-34 和CSF-1 表达水平的影响从而导致HCC 的家族聚集性发生需要进一步探讨。
本研究通过对HCC 高发家族成员组及无癌家族成员组IL-34和CSF-1表达水平的比较,结果发现HCC 高发家族成员组IL-34 表达水平显著高于无癌家族成员组(P<0.05),而CSF-1 表达水平在两组间比较,差异无统计学意义(P>0.05)。提示IL-34 表达水平与广西HCC 家族聚集性存在一定关系,而CSF-1 表达水平未见与广西HCC 家族聚集性相关,也不除外样本量不足所致。IL-34 和CSF-1 均可诱导巨噬细胞的M2 极化,但在不同的组织细胞中存在表达和功能的差异[17]。IL-34 比CSF-1 诱导产生的M1 极化巨噬细胞表达高水平IL-10 的能力更强[13],IL-10 可以抑制Th1 细胞的分化和效应器功能[18],诱导巨噬细胞向M2方向极化,使HCC 高发家族成员免疫微环境可能长期处在一种轻微炎症的状态中,引起外周血清IL-1β 表达升高[7]。IL-1β 可以通过调节核因子-κΒ(NF-κΒ)介导应激细胞中IL-34mRNA 水平,刺激骨髓中单核细胞向巨噬细胞分化[9]。IL-34 在肝组织中持续高表达,血液循环中95%的CSF-1 在肝脏中被巨噬细胞清除[10],这可能限制了CSF-1在肝脏中功能的发挥,因此表现出IL-34 与广西HCC 家族聚集发生关系可能较CSF-1 更为密切。
本课题组前期研究发现,HLA-DRB1*04 是广西HCC 高发区HCC 易感因子,但可能不是通过提高HBV 的感染率而导致HCC 的发生[3],至于HLADRB1*04 等位基因是如何导致HCC 的易感,其免疫机理如何有待进一步探讨。国外有研究发现,HLA-DRB1*04基因亦是埃及地区人群HCC发生的危险因素[19]。本研究以前期研究为基础,分析发现HLA-DRB1*04 阳性组IL-34 和CSF-1 的表达水平均显著高于HLA-DRB1*04 阴性组(P<0.05)。提示IL-34和CSF-1的高水平表达可能受到HLA-DRB1*04 等位基因的影响,HLA-DRB1*04 等位基因通过影响IL-34和CSF-1的高水平表达,引起免疫失衡从而导致HCC 家族聚集性的发生。由于IL-34 和CSF-1 在体内的分布不均,因而在进行HCC 高发家族成员和无癌家族成员比较时IL-34 较CSF-1 与HCC 家族聚集的关系更为密切。有研究发现,携带HLA-DRB1*04 等位基因的人群中促炎因子IL-6 的表达水平升高[20]。在炎症环境中,IL-34具有更强大的促进肝脏Kupffer细胞M2极化的能力[17],M2极化的Kupffer细胞可以诱导Th2型免疫应答,对炎症刺激不敏感、抗原提呈能力低下导致肝脏非典型增生细胞发生免疫逃逸,进而促进癌前病变向HCC发生发展[21]。
国内外许多研究均已证明HBV 感染与HCC 的发生关系极为密切。本研究发现,HBsAg 阳性组IL-34 和CSF-1 表达水平较HBsAg 阴性组均显著下降(P<0.05),提示广西HCC 高发家族成员在HCC发生的过程中,HBV 的感染并不是通过提高IL-34和CSF-1 高水平表达而引起HCC 的易感,也表明IL-34和CSF-1导致HCC易感可能与HBV感染所起作用的途径各异,可能并不存在协同作用。尽管有研究发现,HBV 感染后损伤的肝脏中IL-34 和CSF-1 的表达水平上升,但这可能是肝脏中的Kupffer 细胞及肝星状细胞被慢性激活而非HBV 感染引起的[22]。HCC 癌旁组织较HCC 组织IL-34 表达高,提示IL-34 可以通过介导TAMs 浸润和增殖影响HCC的发生发展[23]。此外,IL-34 还可能通过miR-28-5p-IL-34-TAMs反馈环,调节HCC的转移和进展[21]。这些研究结果提示,在广西HCC 发生的过程中除了HBV 感染的作用外,遗传因素通过对细胞因子的影响,引起体内免疫微环境状态的变化,从而促进HCC的发生发展。
- 广西医科大学学报的其它文章
- Effect of miR-200a-3p targeting transthyretin(TTR)on the biological behavior of placental trophoblasts in hypertensive disorder complicating pregnancy
- 沙利度胺对重型β地中海贫血患者红系细胞γ珠蛋白基因表达及分化的作用研究*
- CEMIP调控Src/AKT/STAT3信号通路对非小细胞肺癌上皮间质转化及细胞侵袭、迁移的影响*
- 乳铁蛋白对正畸复发移动过程中牙周改建的影响*
- 秦皮苷对脂多糖诱导的软骨细胞氧化应激和炎症因子的影响*
- miR-133b-3p对大鼠脑缺血/再灌注损伤的影响及其作用机制*

