青春期巨大卵巢无性细胞瘤伴颈部淋巴结转移1例并文献复习
辛玉琦,田蕾,王晓慧
卵巢无性细胞瘤是卵巢恶性生殖细胞瘤,来源于尚未分化以前的原始生殖细胞,临床发病率低且缺乏典型早期症状,主要表现为腹痛及腹部肿块,合并颈部淋巴结转移病例报道较少。本文报道青春期巨大卵巢无性细胞瘤伴颈部淋巴结转移1例并就相关文献进行讨论,以期为临床诊治工作提供指导。
1 病例摘要
患者,女,15岁,因下腹痛4天,发现左侧颈部淋巴结肿大3天于2019年04月18日收入兰州大学第一医院。患者平素月经规律,初潮12岁,3~5天/28~30天,末次月经:2019年03月21日。查体:左侧颈部可触及一5 cm×4 cm肿物,妇科检查:外阴发育正常,未婚未产型,腹部可触及一大小约25 cm×15 cm肿块,质硬,位置固定,压痛阳性,肛查:子宫后位,活动度欠佳,双侧附件触诊不清。妇科B超:盆腔实性包块(大小约179 mm×109 mm的不均匀低回声,边界清,形态规则),见下页图1。颈部彩超:左锁骨上肿大淋巴结(大小约50 mm×28 mm,边界尚清,形态尚规则)。全腹MRI:腹盆腔及腹膜后多发巨大异常强化占位,血供丰富,腹膜后多发淋巴结增大,部分融合,考虑恶性病变并腹膜后淋巴结转移。颈部及胸部CT:颈部Ⅲ、Ⅳ、Ⅴ、Ⅶ区多发淋巴结肿大,最大者位于左侧V区,最大截面约50 mm×28 mm,见下页图2。纵隔淋巴结肿大。颈部淋巴结穿刺活检:找到转移瘤组织,考虑为无性细胞瘤(多来自卵巢),免疫组化结果:CK7(-),CK20(-),Villin(-),inhibin-a(-),p53(10%),CD45(-),CD38(-),CD138(-),HMB45(-),Melan-A(-),CD31(-),vimentin(局灶1+),ki67(40%),CD99(-),NSE(-),CD56(局灶1+),CgA(-),Syn(-),ckp(-),EMA(-),S-100(个别细胞1+),myoD1(-),Desmin(-),H-caldesmon(-),CD34(-),CD117(1+),DOG1(-),MPO(1+),PLAP(3+),见下页图3。生化:乳酸脱氢酶(lactate dehydrogenase,LDH) 2 533.00 U/L,肿瘤标志物:CA199 50.4 U/mL。
经院内多学科团队讨论后,分别于2019年05月08日、2019年06月25日予以BEP方案(依托泊苷100 mg/m2·d iv-drop d1-d5+顺铂20 mg/m2·d iv-drop d1-d5+博来霉素15 mg/m2/d im d1-d2)化疗,化疗后肿瘤标志物及LDH逐渐降至正常,触诊颈部淋巴结缩小,腹部肿块明显缩小至11 cm×6 cm。2019年07月29日,B超示左侧附件区实性占位性病变(大小约96 mm×59 mm),盆腔MRI示盆腔团块样异常信号占位(盆腔内可见等T1稍长T2团块信号影,大小约10.1 cm×7.6 cm,内见多发分隔)。于2019年8月6日行腹腔镜左侧附件切除术+盆腔淋巴结清扫术+腹主动脉旁淋巴结清扫术+大网膜活检术+腹腔引流术。术中见:左侧卵巢处有一大小约9 cm×8 cm的肿瘤,色白,表面光滑,活动度可,输卵管与瘤体界限不清,腹腔内少量清亮腹水,吸出后送脱落细胞学检查,子宫及右侧附件未见明显异常,膈面光滑,肝、脾、胃、大网膜、阑尾未见异常,盆腔淋巴结未见肿大,腹主动脉旁淋巴结增大,约5 cm×4 cm大小,质硬,术程顺利。术后脱落细胞涂片检查:找到异型成分。术后病检回报:1.(左侧卵巢)结合临床病史,符合无性细胞瘤化疗后改变,未找到残余瘤组织;2.(左侧输卵管)充血、水肿,未见异型成分;3.(另送大网膜)充血、水肿,未见异型成分;4.(另送左侧盆腔淋巴结)未见转移瘤(0/20);(另送右侧盆腔淋巴结)未见转移瘤(0/23);(另送腹主动脉旁淋巴结)未见转移瘤(0/12),免疫组化结果:PLAP(-),CD117(-),ckp(-),vimentin(-),ki67(10%),CD45(+),见图4。术后辅以化疗,分别于2019年9月5日、2019年10月8日、2019年11月4日、2019年12月16日给予BEP方案化疗。
2 讨论
卵巢无性细胞瘤是最常见的卵巢恶性生殖细胞瘤(ovarian malignant germ cell tumors ,OMGCTs),占原发性卵巢肿瘤的1%~2%,占OMGCTs的32.8%~37.5%[1]。3/4的病例发生于年龄小于30岁的女性。无性生殖细胞瘤可能与性腺发育不良或性发育不良有关[2]。患者通常表现为腹痛和腹部肿块,少数患者由于肿瘤扭转、出血或破裂而出现急腹症。
血清肿瘤标志物水平升高可作为初始诊断、治疗监测和治疗后监测的辅助手段。无性细胞瘤中含有分泌LDH和碱性磷酸酶的合胞滋养层巨细胞,血清LDH和碱性磷酸酶常非特异性升高,血清人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)和甲胎蛋白(alpha fetoprotein,AFP)的升高也有报道[3],该患者治疗前LDH升高,化疗后LDH成倍下降,说明连续测量这些标记物可监测疾病的发展。超声为首选的辅助检查手段,其表现为分多个小叶,回声不均匀,小叶轮廓光滑,边界清晰,彩色多普勒和功率多普勒上血管化丰富[4]。CT、MRI亦可有助于诊断,CT显示无性细胞瘤以实性肿瘤为主,间隔增强,囊性变区可能代表出血或坏死,MRI最特征性的表现是由纤维血管隔分隔成小叶的实性肿块,无性细胞瘤在T1加权像上相对于肌肉呈低信号,在T2加权像上呈等强度或稍高强度[5],多房囊性肿块伴有乳头状突起和不规则分隔,类似上皮性卵巢肿瘤的磁共振成像也有报道。但该患者影像学检查结果不典型,也为其早期诊断带来一定困难。
由于该病例发现已于晚期,已有多处颈部淋巴结转移,因此在淋巴结穿刺活检取得肿瘤病理类型后再制定治疗方案是该病例的独特之处,而无性细胞瘤的病理特点也较为典型,易于分辨。卵巢无性生殖细胞瘤由均匀分布的圆形细胞组成,这些圆形细胞类似于原始生殖细胞,胞浆透明或嗜酸性,核呈圆形或扁平状,内有一个或几个突出的核仁,细胞可排列成片状、巢状、索状、小梁状,由纤维间质分隔,并被T淋巴细胞浸润,高达20%的病例间质出现肉芽肿性反应,偶尔可呈结节样。无性细胞瘤具有如下特征性的免疫组化:SALLA-4 (弥漫性、核表达)、OCT4(核表达)、D2-40(膜质和细胞质表达)和CD117(约80%的病例中膜性强表达)。CD117的表达可能与KIT突变的发生有关,这一发现的治疗意义尚待确定。在无性细胞瘤中可能表达的其他免疫组织化学标记包括AFP(局灶性)、细胞角蛋白(高达1/3的病例中局灶性点状到弥漫性细胞质染色)。由于上皮膜抗原(epithelial membrane antigen,EMA)在无性细胞瘤中不表达,因此可以作为卵巢癌的排除标志物[6-7]。

图1 盆腔B超图图2 颈部CT图
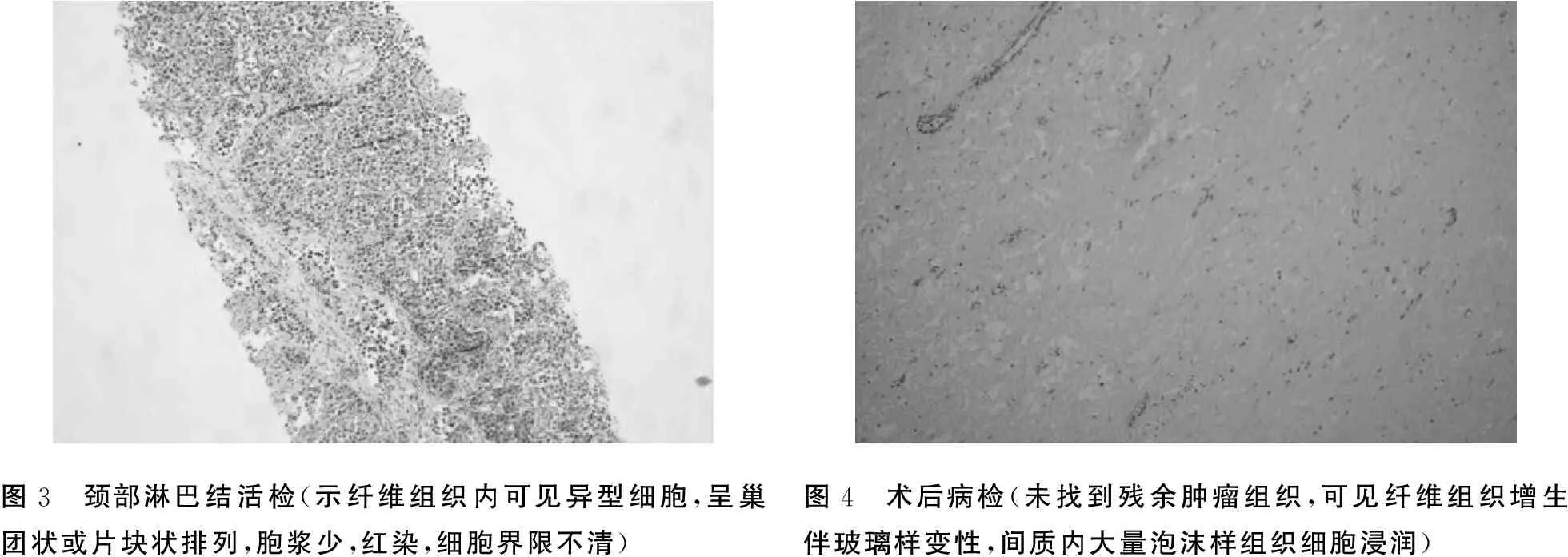
图3 颈部淋巴结活检(示纤维组织内可见异型细胞,呈巢团状或片块状排列,胞浆少,红染,细胞界限不清) 图4 术后病检(未找到残余肿瘤组织,可见纤维组织增生伴玻璃样变性,间质内大量泡沫样组织细胞浸润)
由于该病例腹部包块较大,为缩小腹部包块及肿瘤负荷,经多学科讨论后制定先化疗后手术的治疗方案,无性细胞瘤为卵巢生殖细胞肿瘤,因此采用BEP方案化疗。但该患者发病年龄较小,手术方式为保留生育功能的手术治疗,研究表明切除子宫及双附件后并不会改善患者预后[8]。尽管所有的卵巢无性细胞瘤都是恶性的,但单侧肿瘤的单侧输卵管卵巢切除术的治愈率高达96%,且由于其对化疗敏感性,那些已经扩散到卵巢以外的肿瘤通常也可治愈,总生存率超过80%[9]。
该病例中,患者以腹痛伴颈部淋巴结肿大为首发症状就诊。虽然有一些病例报告无性细胞瘤合并盆腔或主动脉旁淋巴结转移,但少有报告合并颈部淋巴结转移。当淋巴结中发现大而圆的细胞时,需与淋巴瘤、黑色素瘤转移、绒毛膜癌进行鉴别,免疫组化可为其鉴别提供主要依据[10]。
卵巢无性细胞瘤由于缺乏早期临床症状,多数患者确诊已到晚期,但积极治疗后通常预后良好。该患者随访至今,生存良好,一般情况可,复查盆腔MRI及血清肿瘤标志物无明显异常,未见肿瘤复发。

