花生主要碳代谢指标与根瘤固氮能力的关系
郑永美,周丽梅,郑亚萍,吴正锋,孙学武,于天一,沈 浦,王才斌*
(1 山东省花生研究所,山东青岛 266100;2 烟台市农业技术推广中心,山东烟台 264001)
氮素是作物生命活动的物质基础,在作物的生长发育过程中发挥着极其重要的作用。花生根系着生根瘤,可有效供给花生生长所需要的氮素营养,是花生最重要的氮素来源之一[1-3]。减少氮肥施用量,甚至不施用氮肥,充分发挥根瘤菌固氮潜力和土壤供氮能力,满足花生对氮素的需求,是国内外公认的花生节氮、高效、生态栽培最有效的途径,也是未来种植花生的方式[4-6]。
为提高花生根瘤固氮能力,前人从氮肥形态、氮肥水平、基因型、微肥和根瘤菌肥 (剂)等方面已开展不少研究。Wang等[4]对不同形态氮肥的研究表明,提高根瘤固氮的供氮能力以酰胺态氮肥较为适宜,酰胺态氮处理根瘤固氮贡献比例较其它形态氮肥高15%以上。张翔等[7]研究了氮肥用量对花生结瘤和根瘤固氮的影响,花生根瘤固氮潜力随氮肥施用量的增加而减少。郑永美等[8]在高肥力土壤条件下,研究了20个基因型花生根瘤固氮差异性,发现根瘤固氮积累量和收获指数遗传变异系数均高于肥料氮和土壤氮,而且与花生产量呈显著正相关。而根瘤固氮也是一个耗能的过程。Finn等[9]和吴静等[10]研究发现,提高大豆 CO2浓度,增加光照强度等提高植物光合作用,可以提高根瘤菌侵染结瘤和固氮能力,而降低植物光合作用则会降低根瘤菌的固氮能力。Rogers等[11]和Larrainzar等[12]进一步研究发现,成熟根瘤进行固氮作用时,转运到根瘤内的光合产物通过糖酵解途径释放能量,根瘤内固氮酶才可以将N2转变为NH4+,最终氮素以天冬酰胺的形式转运出根瘤。马家斌等[13]和赵江涛等[14]对大豆研究,同样认为增强地上部光合能力,增加成熟根瘤的碳水化合物的供应量,可以增强根瘤生理活性和根瘤固氮能力。崔伟等[15]对7种豆科作物的研究表明,盛花期干物质积累与根瘤质量呈正相关关系。
光合作用是植物将光能转换为可用于生命过程的化学能并进行有机物合成的生物过程,是能量积蓄和干物质积累的物质基础。叶片是花生进行光合作用的主要器官,叶绿素是光合作用的光敏抑制剂,净光合速率是光合特性的综合反映,也是花生光合能力大小的直接指标,而且叶片的叶绿素含量与净光合速率密切相关[16-17]。叶片中的蔗糖合成酶和蔗糖磷酸合成酶是促使光合产物进入碳代谢途径的关键酶,可溶性糖是碳代谢的主要产物,蔗糖合成酶和蔗糖磷酸合成酶活性直接影响叶片中可溶性糖含量[18-19],碳代谢物质供应能力由不同的碳代谢指标决定。
根瘤固氮依赖宿主体内碳代谢物质的供给,但多为大豆等豆科作物的研究,然而,有关花生根瘤固氮能力与叶片碳代谢特性关系的研究,尤其是碳代谢指标间的相关差异性却鲜见报道。因此,本试验在桶栽条件下,应用15N示踪技术,研究了不同花生品种叶片碳代谢特性及其与根瘤固氮能力的关系,阐明碳代谢指标间与根瘤固氮相关差异性,以期为生产中提高花生根瘤固氮能力和培育根瘤高效固氮花生品种提供科学依据。
1 材料与方法
1.1 试验材料与试验设计
试验在山东省花生研究所莱西试验站 (120°30′17′′E,36°48′47′′ N) 进行。供试花生品种 19 个,包括山东、河南、河北、四川等省份近年来审定或育成的品种 (系),分别为:潍花 2000-1 (WH2000-1)、T104、冀花5号 (JH5)、冀花6号 (JH6)、花育22(HY22)、山花 7 号 (SH7)、豫花 9326 (YH9326)、汕油 523 (SY523)、鲁花 11 (LH11)、天府 20 (TF20)、山花 10 号 (SH10)、白沙 1016 (BS1016)、花育 39(HY39)、花育 626 (HY626)、日本千叶半蔓(RBQYBM)、远杂 9307 (YZ9307)、花育 20(HY20)、红色大白沙 (HSDBS)、日花 1 号 (RH1)。不结瘤系花生属于普通型花生,与19个供试花生品种具有相类似的形态特征和生长习性,但不结瘤系花生根系不着生根瘤,氮素营养来源为肥料供氮和土壤供氮,因此,以不结瘤系花生 (NN-1) 为参照材料,计算土壤氮积累量与肥料氮积累量比例系数,利用比例系数进一步可求得19个供试花生品种根瘤固氮积累量。供试土壤为砂壤土,播种前土壤基本理化性质为碱解氮77.9 mg/kg、速效磷45.6 mg/kg、速效钾 97.8 mg/kg、有机质 12 g/kg、pH 5.9。
试验将直径38 cm、高80 cm的硬化PVC无底圆桶埋置在田间土中,圆桶上边高出地表5 cm,各圆桶间距离80 cm。将田间 0—25、26—50和51—75 cm的土壤按照原土层顺序填入桶内。每桶播4粒种子,出苗后第5天间苗,每桶保留3棵均匀一致的花生植株,桶四周以同样密度种植相同品种花生作保护行。供试氮肥为15N标记尿素,15N丰度为10.3%,购买于上海化工研究院;磷肥为磷酸二氢钾,购买于国药集团化学试剂有限公司;钾肥一部分由磷肥 (磷酸二氢钾) 带入,试验钾肥不足部分由硫酸钾补齐,购买于国药集团化学试剂有限公司。每桶肥料用量为 N 1.02 g (90 kg/hm2)、P2O51.70 g(150 kg/hm2)、K2O 2.04 g (180 kg/hm2)。所有肥料在播种前均匀施入0—25 cm土层中,1桶为1次重复,每个品种15次重复。
1.2 样品采集与测定
于花生结荚期 (出苗后95~105天) 进行花生净光合速率测定,同时每个品种取样12桶,选取主茎倒1叶、倒2叶和倒3叶 (从上往下第1叶、第2叶和第3叶),混合均匀后用于叶绿素含量、可溶性糖含量、蔗糖合成酶 (SS) 活性和蔗糖磷酸合成酶 (SPS)活性的测定;于花生成熟期 (出苗后120~130天) 取样3桶,用于花生整株氮含量和15N丰度的测定。
净光合速率测定:采用英国PP-systems公司生产的CIRAS-1型便携式光合测定系统,于晴天9:00—11:00采用开放式气路测定。选取面向阳光的花生主茎倒3叶进行测定,每个处理重复测定10片叶子。
叶绿素含量测定:按照邹琦[20]介绍的方法,均匀混合3桶花生主茎倒1叶、倒2叶和倒3叶,以95%乙醇为浸提液提取色素,用分光光度计比色法分别在665、649和470 nm处测定吸光值,计算叶片叶绿素a、叶绿素b、类胡萝卜素及总叶绿素的含量。
可溶性糖含量测定:参照《植物生理学实验指导》[21],将3桶花生主茎倒1叶、倒2叶和倒3叶于烘箱中105℃杀青30 min,80℃烘干至恒重,称重后粉碎,采用蒽酮比色法,在630 nm波长下测定吸光度,计算可溶性糖含量。
蔗糖合成酶和蔗糖磷酸合成酶活性测定:参照《现代植物生理学实验指南》[22],选取6桶花生主茎倒1叶、倒2叶和倒3叶,锡箔纸包裹标记后迅速放入液氮中带回室内,于–70℃冰箱中保存,用于蔗糖合成酶和蔗糖磷酸合成酶活性测定。混合均匀的花生叶片冰浴研磨,1000 ×g冷冻离心 10 min 提取粗酶液。粗酶液与pH 7.5的Hepes-NaOH 缓冲液、50 mmol/L 的 MgCl2、100 mmol/L 的 UDPG 和 100 mmol/L的6-磷酸果糖混匀在30℃水浴中反应 30 min后,加入 2 mol/L 的 NaOH 沸水浴 10 min 终止反应,流水冷却至室温后加入30%的盐酸和0.1%的间苯二酚,混匀后80℃水浴10 min,流水冷却至室温,在480 nm波长下测定吸光度,计算蔗糖合成酶和蔗糖磷酸合成酶活性。
氮素含量测定:将洗净的花生植株于烘箱中105℃杀青30 min,80℃烘干至恒量称质量。采用Kjeltec2300全自动定氮仪 (福斯公司,瑞士) 测定氮含量,MAT-271型质谱仪 (菲尼根马特公司,美国)测定样品15N丰度。
1.3 计算公式
参照相关文献[4,8]计算根瘤固氮量,具体公式如下:
全氮积累量 = 干物质量 × 氮素含量
肥料氮积累量 = (全氮积累量 × 样品15N 丰度)/肥料15N丰度
土壤氮积累量/肥料氮积累量 (比例系数) = (不结瘤系花生全氮积累量 – 不结瘤系花生肥料氮积累量)/不结瘤系花生肥料氮积累量
土壤氮积累量 = 肥料氮积累量 × 比例系数
根瘤固氮积累量 = 全氮积累量 – 土壤氮积累量 –肥料氮积累量
1.4 数据处理
采用 Microsoft Excel 2010 进行数据统计分析和制作图表;不同花生品种间的差异显著性采用SPSS软件按照Duncan’s 法进行多重比较;各项指标间的相关性分析采用SPSS软件,按照Correlate Birariate进行。
2 结果与分析
2.1 花生叶片碳代谢特性
2.1.1 叶绿素含量 花生叶片叶绿素含量品种间存在显著差异 (表1)。叶绿素a、叶绿素b、类胡萝卜素和总叶绿素的变异幅度分别为1.57~2.54、0.61~0.96、0.28~0.44 和 2.47~3.93 mg/g,变异系数分别为15.4%、12.5%、12.9%和14.0%,表明叶片叶绿素含量遗传变异性大小表现为叶绿素a > 总叶绿素 >类胡萝卜素 > 叶绿素b。由表1还可以看出,叶绿素a、叶绿素b、类胡萝卜素和总叶绿素含量均以日本千叶半蔓最高,日花1号最低,最高值分别是最低值的1.62、1.57、1.57和1.59倍。

表1 各品种花生叶片叶绿素含量 (mg/g)Table 1 Chlorophyll content in leaves of the tested peanut cultivars
2.1.2 净光合速率 不同花生品种叶片净光合速率差异显著 (图 1),平均值为 21.7 μmol/(m2·s),变异幅度为 14.5~29.7 μmol/(m2·s),变异系数为 21.5%,净光合速率最大值约是最小值的2.0倍。叶片净光合速率低于平均值的品种有9个,其中日花1号净光合速率最小,较平均值低30.0%以上,依照净光合速率由高到低依次为花育39号 > 花育22号 > 远杂9307 > 山花 10 号 > 山花 7 号 > 红色大白沙 > 汕油523 > 花育 626 > 日花 1 号,其中汕油 523 和花育626差异不显著;净光合速率高于平均值的品种有10个,其中豫花9326净光合速率最大,较平均值高36.9%,依照净光合速率由高到低依次为豫花9326 > 日本千叶半蔓 > 天府 20 > T104 > 冀花 6 号 >鲁花 11 > 花育 20 号 > 冀花 5 号 > 白沙 1016 > 潍花2000-1,其中豫花9326和日本千叶半蔓、T104和冀花6号、花育20号和冀花5号差异未达显著水平。

图1 不同品种花生叶片净光合速率Fig. 1 Net photosynthetic rates of different peanut cultivars
2.1.3 可溶性糖含量 叶片可溶性糖含量在不同花生品种间存在显著性差异,变异幅度为2.9%~5.0%,变异系数为19.2%,可溶性糖含量以日本千叶半蔓最高,约是可溶性糖含量最低品种日花1号的1.9倍(图2)。不同花生品种叶片可溶性糖含量平均值为3.8%,可溶性糖含量最低品种日花1号较平均值低28.3%,而可溶性糖含量最高品种日本千叶半蔓则较平均值高34.4%。低于平均值的花生品种有10个,依照可溶性糖含量由高到低依次为白沙1016 > 潍花2000-1 > 花育 39 号 > 花育 22 号 > 山花 10 号 > 山花7 号 > 花育 626 > 汕油 523 > 远杂 9307 > 日花 1 号,其中潍花2000-1和花育39号差异未达显著水平,山花7号、花育626、汕油523和远杂9307无显著性差异;高于平均值的花生品种有9个,依照可溶性糖含量由高到低依次为日本千叶半蔓 > 豫花9326 >天府 20 > 花育 20 号 ≈ T104 > 冀花 6 号 ≈ 红色大白沙 > 鲁花 11号 > 冀花 5号,其中天府 20、花育20号和T104差异不显著,冀花6号和红色大白沙差异不显著。
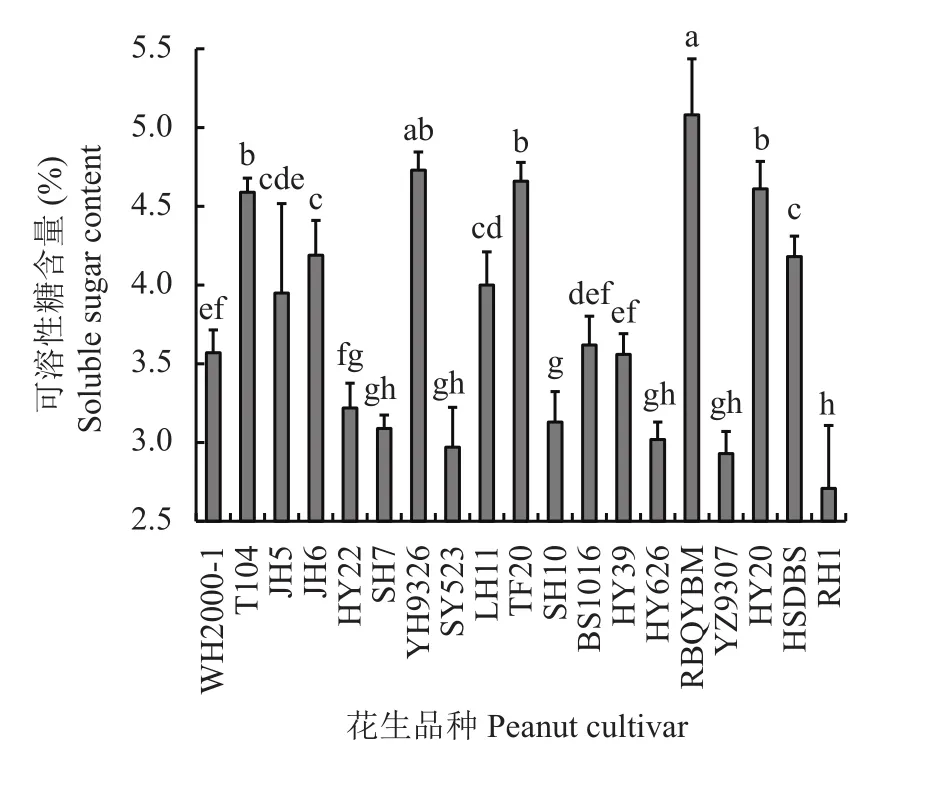
图2 不同品种花生可溶性糖含量Fig. 2 Soluble sugar content of different peanut cultivars
2.1.4 蔗糖合成酶活性 不同花生品种叶片蔗糖合成酶活性存在显著性差异,品种间变异幅度为38.5~72.4 mg/(g·h), FW,变异系数为 18.4%,蔗糖合成酶活性以日本千叶半蔓最高,约是蔗糖合成酶活性最低品种日花1号的2.0倍 (图3)。不同花生品种蔗糖合成酶活性平均值为 58.6 mg/(g·h), FW,蔗糖合成酶活性最低品种日花1号较平均值低34.3%,蔗糖合成酶活性最高品种日本千叶半蔓较平均值高23.6%。蔗糖合成酶活性低于平均值的花生品种有8个,依照蔗糖合成酶活性由高到低依次为花育39号 > 花育22 号 > 山花 10 号 > 山花 7 号 > 汕油 523 > 远杂9307 > 花育 626 > 日花 1 号,其中花育 22 号和山花10号间无显著性差异;蔗糖合成酶活性高于平均值的花生品种有11个,依照蔗糖合成酶活性由高到低依次为日本千叶半蔓 > 豫花 9326 > 天府 20 > T104 >花育 20 号 > 冀花 6 号 ≈ 鲁花 11 号 > 红色大白沙 >冀花 5 号 ≈ 白沙 1016 > 潍花 2000-1,其中冀花 6 号和鲁花11号几乎无差异,冀花5号和白沙1016几乎无差异,日本千叶半蔓和豫花9326间无显著性差异,天府20和T104间无显著性差异。

图3 不同品种花生蔗糖合成酶活性Fig. 3 Activity of sucrose synthase of different peanut cultivars
2.1.5 蔗糖磷酸合成酶活性 不同花生品种叶片蔗糖磷酸合成酶活性差异性显著 (图4),品种间变异幅度为 12.1~33.4 mg/(g·h), FW,平均值为 24.5 mg/(g·h), FW,变异系数为24.3%。豫花9326叶片蔗糖磷酸合成酶活性最高,较平均值高36.3%,约是蔗糖磷酸合成酶活性最低品种日花1号的2.8倍。叶片蔗糖磷酸合成酶活性低于平均值的品种有11个,依照蔗糖磷酸合成酶活性由高到低依次为花育22号 ≈白沙 1016 > 冀花 5 号 ≈ 潍花 2000-1 ≈ 花育 39 号 >汕油 523 > 山花 10 号 > 山花 7 号 > 花育 626 > 远杂9307 > 日花1号,其中花育22号和白沙1016,冀花5号、潍花2000-1和花育39号间差异不显著;叶片蔗糖磷酸合成酶活性高于平均值的品种有8个,依照蔗糖磷酸合成酶活性由高到低依次为豫花9326> 天府 20 ≈ T104 > 日本千叶半蔓 > 鲁花 11 号 > 花育 20号 ≈ 冀花 6号 > 红色大白沙,其中天府 20、T104和日本千叶半蔓,鲁花11、花育20号和冀花6号间均无显著性差异。

图4 不同品种花生蔗糖磷酸合成酶活性Fig. 4 Activity of sucrose phosphate synthase of different peanut cultivars
2.2 根瘤固氮量
不同花生品种根瘤固氮量差异性达显著水平(图 5),品种间变异幅度为 62.7~160.6 kg/hm2,变异系数为21.7%。不同花生品种根瘤固氮量平均值为115.3 kg/hm2,日本千叶半蔓根瘤固氮量最大,较平均值高39.3%,日花1号根瘤固氮量最小,较平均值低45.6%,而且日本千叶半蔓根瘤固氮量约是日花1号的2.6倍。根瘤固氮量低于平均值的有10个花生品种,依照固氮量由高到低依次为白沙1016 > 潍花 2000-1 > 花育 39 号 > 花育 22 号=山花 10 号 > 山花 7 号 > 汕油 523 > 花育 626 > 远杂 9307 > 日花1号,其中花育22号和山花10号无差异,汕油523和花育626差异不显著。根瘤固氮量高于平均值的有9个花生品种,依照固氮量由高到低依次为日本千叶半蔓 > 豫花 9326 > 天府 20 > T104 > 花育20 号 > 冀花 6 号 > 鲁花 11 > 红色大白沙 > 冀花5号,其中天府20和T104差异不显著,花育20号、冀花6号、鲁花11号和红色大白沙品种间差异亦未达显著水平。

图5 花生根瘤固氮量Fig. 5 Amount of nitrogen fixed by nodules of each peanut cultivar
2.3 花生碳代谢特性与根瘤固氮能力的关系
由图6可以看出,花生叶片叶绿素含量与根瘤固氮能力存在极显著正相关关系,决定系数范围为0.793~0.906。类胡萝卜素含量与根瘤固氮能力相关性最大,决定系数达0.906,叶绿素b和总叶绿素次之,叶绿素a最低。

图6 花生叶片叶绿素含量与根瘤固氮的关系Fig. 6 Relationship among chlorophyll content in peanut leaves and nitrogen fixation ability of root nodule
花生叶片净光合速率和可溶性糖含量均与根瘤固氮能力显著正相关,决定系数分别为0.828和0.908,因此提高花生叶片光合能力和可溶性糖含量可以协同增强根瘤固氮能力 (图7)。
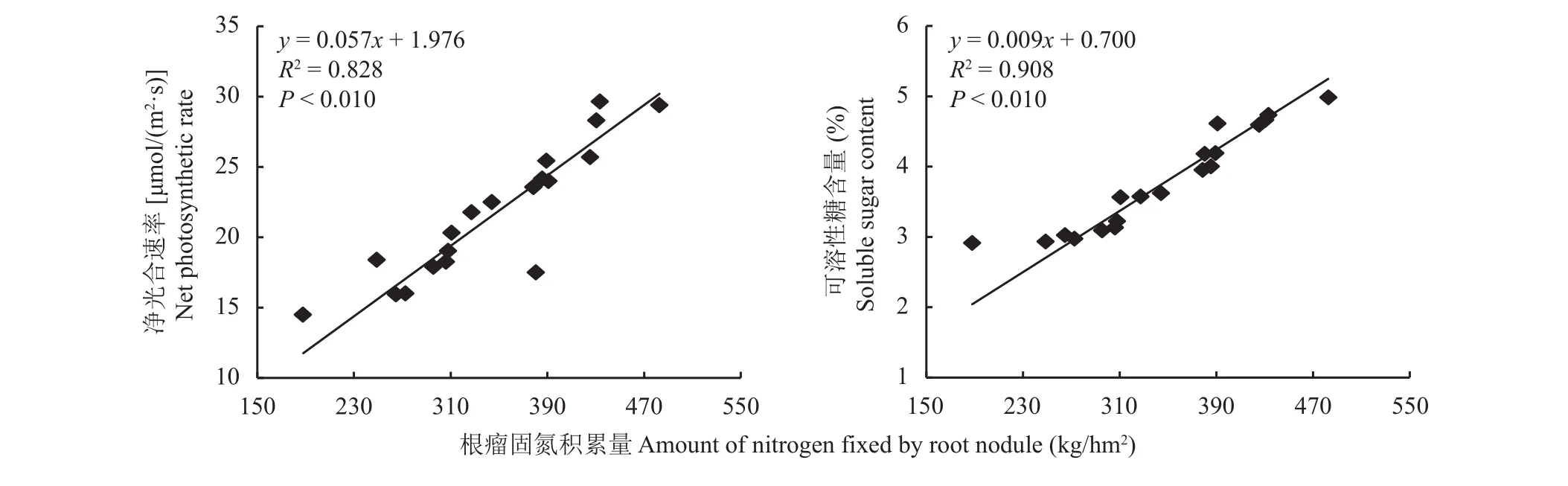
图7 净光合速率、可溶性糖含量与根瘤固氮能力的关系Fig. 7 Relationship among the net photosynthetic rates,soluble sugar content and nitrogen fixation ability of root nodule
蔗糖合成酶和蔗糖磷酸合成酶是催化蔗糖合成的关键酶,其活性高低与同化物质的积累和输出能力密切相关。从图8可以发现,蔗糖合成酶和蔗糖磷酸合成酶活性均与根瘤固氮能力呈正相关关系,且达极显著水平,决定系数分别为0.950和0.894,蔗糖合成酶活性相关系数大于蔗糖磷酸合成酶活性。

图8 蔗糖合成酶和蔗糖磷酸合成酶活性与根瘤固氮能力的关系Fig. 8 Relationship between the activities of sucrose synthase and sucrose phosphate synthase and the nitrogen fixation ability of root nodule
综合分析可以发现,反映叶片碳代谢特性的各指标与根瘤固氮能力均呈显著正相关,与各指标相关性大小依次为蔗糖合成酶活性>可溶性糖含量 ≈ 类胡萝卜素含量>蔗糖磷酸合成酶活性>总叶绿素含量 ≈ 叶绿素b含量>净光合速率>叶绿素a含量。
3 讨论
3.1 碳代谢特性
作为光能吸收和转换的原初物质,叶片叶绿素构成及其含量直接影响作物的光合作用[23-25]。原小燕等[26]研究表明,施用氮肥能够促进花生叶片叶绿素含量的增加,但氮肥水平超过一定范围,叶绿素含量的增速会逐渐降低。化控也可显著提高花生叶片叶绿素含量,增强花生叶片保绿性和保持较大的绿叶面积,而且化控时间越早效果越显著[27-28]。本试验表明,花生叶片叶绿素含量在品种间存在显著性差异,叶绿素a、叶绿素b、类胡萝卜素和总叶绿素含量品种间变异系数均达12.0%以上,其中以叶绿素a最大,其最高值是最低值的1.6倍,表明花生叶片叶绿素含量不仅受外界条件的调控,而且还具有显著的遗传变异性,会因品种遗传特性而存在较大差异。
光合作用为植物生长发育提供物质和能量,是植物生长发育的基础。国内外学者对花生光合特性开展了大量研究,林松明等[29]研究表明玉米花生间作遮阴会降低花生叶片净光合速率,但增施钙肥在一定程度上可以有效缓解遮阴引起的负效应,净光合速率可达单作不施钙肥处理水平。增施钙钼肥可以显著增强花生光合生理特性,提高蒸腾速率、气孔导度、净光合速率和群体光合势,进而提高花生产量[30]。旱、盐及旱盐双重非生物胁迫对花生光合特性存在显著影响,降低花生净光合速率和叶面积指数等[31-34]。夏花生单粒精播较双粒穴播不仅可以增加花生叶片叶绿素含量,还可以显著提高净光合速率,延缓叶片衰老,维持生育后期较高的光合能力和光合时间[35]。本研究中,叶片净光合速率在花生品种间存在显著性差异,变异幅度为 14.5~29.7 μmol/(m2·s),品种间变异系数为21.5%,日花1号净光合速率最小,较19个品种的平均值低30.0%以上,豫花9326净光合速率最大,较平均值高36.9%。这表明花生叶片净光合速率不仅受光照、养分、水分、种植模式等的影响,还取决于品种的遗传特性,这与吴桂成等[36]、陈四龙等[37]的研究结果基本一致。因此,在花生种质资源中进行品种筛选,选择或培育光合能力较强品种是可行的。
可溶性糖是植物碳代谢的主要产物,是间接反映碳代谢能力的重要指标,可溶性糖含量越高,说明碳代谢能力越强。前人对花生的研究表明,可溶性糖含量受温度、养分、栽培方式等的显著影响[38-40]。本研究表明,不同花生品种间叶片可溶性糖含量存在显著性差异,19个花生品种间变异系数达19.2%,其中日本千叶半蔓可溶性糖含量最高,较19个花生品种平均值高34.4%,约是可溶性糖含量最低品种日花1号的1.9倍。因此,品种基因型也决定着叶片可溶性糖含量,这与马春梅等[41]、崔丽娜等[42]对大豆和玉米的研究结果基本一致。
蔗糖是植物体内碳水化合物贮存和运输的主要形式,叶片中的蔗糖合成酶和蔗糖磷酸合成酶是催化合成蔗糖的关键酶,其活性大小对碳代谢产物的积累和输出能力具有显著影响。孙虎等[43]对花生施氮水平的研究表明,在一定氮肥水平范围内随氮肥水平增加,花生叶片蔗糖磷酸合成酶活性增高,提高叶片蔗糖含量,而过高水平氮肥则减小蔗糖磷酸合成酶活性,降低叶片蔗糖含量,适量水平的氮肥才有利于花生叶片蔗糖的合成。适宜密度的单粒精播较传统双粒播种可以提高花生叶片蔗糖合成酶和蔗糖磷酸合成酶的活性,促进叶片中蔗糖的合成与积累,显著提高生育后期叶片的碳代谢能力[44]。本研究发现,叶片中蔗糖合成酶和蔗糖磷酸合成酶活性均存在显著的遗传变异性,19个品种间蔗糖合成酶和蔗糖磷酸合成酶活性变异系数分别为18.4%和24.3%,其中日本千叶半蔓蔗糖合成酶活性最高,约是活性最低品种的2.0倍,豫花9326蔗糖磷酸合成酶活性最高,约是活性最低品种的2.8倍,因此,基因型 (品种) 是影响蔗糖合成酶和蔗糖磷酸合成酶活性的重要因子,对碳代谢特性具有重要影响,这与前人对大豆[45]、水稻[46]、玉米[47]、油菜[48]等的研究一致。
3.2 根瘤固氮能力
花生有3种氮素来源,分别为土壤氮、肥料氮和根瘤固氮,在施肥条件下,花生氮素有19.2%~49.0%来自土壤氮,6.4%~26.5%来自肥料氮,而24.5%~80.8%来自根瘤固氮[49]。相关研究提出选择酰胺态氮肥[4],合理的氮肥水平和运筹[7,50],选用根瘤固氮高效型品种[6,8]等措施以充分发挥根瘤固氮作用。本文对19个代表不同产区的花生品种研究表明,根瘤固氮量在品种间存在显著性差异,变异系数达20.0%以上,根瘤固氮量以日本千叶半蔓最高,较19个品种的平均值高39.3%,是根瘤固氮量最小品种日花1号的2.6倍,因此,根瘤固氮具有较大的遗传变异性,通过培育高效根瘤固氮花生品种来满足花生对氮素的需求,减少肥料氮和土壤氮的供给,是花生节氮栽培的有效途径,这与郑永美等[8]、李海先等[51]对花生和大豆的研究结果基本一致。
3.3 碳代谢特性与根瘤固氮能力关系
根瘤进行固氮时,根瘤菌固氮酶反应和NH3同化过程需要消耗能量,有研究统计,根瘤固定1 kg氮化合物需要消耗12~17 kg的碳水化合物[52-54]。邹长明等[55]对不同品种小豆研究发现,降低小豆的光合能力,光合产物供应不足会严重抑制根瘤的生长发育。雍太文等[56]对大豆研究表明,大豆地上部较强的光合能力可以为地下根瘤的生长发育及固氮提供充足的能量,促进根瘤固氮能力和大豆产量的提高。本研究对不同花生品种碳代谢特性与根瘤固氮能力关系进行了系统分析,花生叶片叶绿素含量、净光合速率、可溶性糖含量、蔗糖合成酶和蔗糖磷酸合成酶活性均与根瘤固氮积累量呈极显著正相关关系,其中与蔗糖合成酶活性相关性最大,与可溶性糖含量相关性次之,表明,花生的碳代谢能力及碳水化合物的供给能力与根瘤固氮密切相关,这与前人[9,12-13]对大豆的研究结论基本一致。
4 结论
不同花生品种间叶绿素含量、净光合速率、可溶性糖含量、蔗糖合成酶和蔗糖磷酸合成酶活性及根瘤固氮量均存在显著性差异。根瘤固氮量与各碳代谢指标密切相关,决定系数最大可达0.950。不同碳代谢指标间可溶性糖含量及调控蔗糖代谢的蔗糖合成酶活性不仅遗传变异性较大,而且与根瘤固氮量正相关性均达0.9以上,明显高于叶绿素含量、净光合速率和蔗糖磷酸合成酶活性。因此,在花生生产及品种培育中,通过调控碳代谢来提高根瘤固氮能力是可以实现的,而且不同的碳代谢指标间可以首先选择可溶性糖水平和蔗糖合成酶活性。
——固氮微生物

