γ-氨基丁酸对番茄嫁接苗耐盐性的生理调控效应
贾邱颖,吴晓蕾,冀胜鑫,褚新培,赵 峰,宫彬彬,李敬蕊,高洪波
(河北农业大学园艺学院/河北省蔬菜种质创新与利用重点实验室/河北省蔬菜产业协同创新中心,河北保定 071001)
土壤盐渍化是影响植物生长发育的主要非生物胁迫之一,世界上约7%的土地面积和20%的灌溉土地均受到盐渍化的影响[1-2]。盐胁迫常造成植物叶片营养元素缺乏,影响植物光合作用,严重抑制植株生长发育。研究表明,盐胁迫致使植物发生离子毒害,导致植株内活性氧 (ROS) 大量积累,从而使植物体内细胞膜的完整性、各种酶的活性,以及根系对营养物质的获取、叶片中光合器官的功能等都受到高浓度盐分的影响,使植物生长受限,植株表型出现盐害症状[3]。
番茄 (Solanum lycopersicumL.) 作为一种世界性蔬菜作物,土壤盐渍化已成为番茄设施栽培及优质高产的限制因素之一[4],高浓度的盐分导致番茄幼苗体内发生离子失衡和质膜过氧化,通过破坏光合作用等一系列生理过程来抑制番茄生长[5-6]。研究表明,嫁接提高番茄植株耐盐性主要决定于砧木根系的耐盐能力,与降低Na+吸收、Na+截留作用[7],减少ROS积累[8]等途径密切相关,耐盐砧木嫁接后接穗叶片主要表现为光合作用提高、活性氧积累量降低和渗透调节物质的显著积累[9-10]。但是不同番茄砧木耐盐能力存在显著差异,即使耐盐砧木具备对NaCl等盐分胁迫的抵抗能力,其对缓解盐胁迫的作用也是有限的,是否可以通过施用外源物质进一步提高植株耐盐性有待研究。
γ-氨基丁酸 (γ-aminobutyric acid,GABA) 作为一种四碳非蛋白质氨基酸,常被作为一种外源物质施用以缓解植物在生长过程中的逆境伤害[11-12]。研究表明,外源GABA处理通过促进内源GABA的积累显著提高了 150 mmol/L NaCl处理下玉米的耐盐性[13];外源GABA通过加快甜瓜内活性氧代谢,促进抗坏血酸-谷胱甘肽 (AsA-GSH) 循环[14],降低盐胁迫下细胞膜损伤;还可改善生菜和玉米的光合作用并调节活性氧代谢[15-16]等来降低盐胁迫的有害影响。我们前期研究也表明,外源GABA可通过促进盐胁迫下番茄种子萌发、幼苗生长,加速活性氧代谢,提高叶片光合速率,提升番茄幼苗耐盐性[17-20]。但外源施用GABA提高植株耐盐能力的效果是否受植株根系耐盐性或吸收能力的影响尚不明确,而这与生产中GABA的应用效果具有直接联系。
为此,本研究以筛选出的抗盐性最强的番茄品种为砧木,以盐敏感番茄品种为接穗形成嫁接苗,以接穗自嫁接苗作为对照,形成具有根系耐盐性显著差异的番茄嫁接材料,在175 mmol/L NaCl胁迫下,研究外源添加5 mmol/L GABA对盐胁迫下植株生长、Na+积累、氨基酸含量和抗氧化酶活性等指标的影响,阐明外源GABA在提高番茄嫁接苗耐盐过程中的生理调节机制,探讨嫁接植株抗盐能力、离子吸收和生理代谢是否受GABA的调节,GABA提高植株耐盐性是否与幼苗根系存在密切联系,研究结果为生产中外源GABA氨基酸肥料施用及提高蔬菜耐盐性提供理论依据和实践参考。
1 材料与方法
1.1 试验地点与材料
试验在2018年预备试验筛选出耐盐性差异材料及差异显著NaCl处理浓度的基础上,于2019年1—10月在河北省保定市定兴县华农蔬菜专业合作社工厂化育苗基地和河北农业大学试验基地内进行。以耐盐性较强的砧用番茄品种‘OZ-006’(R) 为砧木,用盐敏感番茄品种‘中杂9号’(S) 为接穗形成嫁接苗 (RS),并以‘中杂9号’自嫁接苗 (SS) 为对照,在 175 mmol/L NaCl胁迫下进行培养。
番茄砧木和接穗种子分别购自北京开心格林农业科技有限公司和中国农业科学院蔬菜花卉研究所;GABA购自美国Sigma-Adrich公司。
1.2 试验设计
番茄砧木和接穗种子催芽后用72孔穴盘进行育苗,育苗基质为草炭∶蛭石∶珍珠岩 = 1∶1∶1。待番茄幼苗长至四叶一心时,以番茄品种R作为砧木,S作为接穗,采用劈接法获得嫁接苗 (RS) 及中杂9号自嫁接苗 (SS)。嫁接后15天,选取整齐一致且长势良好的嫁接苗,洗去幼苗根部基质,定植于装有 16 L Hoagland 营养液 (pH 6.5,EC 值 2.0~2.2 mS/cm) 的灰色塑料盆中进行水培,用充氧泵及时补充氧气,保持番茄幼苗正常生长。预培养3天后,分别对SS和RS幼苗进行NaCl (营养液中添加175 mmol/L NaCl,CK) 及 Na+G 处理 (营养液中添加 175 mmol/L NaCl和 5 mmol/L GABA,用“+G”表示)。在处理后不同时间内统计番茄幼苗盐害指数及生长速率,测定幼苗鲜重、干重以及叶绿素、Na+、氨基酸含量和活性氧代谢指标。处理及取样时间为上午8:00,每处理取样15株分别测定生长指标,生理指标测定取样6株,3次重复。
1.3 测定方法
分别在处理0、1、2、4、6天后,每处理选15株幼苗统计测定盐害指数,盐害指数 (%) =∑(N 级苗数 × N 级)/5 级 × 总苗数 × 100[21]。每处理选固定15株幼苗测定其株高(幼苗茎基部至顶部生长点),株高生长速率 = (测定株高-前一次测定株高)/前一次测定株高 × 100%。在处理第 2、4 天,每处理选择15株幼苗分别称量植株鲜重,在烘箱内105℃下杀青10 min后在80℃烘干至恒重,测定植株干重。组织含水量 = (鲜重-干重)/鲜重 × 100%。处理第2、4天后,采用丙酮乙醇 (1∶1) 浸提法测定幼苗叶片叶绿素含量[22]。
分别在处理第2、4 天后,取番茄幼苗叶片及根系烘干样品 100 mg,加入 5 mL HNO3(65%~68%),在微波消化系统中消煮2~3 h,使用原子吸收光谱仪测定 Na+含量[23]。
采用2,4-二硝基氟苯 (FDNB) 柱前衍生、反相高效液相色谱法测定番茄叶片氨基酸含量。分别在处理 2、4 天,取番茄叶片 2 g,按 1∶1 比例 (V/V) 加入10%磺基水杨酸匀浆,于4℃下放置17 h,离心10 min后取上清液,使用1% 2,4-二硝基氟苯进行氨基酸柱前衍生化处理,0.22 μm滤膜过滤后,取20 μL进样,使用安捷伦1260高效液相色谱仪 (检测器为紫外检测器) 进行测定,反相高效液相色谱柱为ZORBAX Eclipse Plus C18 (5 μm,250 mm × 4.6 mm)检测波长为360 nm,柱温40℃,流速为1 mL/min,按外标法计算番茄叶片内氨基酸含量[24]。
分别在处理0、1、2、4、6天后,称取番茄幼苗的叶片和根系0.5 g,测定抗氧化酶活性;超氧化物歧化酶 (SOD) 活性参考 Giannopolitis等[25]的方法测定,以试验反应中抑制氮蓝四唑 (NBT) 光化还原50%作为一个酶活力单位 (U);过氧化物酶 (POD) 活性参考Zeng等[26]的愈创木酚法测定,以OD值变化0.01/min为1个酶活力单位 (U);过氧化氢酶 (CAT)活性采用Dhindsa等[27]方法,以OD值变化0.1/min 为 1 个酶活力单位 (U)。超氧阴离子 () 产生速率参照王爱国等[28]方法测定,丙二醛 (MDA) 含量采用硫代巴比妥酸法测定[29]。的组织化学染色参照Thordal-Christensen等[30]的方法进行。
1.4 数据处理
试验数据使用Excel 2016和SPSS 22.0软件进行处理和统计分析,采用单因素和Duncan法进行方差分析 (P< 0.05 为显著)。
2 结果与分析
2.1 GABA对盐胁迫下番茄幼苗盐害指数及株高生长速率的影响
从表1可以看出,SS和RS幼苗的盐害指数随NaCl胁迫时间延长逐渐增加,但RS幼苗盐害指数显著低于SS幼苗,降低幅度为16.9%~54.5%。在+G处理中,SS和RS幼苗的盐害指数均较对照处理显著下降,但SS幼苗盐害指数降低幅度明显大于RS幼苗,其中SS幼苗的最大降低幅度为54.5%,而RS幼苗最大降低幅度仅为22.7%。
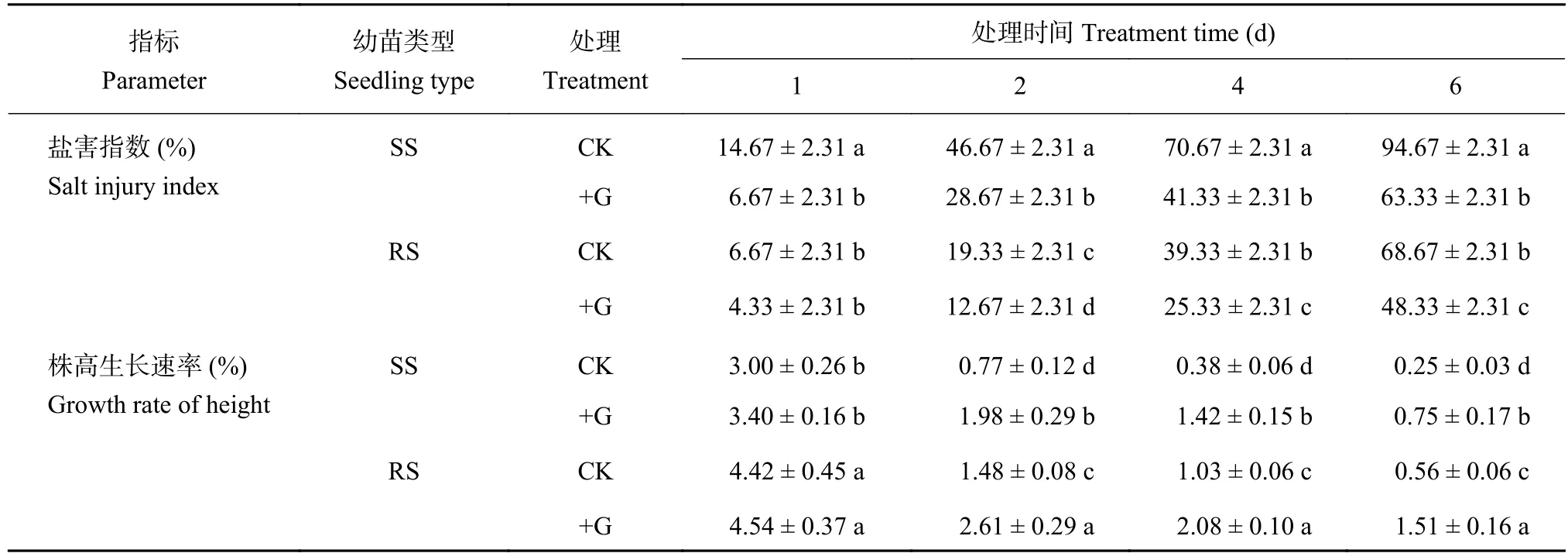
表1 GABA对盐胁迫下番茄幼苗盐害指数及株高生长速率的影响Table 1 Effects of GABA on salt injury index and plant height growth rate of tomato seedlings under salt stress treatments
在整个处理过程中,对照处理的RS幼苗株高生长速率均显著高于SS幼苗,提高幅度达47.3%~124.0%。外源GABA处理可有效缓解NaCl胁迫对番茄幼苗生长的抑制作用,促使SS和RS幼苗株高生长速率显著增加,在+G处理2、4、6天,SS幼苗株高生长速率分别比对照处理提高1.57、2.74和2.00倍,而RS幼苗株高生长速率仅分别比对照处理提高了0.76、1.02及1.70倍。
2.2 GABA对盐胁迫下番茄幼苗鲜重、干重的影响
从表2可以看出,对照条件下,RS幼苗鲜重在处理第2和第4天均显著高于SS幼苗,RS幼苗干重仅在处理第2天时显著高于SS幼苗,组织含水量在处理第4天时显著高于SS幼苗。外源施用GABA后,SS和RS幼苗鲜重和干重都得到了提升,其中鲜重的提高幅度更为明显,与对照相比,SS幼苗在+G处理第2天和第4天,鲜重提高幅度分别达到18.2%和27.1%,RS幼苗鲜重分别提高10.7%和13.7%;同时GABA也显著提高了处理第2天时SS幼苗的干重和处理第4天时SS幼苗的组织含水量。
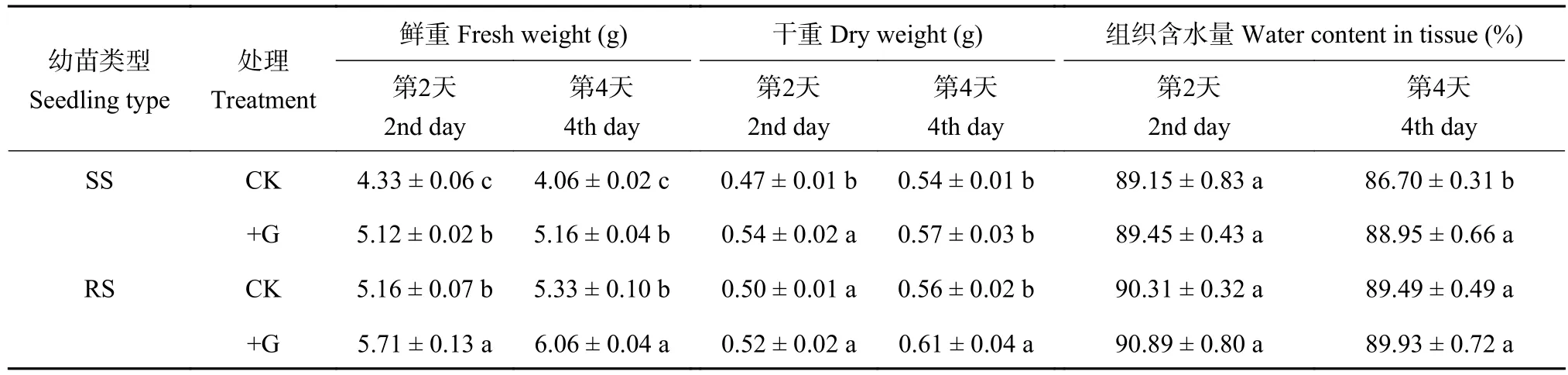
表2 盐胁迫处理第2天和第4天的番茄幼苗生物量和含水量Table 2 Weight and tissue water content of tomato seedlings on the 2nd and 4th day of salt stress treatments
2.3 GABA对盐胁迫下番茄幼苗叶绿素含量的影响
如表3所示,盐胁迫下RS幼苗叶片Chl.a、Chl.b、Chl.(a+b) 含量均显著高于SS幼苗,在处理第4天时分别提高了57.87%、17.23%和39.66%。外源GABA可显著增加NaCl胁迫下RS和SS幼苗叶片叶绿素含量,但RS和SS幼苗间存在显著差异,在处理第4天时,+G处理的SS幼苗叶片内Chl.a、Chl.b、Chl. (a+b) 含量分别比对照处理提高69.03%、32.04%和52.46%,而+G处理的RS幼苗比对照处理分别提高19.53%、51.66%和31.62%,外源GABA对SS幼苗叶片叶绿素含量提高效果比对RS幼苗明显,但+G处理的RS幼苗叶片Chl.a、Chl.b 及 Chl. (a+b) 含量均显著高于 SS 幼苗。
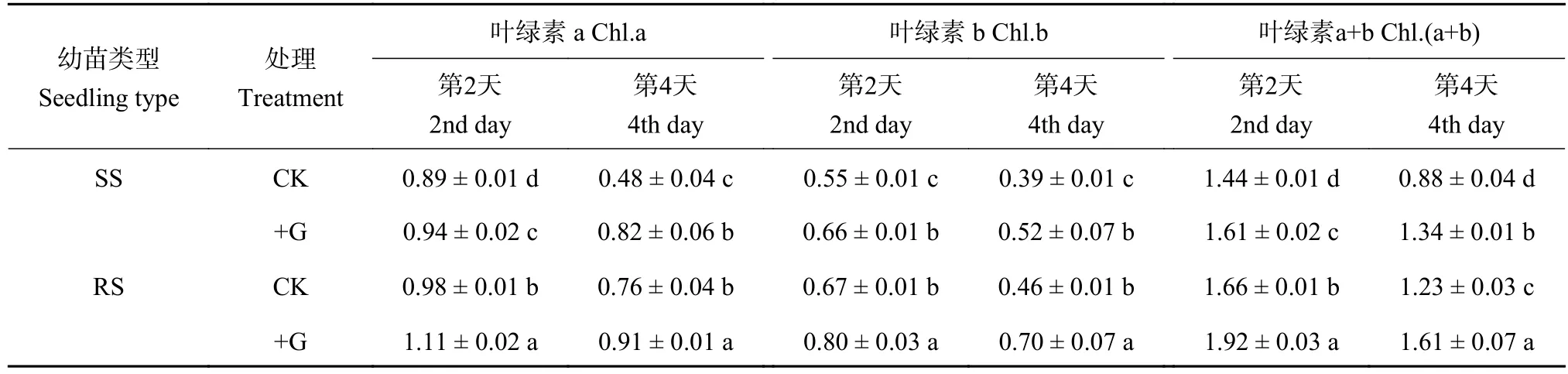
表3 盐胁迫下处理第2天和第4天的番茄幼苗叶绿素含量 (mg/g,FW)Table 3 Chlorophyll content of tomato seedlings on the 2nd and 4th day of salt stress treatments
2.4 GABA对盐胁迫下番茄幼苗叶片及根系Na+含量的影响
从表4可以看出,SS幼苗根系和叶片内Na+含量随NaCl处理时间延长而逐渐增加;RS幼苗根系Na+含量在对照处理第4天时明显高于处理第2天时,但是叶片Na+含量却呈现下降的趋势,RS幼苗根系和叶片Na+含量在对照处理中均显著低于SS幼苗,处理第2天和第4天时,根系Na+含量降低幅度分别为12.9%和14.9%,叶片降低幅度分别为35.7%和45.5%。SS和RS幼苗根系中Na+含量均高于叶片,但RS幼苗叶片与根系Na+含量差异较大,叶片比根系降低48.0%~53.6%,表明RS幼苗不仅抑制了根系对Na+的吸收,也减少了Na+向叶片的运输,限制幼苗内Na+累积的能力强于SS幼苗。外源GABA处理下SS和RS幼苗根系及叶片内Na+含量较对照处理均呈现显著下降的趋势,其中SS幼苗叶片Na+含量在处理第2天和第4天时分别比对照处理降低了39.4%和32.6%,根系Na+含量分别下降了24.3%和19.6%;RS幼苗叶片内Na+含量在处理第2天和第4天时降低幅度小于SS幼苗,降低幅度分别为12.8%和10.8%,根系Na+含量分别降低18.8%和23.3%,表明外源GABA可抑制根系对Na+的吸收和叶片内Na+的积累。
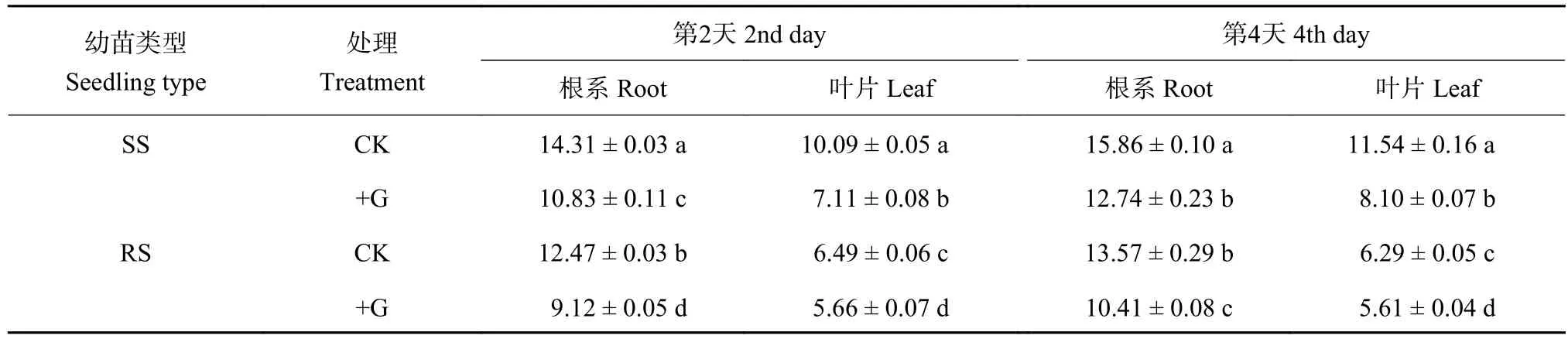
表4 GABA对盐胁迫下第2天和第4天番茄幼苗叶片和根系内Na+含量的影响Table 4 Effects of GABA on Na+ content in leaves and roots of tomato seedlings on the 2nd and 4th day of salt stress treatments
2.5 GABA对盐胁迫下番茄幼苗叶片氨基酸含量的影响
从图1可以看出,RS和SS幼苗在对照和+G处理下叶片谷氨酸 (Glu)、组氨酸 (His)、甘氨酸(Gly)、脯氨酸 (Pro)、丙氨酸 (Ala)、γ-氨基丁酸(GABA)、缬氨酸 (Val)、甲硫氨酸 (Met)、异亮氨酸(Ile)、亮氨酸 (Leu)、苯丙氨酸 (Phe)等 11 种氨基酸含量存在差异。其中处理第2天时RS幼苗叶片的Glu、Ala、GABA、Met、Ile、Leu 及 Tyr共 7 种氨基酸含量均显著高于SS幼苗叶片,处理第4天时RS幼苗叶片Glu、GABA、Leu显著高于SS幼苗叶片。在11种氨基酸中,Glu、Pro、GABA含量受外源GABA影响较大,其中SS幼苗叶片Glu和GABA含量受GABA诱导提高幅度大于RS幼苗叶片。+G处理的第2天和第4天,SS幼苗叶片Glu和GABA含量较对照处理提高幅度分别为63.7%~151.0%和57.2%~60.7%,而+G处理的RS幼苗叶片Glu和GABA含量较对照处理提高幅度分别为49.5%~78.3%和30.3%~43.0%,均显著高于对照处理的SS和RS幼苗叶片;RS幼苗叶片在+G处理下Pro含量显著高于SS幼苗叶片,提高幅度达18.3%~25.8%。
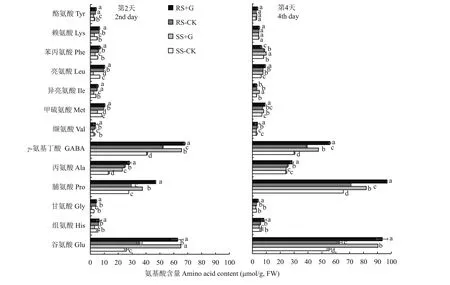
图1 GABA对盐胁迫下第2天和第4天番茄幼苗叶片氨基酸含量的影响Fig. 1 Effects of GABA on amino acid content of tomato leaves on the 2nd and 4th day under salt stress treatments
2.6 GABA对盐胁迫下番茄幼苗叶片和根系SOD活性的影响
如图2所示,SS和RS幼苗的叶片和根系SOD活性随NaCl处理时间的延长呈逐渐增加的趋势,且RS幼苗体内SOD活性显著高于SS幼苗。外源GABA处理显著提高了盐胁迫下SS和RS幼苗体内SOD活性,在处理6天后,+G处理的RS幼苗叶片SOD活性比对照处理提高了19.0%,根系提高了26.6%,+G处理的SS幼苗叶片SOD活性比对照处理提高了15.6%,根系提高了21.2%,但+G处理的RS幼苗叶片和根系SOD活性均高于SS幼苗,在处理第4天和第6天时RS幼苗叶片SOD活性较SS幼苗分别提高18.2%、15.2%,根系较SS幼苗分别提高20.9%、12.2%。
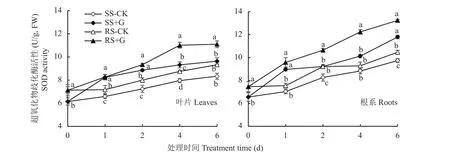
图2 GABA对盐胁迫下番茄幼苗叶片和根系SOD活性的影响Fig. 2 Effects of GABA on SOD activity in leaves and roots of tomato seedlings under salt stress treatments
2.7 GABA对盐胁迫下番茄幼苗叶片和根系POD活性的影响
图3表明,在处理0~6天内,对照处理下SS和RS幼苗叶片和根系内POD活性均随处理时间的延长逐渐增加,+G处理的SS和RS幼苗叶片及根系POD活性均显著高于对照处理,均表现为RS幼苗高于SS幼苗。在处理1~6天,RS幼苗在+G处理下叶片和根系POD活性较对照处理分别提高了12.9%~32.9%和13.5%~29.1%。+G处理1~6天,RS幼苗叶片POD活性较SS幼苗提高了11.8%~15.5%,RS幼苗根系POD活性在处理1和2天分别比SS幼苗提高了11.7%和10.2%,呈现显著差异。
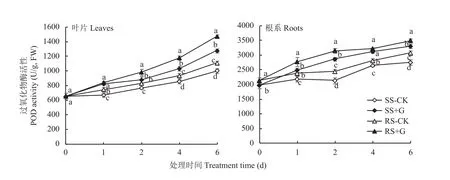
图3 GABA对盐胁迫下番茄幼苗叶片和根系POD活性的影响Fig. 3 Effects of GABA on POD activity in leaves and roots of tomato seedlings under salt stress treatments
2.8 GABA对盐胁迫下番茄幼苗叶片和根系CAT活性的影响
从图4可以看出,对照处理中SS和RS幼苗体内CAT活性存在显著差异,RS幼苗叶片CAT活性在处理的第1、4、6天显著高于SS幼苗叶片,RS幼苗根系CAT活性在处理第2~6天显著高于SS幼苗根系,叶片与根系内CAT活性均表现为RS+G > SS +G > RS-CK > SS-CK,在+G 处理第 1、2天,RS幼苗叶片CAT活性显著高于SS幼苗叶片,提高幅度分别为18.9%和19.4%,而根系CAT活性在整个+G处理过程中均显著高于SS幼苗根系,提高幅度为6.9%~25.2%。
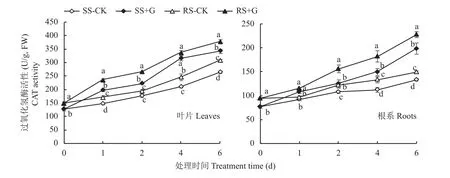
图4 GABA对盐胁迫下番茄幼苗叶片和根系CAT活性的影响Fig. 4 Effects of GABA on CAT activity in leaves and roots of tomato seedlings under salt stress treatments
2.9 GABA对盐胁迫下番茄幼苗叶片和根系MDA含量的影响
从图5可知,随NaCl处理时间的延长,幼苗叶片和根系MDA累积量呈不断增加的趋势,但RS幼苗叶片和根系MDA含量在整个处理过程中均显著低于SS幼苗。外源GABA显著降低RS和SS幼苗体内MDA的累积量,在处理第2、4、6天,+G处理的RS幼苗叶片内MDA含量较对照处理分别降低了14.2%、19.7%和18.0%,根系内分别降低了10.4%、13.8%和16.7%,+G处理的SS幼苗叶片内MDA含量较对照处理分别降低了19.5%、18.7%和14.0%,根系内分别降低了12.2%、16.4%和17.9%,但+G处理的SS幼苗叶片和根系MDA含量仍显著高于幼苗RS。其中,处理第6天后的SS幼苗叶片MDA含量较RS幼苗提高12.5%,根系MDA含量较RS幼苗提高10.0%。
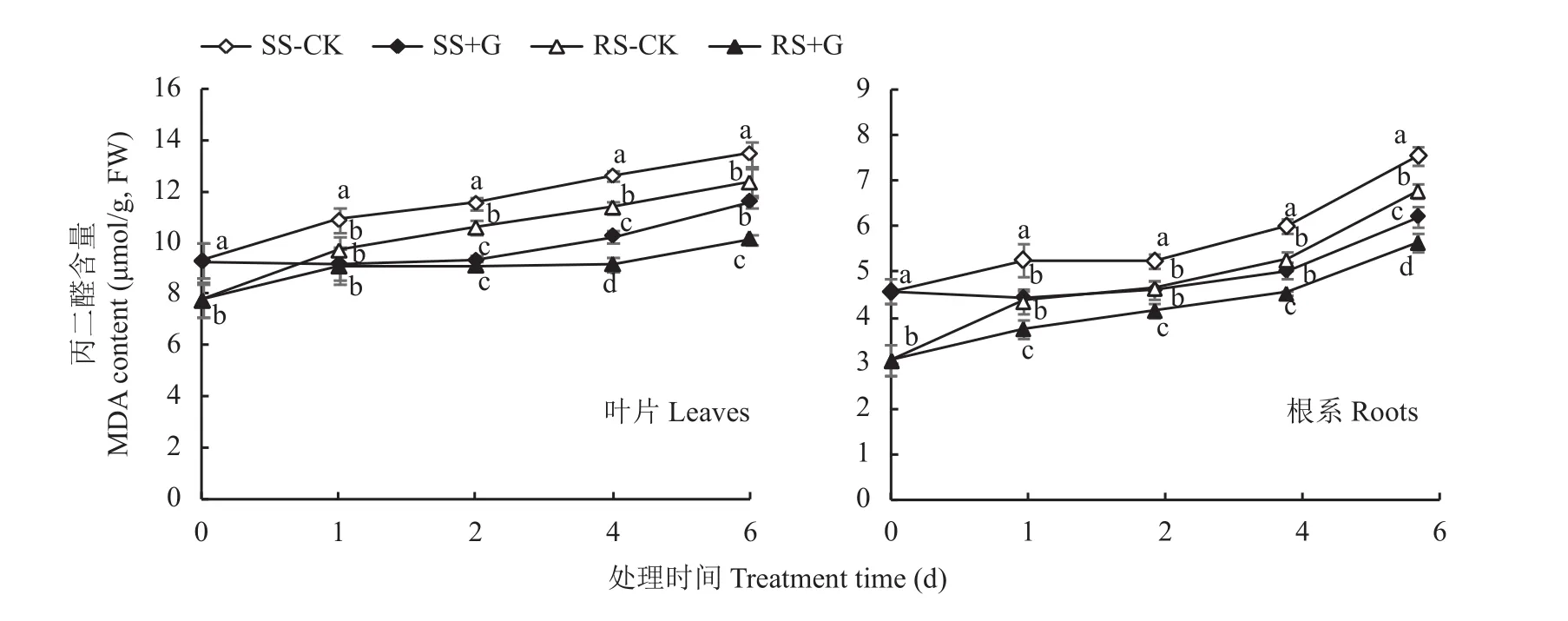
图5 GABA对盐胁迫下番茄幼苗叶片和根系MDA含量的影响Fig. 5 Effects of GABA on MDA content in leaves and roots of tomato seedlings under salt stress treatments
2.10 GABA对盐胁迫下番茄幼苗叶片和根系产生速率的影响
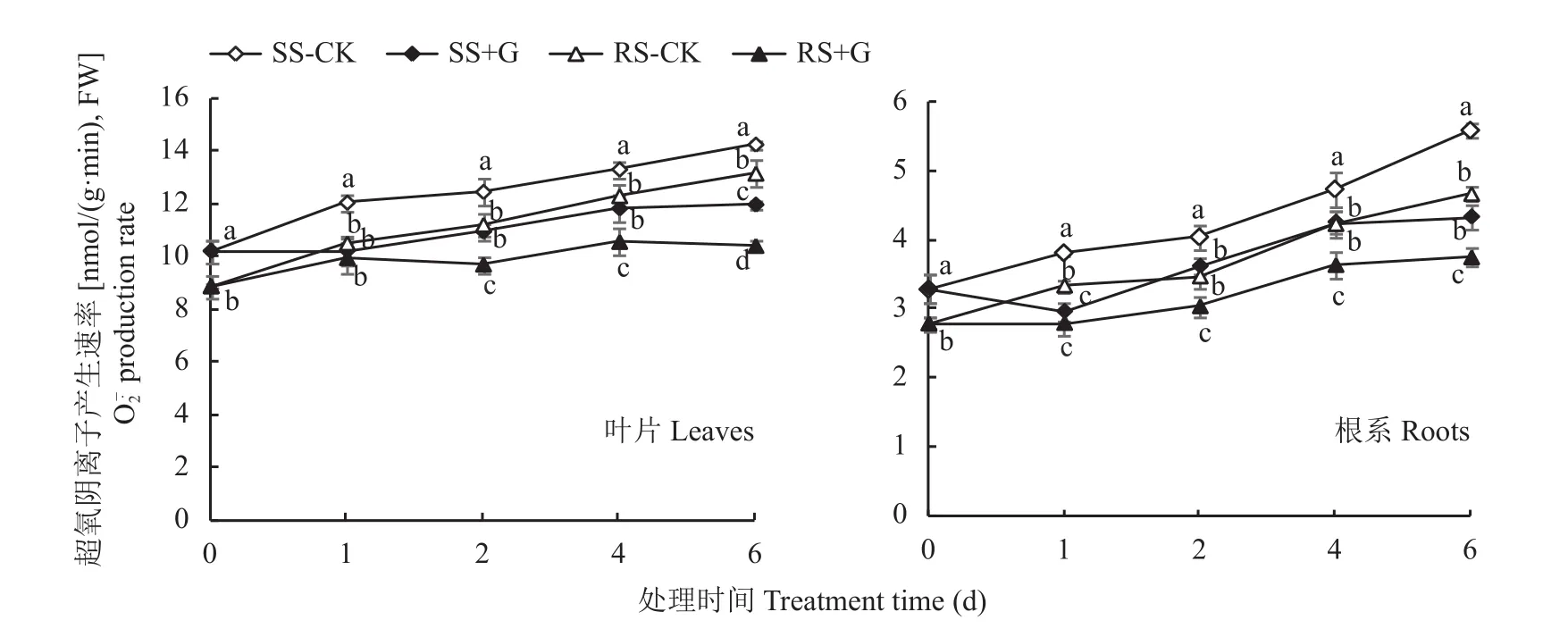
图6 GABA对盐胁迫下番茄幼苗叶片和根系产生速率的影响Fig. 6 Effects of GABA on production rate in leaves and roots of tomato seedlings under salt stress treatments

图7 不同处理下番茄幼苗叶片染色照片Fig. 7 Photos of tomato seedling leaves under different treatments
3 讨论
3.1 GABA对盐胁迫下番茄嫁接苗生物量的影响
植物响应盐胁迫最直观的变化就是植株生长受到明显抑制。研究发现,嫁接通过利用砧木发达的根系及较强的抗性,可显著缓解盐胁迫对番茄幼苗生长的抑制作用[31];外源施用GABA通过提高抗氧化能力[16],减少叶绿素降解,保持叶片的光合作用[19]等途径缓解了盐胁迫对植物生长的抑制作用。本试验研究以自嫁接苗和耐盐砧木嫁接苗为材料,分析了盐胁迫下GABA对2种嫁接苗耐盐性的影响,结果表明,NaCl胁迫下,2种嫁接苗 (RS、SS) 的株高生长速率、干鲜重、叶绿素含量均表现为RS >SS,盐害指数则表现为RS < SS,这是由于利用耐盐砧木嫁接的RS幼苗其砧木本身耐盐性显著高于SS幼苗,嫁接后番茄的砧木根系活力较强,可吸收较多生长所需要的营养物质,进而增强盐胁迫下番茄植株的生长势,各项生长指标受伤害程度小,在植株表型上表现出的盐害症状较轻。外源GABA作为含氮物质,被植物体吸收后可有效促进生长,减少盐胁迫下SS和RS幼苗叶片叶绿素降解,缓解盐害对植株生长的抑制作用,RS幼苗在各项表型指标上均优于SS幼苗,表明GABA在耐盐性强的嫁接苗上施用可进一步发挥耐盐砧木在减轻盐胁迫伤害中的重要作用,使得盐胁迫下番茄嫁接苗的生物量显著增加。
3.2 GABA对盐胁迫下嫁接番茄幼苗Na+累积的影响
Na+是造成土壤盐渍化的主要离子之一,盐胁迫导致的植物细胞损伤和由此产生的生长抑制主要是由于植物对Na+的过量吸收和积累造成的[32]。嫁接换根通过调节植物体内离子的区域化分配,可减轻盐胁迫导致的离子毒害[33];白丽萍等[34]研究发现,耐盐砧木具有较强的拒盐及限制Na+向上运输的能力,可有效减少地上部Na+累积量,进而减轻Na+对叶片的伤害。本试验研究结果表明,盐胁迫导致SS和RS幼苗内Na+含量逐渐增加,其中RS幼苗的叶片及根系内Na+含量均显著低于SS幼苗,且RS幼苗叶片内Na+累积量低于根系,这可能是由于耐盐砧木有较强的避钠、拒钠能力,根系对Na+的吸收量少于自嫁接苗,并将较多的Na+截留在根系中,减少Na+向叶片运输,进而缓解了盐胁迫对幼苗造成的损伤。施用外源抗逆物质可有效减少盐胁迫下植物体内Na+的积累量[35],在盐胁迫下,经外源GABA处理后的甜高粱种子发芽率最高,对Na+的吸收量最小,对盐害的缓解效应最佳[36]。本试验也证明外源GABA对减少盐胁迫下番茄幼苗内Na+累积具有显著效果,其Na+积累量均较对照处理显著降低,但在2种嫁接苗中,GABA处理后的RS幼苗的Na+含量最低,这可能是由于外源GABA作为一种小分子含氮物质,在被植物根系吸收后,直接参与了番茄幼苗内的多种生理代谢过程,提高了细胞内的渗透调节水平,增强了砧木根系抑制Na+吸收及向上运输的能力,这种能力与RS幼苗的砧木耐盐能力结合,有效抑制了根系对于Na+的吸收,减轻了Na+在叶片中过度积累导致的离子毒害。
3.3 GABA对盐胁迫下嫁接番茄幼苗氨基酸含量的影响
氨基酸含量的增加能够提高植物对盐胁迫的适应能力。研究表明,氨基酸的合成是植物在NaCl胁迫下的适应性反应之一[37],嫁接可通过诱导植物体内氨基酸累积来缓解逆境伤害。Penella等[38]研究认为嫁接砧木可通过调节脯氨酸积累等生理过程,提高幼苗耐盐能力。本试验结果表明,RS幼苗叶片内GABA、脯氨酸等多种氨基酸含量均显著高于SS幼苗叶片,这可能是因为RS幼苗根系耐盐性强,通过嫁接可刺激盐胁迫下幼苗接穗叶片内细胞游离氨基酸含量增加,提高幼苗的渗透调节能力。GABA处理诱导植物体内丙氨酸[39]及脯氨酸[40-41]的积累,已被证明是植物应对不同逆境胁迫的有效方法。本试验研究表明,外源施用GABA的SS和RS幼苗叶片内氨基酸含量均显著提高,尤其是内源GABA和脯氨酸含量提高幅度最大,且GABA处理后RS幼苗叶片内各氨基酸含量均显著高于SS幼苗叶片,这表明外源GABA在被砧木根系直接吸收利用后,可在嫁接苗内运输传导,并诱导叶片内源GABA和游离氨基酸含量的进一步增加,提高细胞渗透调节能力,从而增强嫁接苗抵御盐胁迫伤害的能力。而外源GABA添加后RS和SS幼苗的叶片氨基酸含量在盐胁迫下存在显著差异,可能是由于耐盐砧木嫁接苗具有较为发达的根系,对外源GABA的吸收速度及转化效率快于耐盐能力弱的嫁接苗,能够诱导叶片细胞氨基酸积累,用于抵抗盐胁迫伤害。因此,耐盐性强的嫁接苗添加外源GABA后,仍优于耐盐性弱的嫁接苗。
3.4 GABA对盐胁迫下嫁接番茄幼苗活性氧代谢的影响
盐胁迫造成活性氧 (ROS) 的过量积累而破坏细胞膜结构,而抗氧化酶活性在保护植物免受盐分引起的氧化损伤方面起着重要的作用[19]。Colla等[42]研究认为异砧嫁接植株耐盐性的增强与活性氧清除系统的激活有关。本试验结果也证明了盐胁迫下异砧嫁接苗RS比自嫁接苗SS表现出更强的活性氧清除能力,表现为RS幼苗体内SOD、POD、CAT活性显著高于SS幼苗,而和MDA含量则显著低于SS幼苗。相关研究表明,外源施用GABA处理可有效缓解盐胁迫对植物生长的抑制和氧化损伤,主要是由于GABA通过阻止ROS的积累和细胞死亡参与了对NaCl胁迫的反应,使植物免受盐逆境伤害[43]。本研究结果表明外源GABA可进一步提升番茄嫁接苗叶片和根系内3种抗氧化酶活性,降低产生速率和MDA含量,其作用机制可能是通过诱导番茄幼苗叶片及根系内SOD、POD及CAT活性的提高,降低了幼苗内活性氧含量,减轻了膜脂过氧化伤害;添加GABA后,RS幼苗较SS幼苗呈现出更高的活性氧清除能力,是因为外源GABA在嫁接的基础上,抑制了幼苗内Na+的过量积累,减轻了盐胁迫对幼苗造成的活性氧伤害,并且外源GABA进一步诱导耐盐砧木提高嫁接苗活性氧清除能力,保护细胞膜结构免受伤害,进一步提高了嫁接番茄的耐盐性。
3.5 GABA对两种嫁接苗盐害缓解程度的差异
外源GABA可有效缓解2种番茄幼苗的盐胁迫症状,但本试验发现外源GABA对RS和SS幼苗盐胁迫伤害的缓解程度不同。在GABA对李属砧木耐低氧作用的研究中发现,外源GABA可瞬时提高低氧敏感型砧木的叶绿素含量、光合作用等指标,从而提高其耐性,而对于耐性较强的砧木作用则不明显[44];我们前期对于甜瓜耐低氧的研究中发现,外源GABA处理对耐低氧性强的品种效果更明显[45]。本研究中外源GABA诱导幼苗盐害指数和Na+累积量降低幅度,株高生长速率、干鲜重及叶绿素、谷氨酸、GABA含量和抗氧化酶活性等指标的提高幅度在SS幼苗中明显高于RS幼苗,这可能是由于耐性不同的根系对外源GABA的响应因基因型和处理时间的不同存在差异,外源GABA对RS幼苗盐害症状的缓解没有对SS幼苗明显,可能是由于SS幼苗本身耐盐性弱,经GABA处理后,表现出在盐处理0~6天的各项指标的剧烈变化全部是由GABA诱导,最大限度的体现了GABA对于盐胁迫的缓解,而RS幼苗根系耐盐性强,表现出的盐害症状轻,外源GABA与嫁接方法综合使用进一步增强了砧木对Na+的截留作用,减少Na+向叶片运输,提高盐胁迫下幼苗离子吸收的稳态平衡,表明GABA处理对于RS幼苗盐害的缓解是GABA与嫁接苗根系共同作用的结果,但这种作用不是简单的叠加关系,包含了耐盐砧木根系对钠离子运输的抑制及外源GABA对植株多种代谢调节的复杂效应。外源施用GABA等氨基酸肥料均可提高不同耐性嫁接植株的耐盐性,而在耐盐性较强的嫁接番茄幼苗中施用,可将外源GABA与嫁接缓解盐胁迫伤害的综合效应最大化,因此,在实际生产应用中,外源GABA的施用不必受植株本身耐性的约束,与嫁接同时应用可收到更理想的耐盐效果。
4 结论
本研究从生长、Na+积累、氨基酸含量及抗氧化酶活性的变化差异讨论了外源GABA对盐胁迫下番茄RS及SS幼苗的影响,结果表明,5 mmol/L GABA处理通过对番茄幼苗Na+向上运输、氨基酸水平和抗氧化酶活性的调控,进一步增强嫁接苗的耐盐性,主要原因在于GABA为幼苗提供了氮素营养,促进盐胁迫下植物生长和叶绿素的合成,同时,GABA诱导细胞内多种氨基酸含量上升,叶片渗透调节能力增强,从而抑制了Na+过量积累,缓解了细胞内活性氧积累带来的伤害。但GABA处理对盐害的缓解作用在耐盐性弱的SS幼苗上效果更明显,说明GABA作用的发挥与幼苗本身耐性有关,GABA处理下RS幼苗耐盐性的提高是砧木和GABA共同作用的结果,而SS幼苗耐盐性的提高主要受外源GABA的诱导。因此,GABA作为氨基酸肥料进行广泛使用,可提高不同耐性植株的耐盐能力。

