miR-218在高浓度葡萄糖诱导大鼠视网膜微血管内皮细胞凋亡中的作用△
郭闯 刘学政
糖尿病视网膜病变(DR)是成年人视力损害的首要因素[1],高血糖在DR的发生发展过程中发挥重要作用。微小核糖核酸(miRNA)是一种小的非编码RNA,能调节多种基因的表达,从而直接或间接参与疾病的发生发展。miR-218是一种与视网膜微血管内皮细胞增殖与凋亡密切相关的miRNA[2-3],研究发现,miR-218在高浓度葡萄糖饮食的小鼠晶状体中高表达[4],但是引发miR-218升高的相关机制以及miR-218对内皮细胞的影响目前仍不清楚。本研究主要探讨miR-218在高浓度葡萄糖诱导大鼠视网膜微血管内皮细胞(rat retinal microvascular endothelial cells,rRMECs)凋亡中的作用及其相关机制。
1 材料与方法
1.1 实验细胞与主要试剂rRMECs(上海雅吉生物科技有限公司),CCK-8试剂盒、BCA蛋白浓度测定试剂盒、Hoechst 染色液(上海碧云天生物公司),TaqMan MicroRNA检测试剂盒(上海Applied Biosystems公司),Lipofectamine 2000(Lipo 2000)、Trizol试剂盒(美国Invitrogen生物公司),实时定量 PCR试剂盒、miR-218抑制剂、miR-218阴性抑制剂、cDNA逆转录试剂盒(上海吉玛制药技术有限公司),Caspase-3抗体、β-actin抗体(上海Abcam公司)。
1.2 细胞处理及实验分组将细胞培养达80%融合时弃去完全培养基,随后置于无血清且含有碱性成纤维细胞生长因子的培养基中按照10×106个·L-1的密度接种于6孔培养板,培养过夜后进行分组。将细胞分为对照组、高糖组、miR-218阴性抑制组和miR-218抑制组。对照组细胞用DMEM低糖培养基培养;高糖组在培养基中添加D-葡萄糖,终浓度为25 mmol·L-1;miR-218抑制组及miR-218阴性抑制组是在高糖组培养基的基础上,按照说明书操作,利用Lipo2000将miR-218抑制剂和阴性抑制剂转染rRMECs,共同孵育24 h。
1.3 总RNA提取与miR-218含量分析利用Trizol试剂盒从rRMECs中提取总RNA。首先用氯仿提取RNA,然后离心分离样品为水相和有机相。再用异丙醇沉淀法从水相中提取RNA,并悬浮于二乙基焦碳酸酯处理过的水中。取1 μg总RNA,利用miRNA的互补DNA(cDNA)逆转录试剂盒合成cDNA,将所得cDNA产物在-20 ℃下保存备用。再利用PrimeScript miRNA cDNA试剂盒合成cDNA,最后利用TaqMan MicroRNA检测试剂盒,以RNA U6为内对照构建反应体系,对miR-218进行定量分析。miR-218正向引物序列为5’- GCGCTTGTGCTTGATCTAA-3’,反向引物序列为5’- GTGCAGGGTCCGAGGT -3’;U6正向引物序列为5’-CTCGCTTCGGCAGCACA-3’,U6反向引物序列为5’-AACGCTTCACGAATTTGCGT-3’。
1.4 细胞活力检测根据试剂盒提供的实验方案测定各组rRMECs细胞活力。将细胞按每孔10×103个的密度接种到96孔板中培养过夜,细胞贴壁后分组培养72 h,在每个孔中加入10 μL CCK-8溶液,置于37 ℃的细胞培养箱中孵育细胞2 h,然后用酶标仪测量490 nm处的吸光度。用不同组的平均吸光度/对照组的平均吸光度计算各组细胞活力。
1.5 细胞凋亡率检测分组培养rRMECs 72 h后进行Hoechst染色。将培养的细胞用磷酸盐缓冲液轻轻冲洗2次,再加入2 mL的Hoechst溶液(20 mmol·L-1),置于37 ℃细胞培养箱中染色孵育20 min,染色结束后将磷酸盐缓冲液冲洗干净,用荧光显微镜观察细胞形态,计算各组细胞凋亡率。
1.6 采用Western blot检测Caspase-3蛋白表达刮取rRMECs细胞,加入蛋白裂解液,离心收集上清液,测定上清液中的蛋白含量。调节蛋白浓度后,将蛋白置于聚丙烯酰胺凝胶中电泳并转移到聚偏氟乙烯膜上,并与兔源性Caspase-3和β-actin一抗分别孵育,4 ℃孵育过夜后,用含有Tween20的Tris缓冲液清洗膜,然后在室温下与山羊抗兔IgG(辣根过氧化物酶标记)孵育1 h。再次用含有Tween20的Tris缓冲液清洗后,用增强化学发光试剂盒显色,观察信号,用凝胶成像系统分析蛋白发光强度,参照β-actin计算Caspase-3蛋白的相对表达量。
1.7 统计学分析利用SPSS 19.0统计学软件对实验数据进行单因素方差分析并进行两两比较。检验水准:α=0.05。
2 结果
2.1 各组rRMECs细胞内miR-218相对表达量实时定量PCR检测结果显示,对照组、高糖组、miR-218阴性抑制组、miR-218抑制组miR-218相对表达量分别为1.00±0.08、1.48±0.12、1.46±0.14、1.03±0.08。与对照组相比,高糖组和miR-218阴性抑制组的miR-218相对表达量均明显升高(均为P<0.05),miR-218抑制组的miR-218相对表达量较对照组变化不显著(P>0.05)。
2.2 各组rRMECs细胞活力依据测得的吸光度计算得出对照组、高糖组、miR-218阴性抑制组、miR-218抑制组的细胞活力分别为100.0%、(72.3±7.5)%、(70.7±9.3)%及(98.4±9.4)%。高糖组和miR-218阴性抑制组rRMECs细胞活力与对照组相比均明显降低(均为P<0.05);miR-218抑制组与对照组相比细胞活力未见明显变化,差异无统计学意义(P>0.05)。
2.3 各组rRMECs细胞凋亡率Hoechst染色显示凋亡细胞的膜通透性受到破坏,细胞核易着色,呈亮蓝色碎片或皱缩等形态改变。对照组、高糖组、miR-218阴性抑制组、miR-218抑制组rRMECs细胞凋亡率分别为(2.3±0.0)%、(20.3±3.1)%、(23.1±3.2)%及(2.9±0.1)%。高糖组和miR-218阴性抑制组的细胞凋亡率均显著高于对照组(均为P<0.05);而miR-218抑制组与对照组相比,细胞凋亡率变化不明显,差异无统计学意义(P>0.05)(见图1)。

图1 Hoechst染色检测各组rRMECs凋亡情况(×400) A:对照组;B:高糖组;C:miR-218阴性抑制组;D:miR-218抑制组。
2.4 各组rRMECs中Caspase-3蛋白表达的变化对照组rRMECs Caspase-3蛋白相对表达量为(18.6±2.3)%、高糖组为(43.3±4.5)%、miR-218阴性抑制组为(41.6±3.9)%、miR-218抑制组为(20.0±2.8)%。与对照组相比,高糖组和miR-218阴性抑制组的Caspase-3蛋白相对表达量均明显增加(均为P<0.05),miR-218抑制组Caspase-3蛋白相对表达量变化不明显(P>0.05)(见图2)。
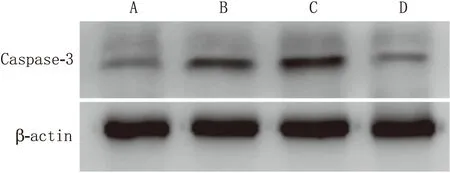
图2 Western blot检测各组rRMECs中Caspase-3蛋白表达情况 A:对照组;B:高糖组;C:miR-218阴性抑制组;D:miR-218抑制组。
3 讨论
视网膜微血管内皮细胞凋亡、通透性增加、异常血管新生及视网膜水肿等改变是DR的重要病理变化。DR微血管病变机制复杂,持续的高血糖是微血管病变的重要原因。高血糖能导致多元醇途径、蛋白激酶C途径、己糖胺途径及晚期糖基化终末产物四条经典代谢途径激活,从而损害包括内皮细胞在内的多种视网膜细胞和组织[1]。
miRNA参与多种疾病的发生发展,DR时可见多种miRNA表达异常[5]。其中miR-218能调节视网膜新生血管形成,可以抑制缺氧诱导的视网膜血管生成[2-3],在糖尿病小鼠的晶状体内miR-218含量明显增加[4]。本研究发现,高浓度葡萄糖能导致rRMECs内miR-218含量增加,这提示高浓度葡萄糖可能是视网膜微血管内皮细胞miR-218含量增加的直接因素。
miR-218作用范围较广,与癌症、先天性巨结肠病、心肌细胞肥大、神经病理性疼痛和慢性阻塞性肺气肿等多种临床疾病都有密切关系,具有抑制细胞增殖及诱导凋亡的作用[6-9]。抑制miR-218能促进心肌梗死大鼠内皮细胞再生及血管生成,减轻心肌组织病理损伤并减小梗死面积,从而减轻心功能损害[10]。为了探讨miR-218升高对rRMECs的影响,本研究观察了rRMECs活力和凋亡与miR-218之间的关系,结果发现rRMECs细胞内miR-218含量增加时,细胞凋亡明显,细胞活力显著下降,而特异性抑制miR-218表达能抑制高浓度葡萄糖诱导的rRMECs凋亡,这提示miR-218含量增加是高浓度葡萄糖诱导rRMECs凋亡的重要机制。
miR-218作用机制复杂,在LN229胶质瘤细胞研究中发现,miR-218能抑制Survivin的表达,与胶质母细胞瘤的总体生存率呈负相关[11]。随后有研究利用荧光素酶标记实验,证实了Survivin是miR-218的直接靶基因,上调miR-218能降低SGC7901/DDP细胞Survivin的表达,进而诱导细胞凋亡[12]。下调miR-218可降低Caspase-3和Bax的表达,增加Bcl-2的表达,抑制间歇性低氧诱导的小鼠主动脉内皮细胞凋亡[13]。本研究中观察到,随着miR-218的上调与rRMECs凋亡,Caspase-3蛋白的表达明显增加。这表明Caspase-3蛋白的表达受miR-218调节,是miR-218诱导rRMECs凋亡的重要分子机制之一。miR-218能直接抑制Survivin的表达[12],抑制Survivin能促进Caspase-3的表达[14],这可能是miR-218上调Caspase-3表达的重要分子机制之一。
本次我们利用高浓度葡萄糖体外培养rRMECs,模拟糖尿病状态下体内高浓度葡萄糖环境,仅探讨高浓度葡萄糖这一因素对视网膜微血管内皮细胞的影响,证实了高浓度葡萄糖上调miR-218是导致rRMECs凋亡的重要原因,其机制可能与Caspase-3蛋白表达增加有关。但miR-218靶基因众多,可能还有其他基因参与rRMECs凋亡过程。此外,影响糖尿病视网膜微血管内皮细胞病变因素很多,除了高血糖之外,高血脂以及可能出现的高酮体血症等都可能参与DR的发生发展。而且体外实验无法完全模拟体内环境,miRNA对于DR的防治作用仍需进一步探讨。

