菊花提取液对小鼠视网膜光损伤的保护作用△
巩一博 郭雅图 张伟
年龄相关性黄斑变性(AMD)是一种年龄相关性的视网膜退行性病变,AMD产生的原因目前尚未完全明确,其诱发因素可能与直接强光暴露、饮食中缺乏抗氧化的食物等有关[1-3]。随着人口老龄化的发展,至2020年,在全球患有AMD的人数将有可能达到2亿,至2040年可能增加到3亿,并且发病具有年轻化趋势[4]。早期的AMD主要表现为玻璃膜的聚集及视网膜色素上皮(RPE)细胞的破坏,后期则逐渐可以分为干性和湿性两种类型,干性AMD主要为视网膜地图样萎缩,湿性AMD主要以新生血管为主[5-6]。这两种类型可以独立存在,也可以相继发生,其关系目前尚未完全明确。因为对发病机制认识不完全清晰,尚没有预防AMD的有效措施。
菊花在我国种植广泛,有研究表明,菊花提取液在多种不同色光照射下可以产生抗氧化损伤的作用[7]。菊花具有较强的清除氧自由基和较好的还原能力[8]。其含有的黄酮、多糖等,尤其黄酮小分子物质具有较好的抗氧化作用[9]。AMD的发生与光感受器细胞的氧化应激有关[10]。小鼠急性及慢性光损伤是研究常用的光损伤模式,本研究旨在证明菊花提取液在小鼠视网膜光损伤中的保护作用,并探讨其对AMD的预防性作用。
1 材料与方法
1.1 实验对象及分组本实验采用28只C57BL/6J野生型小鼠(北京斯贝福,SPF级),6周龄,雄性,饲养环境温度为(23±2)℃,相对湿度为55%,12 h明暗交替光照饲养。随机分为对照组(8只)、模型组(8只)、菊花低剂量组(6只)、菊花高剂量组(6只),根据2015年版《中华人民共和国药典》及2003年版《保健食品与评价技术规范》中关于菊花的提取及剂量,菊花用水提法浓缩烘干后,粉碎成粉末,灌胃时生理盐水混悬,在达到最低有效浓度和不产生毒性作用范围内使用。菊花灌胃剂量分别为:菊花低剂量0.23 g·kg-1、菊花高剂量0.38 g·kg-1,每天0.2 mL连续灌胃8周,剂量与董璐萌等[11]的研究相近,对照组及模型组普通饲料喂养,食、水均自由摄取。灌胃结束1 d后,采用亚急性光损伤模式对模型组和菊花低、高剂量组采用白光照射,光照强度10 000 lux,散瞳后连续光照7 d,每天4 h,累计共28 h,光照时将每只小鼠用透明隔板隔开,避免推挤后受损不均。对照组维持在12 h明暗交替光照环境下喂养。
光损伤7 d后对各组小鼠分别进行活体下视网膜电生理(ERG)、光学相干断层扫描(OCT)、荧光素眼底血管造影(FFA)检查,3 d后眼动脉放血法处死小鼠并取出眼球进行HE及Tunel染色,同时取眼动脉血进行超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性检测。
1.2 主要仪器及试剂光照设备(深圳市爱图仕影像器材有限公司),视觉电生理仪(德国罗兰),小动物视网膜显微成像系统(Phoenix research labs,型号:Micron Ⅳ,美国)。SOD测定试剂盒、CAT测定试剂盒(南京建成生物工程研究所),Tunel免疫荧光染色检测试剂盒(美仑生物技术有限公司),菊花提取液(天津科技大学提供)。
1.3 ERG检测小鼠暗适应12 h后50 g·L-1水合氯醛麻醉,散瞳双眼,将小鼠固定于动物台上,连接参考电极于头部,环形角膜电极固定于小鼠眼球,地极接于尾部,罗兰视觉电生理仪记录暗适应下光强度0.01 cds·m-2、3.00 cds·m-2及振荡电位(OPS)波形,明适应10 min后记录光强度为3.00 cds·m-2波形。
1.4 OCT检查ERG检测结束后,卡波姆眼凝胶涂眼,保持小鼠角膜透明性,瞳孔散大状态下应用Phoenix小动物视网膜显微成像系统对小鼠视网膜行OCT检查,观察各组小鼠视网膜各层形态。
1.5 FFA检查OCT检查结束后,100 g·L-1荧光素钠稀释至20 g·L-1后腹腔注射,采用Phoenix小动物视网膜显微成像系统,在固定的GAIN值下进行FFA检查并获取动静脉期小鼠视网膜血流图,Angiotool应用软件分析参数包括动静脉期小血管面积、小血管面积百分比和血管分支点个数。
1.6 HE染色及Tunel染色FFA检查结束3 d后待造影剂排出体外,采用眼动脉放血方法,处死小鼠,取眼球,福尔马林固定12 h后,取部分角膜,再次浸泡固定至少8 h,脱水,石蜡包埋处理后进行HE染色及Tunel 免疫荧光染色,分析对照组、模型组、菊花低剂量及菊花高剂量组视网膜神经节细胞(RGC)层、内核层(INL)、外核层(ONL)及视网膜总体细胞凋亡率。
1.7 生物化学检测眼动脉放血处死小鼠的同时收集其眼动脉血液,4 ℃恒温超速离心,取上清血清,测定小鼠动脉血清中SOD及CAT活性。

2 结果
2.1 OCT检查、眼底照相及HE染色OCT检查结果显示,光损伤后模型组视网膜出现了明显的RPE层下的弧形弓背向上的高反射信号,病变累及外界膜(ELM)以下的视网膜结构;眼底照相可见明显的视网膜渗出样改变。而对照组、菊花低剂量组及菊花高剂量组OCT检查和眼底照相均显示视网膜结构较完整平滑,未出现明显的结构改变(图1)。
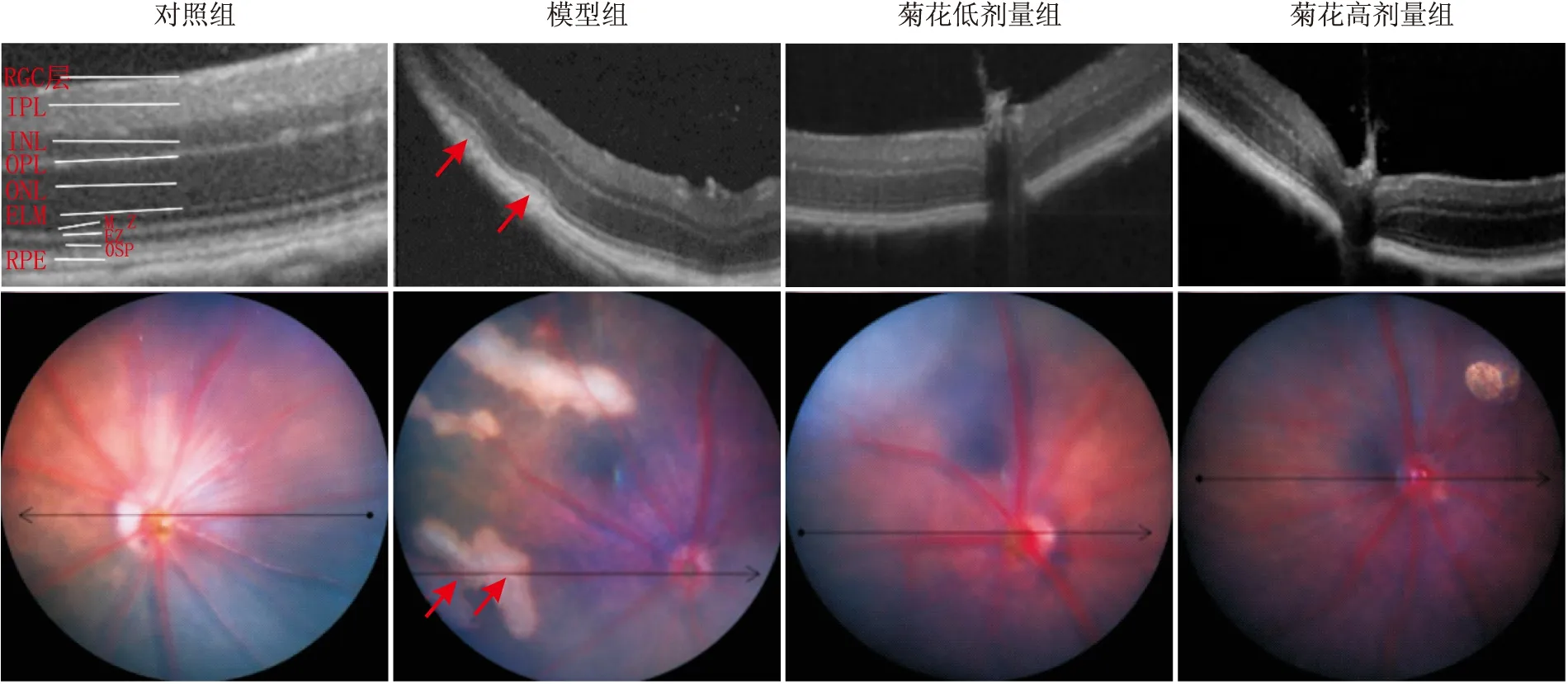
图1 各组小鼠视网膜OCT图像(上图)及眼底照相(下图) 模型组小鼠视网膜在OCT图像中出现了明显的结构异常,红色箭头所示RPE层及光感受器细胞层结构改变,呈弓背向上高反射信号带,眼底照相对应红色箭头处可见明显的视网膜渗出样改变。对照组、菊花低剂量组及菊花高剂量组小鼠视网膜OCT及眼底照相均未出现明显异常。IPL:外丛状层;OPL:外丛状层;MZ:肌样体带;EZ:椭圆体带;OSP:光感受器细胞外节。
HE染色:与OCT表现相似,对小鼠视网膜行HE染色结果显示,模型组视网膜光感受器细胞层、RPE层破坏明显,呈驼峰样隆起;而对照组、菊花低剂量及菊花高剂量组小鼠视网膜结构完整,光感受器细胞层及RPE层未出现明显损伤性改变(图2)。

图2 各组小鼠视网膜HE染色(×40) HE染色下可见模型组小鼠视网膜RPE层及光感受器细胞层结构破坏明显,红色箭头所示RPE层隆起、不连续,光感受器细胞层结构紊乱。对照组、菊花低剂量及菊花高剂量组RPE层及光感受器细胞层结构清晰,无明显损伤。
2.2 ERG检测结果ERG检测结果显示,暗适应下0.01 cds·m-2b波振幅模型组较对照组下降41.63%,菊花低剂量组b波振幅较模型组提高83.50%,菊花高剂量组b波振幅较模型组提高120.60%;暗适应下3.00 cds·m-2a波振幅模型组较对照组下降22.28%,菊花低剂量组a波振幅较模型组提高76.45%,菊花高剂量组a波振幅较模型组提高118.50%;以上差异均有统计学意义(均为P<0.01)。明适应下模型组3.00 cds·m-2a波振幅较对照组下降37.04%,差异有统计学意义(P<0.05);菊花低剂量组a波振幅较模型组提高26.37%,差异无统计学意义(P>0.05);菊花高剂量组a波振幅较模型组提高76.45%,差异有统计学意义(P<0.05)。明适应和暗适应下3.00 cds·m-2b波振幅各组间差异均无统计学意义(均为P>0.05)。OPS波振幅在各组间差异无统计学意义(P>0.05)(见表1和表2)。

表1 各组暗适应下ERG波振幅

表2 各组明适应下ERG波振幅
2.3 FFA检查结果小鼠后极部视网膜动静脉期小血管参数分析结果显示,小鼠视网膜后极部直径2~4 mm的小血管面积:模型组较对照组增加35.65%,差异有统计学意义(P<0.05);而菊花低剂量组较模型组降低20.89%,菊花高剂量组较模型组降低15.79%,差异均无统计学意义(均为P>0.05)。小血管面积百分比:模型组较对照组提高37.28%,差异有统计学意义(P<0.05);菊花低剂量组较模型组降低 20.52%,菊花高剂量组较模型组降低13.72%,差异均无统计学意义(均为P>0.05)。血管分支点个数:模型组较对照组增加64.49%,差异有统计学意义(P<0.05);而菊花低剂量组及菊花高剂量组较模型组分别降低34.29%及23.39%,差异均无统计学意义(均为P>0.05)(图3)。

图3 各组小鼠视网膜动静脉期FFA血流图(上)及Angiotool软件分析血流图像后取得相关参数(下) 模型组小血管面积、小血管面积百分比及视网膜血管分支点个数均较对照组明显升高,*P<0.05。
2.4 Tunel染色凋亡检测各组视网膜Tunel染色结果见图4,各组细胞凋亡率分析结果见图5。由图可见,模型组视网膜凋亡细胞明显增多,对照组RGC凋亡率为5%±1%,模型组为55%±28%;INL细胞凋亡率对照组为2%±1%,模型组为6%±2%;ONL细胞凋亡率对照组为1%,模型组为10%±4%;视网膜总体细胞凋亡率对照组为1%,模型组为10%±7%;以上各组差异均有统计学意义(均为P<0.01)。

图4 Tunel染色检测各组视网膜细胞凋亡 红色为凋亡细胞,蓝色为DAPI染色,可见模型组RGC层、INL、ONL细胞均有不同程度的凋亡。
菊花低剂量组RGC凋亡率较模型组降低73.18%,菊花高剂量组较模型组降低57.28%;菊花低剂量组INL细胞凋亡率较模型组降低78.31%,菊花高剂量组较模型组降低52.75%;以上差异均有统计学意义(均为P<0.01)。
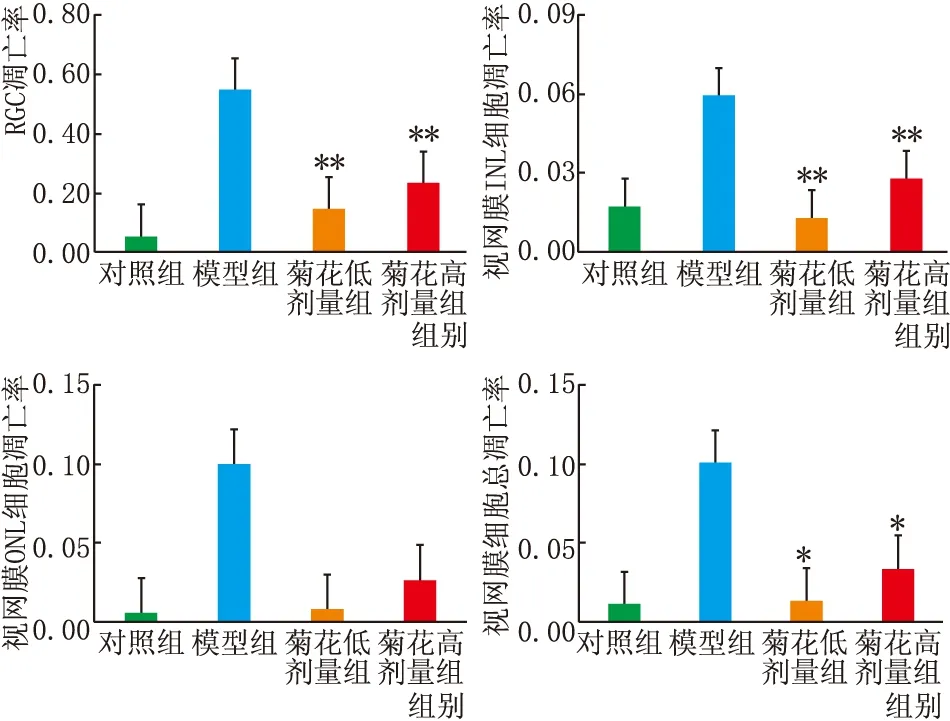
图5 Image J 分析各组小鼠视网膜各层细胞凋亡率 与模型组比较,*P<0.05,**P<0.01。
2.5 生物化学检测小鼠动脉血清中SOD及CAT活性对照组SOD活性与模型组差异无统计学意义(均为P>0.05),对照组CAT活性与模型组差异有统计学意义(P<0.05);而菊花低剂量组CAT活性较模型组提高48.57%,菊花高剂量组CAT活性较模型组提高185.12%,差异均有统计学意义(均为P<0.05)。SOD活性各组间差异无统计学意义(P>0.05)(图6)。

图6 各组小鼠血清SOD(A)及CAT(B)活性分析 其中SOD 无明显变化;CAT活性分析显示,与模型组比较,*P<0.05。
3 讨论
氧化应激损伤和一些危险因素(如年龄、吸烟、光毒性、遗传因素)的联合作用下,可引起RPE细胞及光感受器细胞的氧化应激和炎症反应的恶性循环,导致AMD的发生。光损伤可以使RPE层产生大量的ROS,同时诱发细胞凋亡。AMD的产生与亚急性炎症相关。而氧化应激产生的细胞凋亡可以诱发局部炎症反应。因此,采用强光照射并维持一定时间,有利于获得凋亡细胞积累和亚急性炎症的产生[12]。有研究[13]为证明氧化应激在AMD中的关键作用,在实验中增加或降低氧化产物,如CEP、MDA等引起的炎症反应和视网膜表型变化与AMD非常相似。老化的RPE细胞积聚一些溶酶体不可降解的物质,形成脂褐素。这些物质包括功能异常的线粒体,被吞噬的光感受器细胞的外节段[14]。早期阶段脂褐素的沉积并不会造成细胞代谢的异常,然而随着脂褐素的堆积,RPE细胞在体内作为永久细胞,积聚的脂褐素不能够通过增殖的方式稀释,占据于细胞内影响细胞线粒体及溶酶体功能长期的累及也会影响蛋白水解系统[15],由于蛋白水解能力的下降导致细胞外氧化蛋白的堆积而形成玻璃膜疣。目前有研究发现,细胞自噬功能异常和DNA损伤性反应(DDR)是AMD发生的重要机制,其主要原因也同样与ROS的水平增加有关。因此氧化性损伤不仅是细胞衰老的重要因素,同时也在AMD的发生发展中与炎症反应形成了恶性的病理循环机制,因此抗氧化损伤是预防年龄相关性疾病的重要手段[16]。综上,氧化应激反应ROS的产生在AMD的发生发展中都起到重要作用。
本研究中,C57BL/6J小鼠在接受光损伤后视网膜形态及功能出现明显异常和降低。OCT图像中,我们发现光损伤后小鼠RPE层下出现高反射信号带,EZ(富含线粒体)受损;HE染色发现光感受器细胞层出现明显的结构破坏,同时RPE细胞层结构异常,可见,活体及离体状态下小鼠在接受了光损伤后视网膜有关对抗氧化应激功能层出现明显异常,这可能与氧化应激后ROS大量产生、线粒体破坏、溶酶体系统破坏相关。从功能方面,根据全视野ERG分析方法,0.01 cds·m-2暗适应条件下b波主要反映视杆细胞功能,3.00 cds·m-2暗适应条件下反映视杆细胞及视锥细胞的混合反应,OPS波主要反映视网膜内层功能,3.00 cds·m-2明适应条件下,主要反映视锥细胞功能。本研究结果显示,受到光损伤后的小鼠主要以视杆细胞系统功能下降为主,而这可能与小鼠视杆细胞系统比较发达有关。FFA检查结果显示,视网膜光损伤后视网膜微小血管的密度增大,这可能提示新生血管的产生。视网膜细胞各层凋亡结果显示,光损伤后小鼠的视网膜各细胞层出现了不同程度的凋亡细胞增加,这不仅可以导致视网膜功能受损,同时加重视网膜溶酶体系统负担,可能导致细胞及细胞器堆积。
菊花提取液中含有丰富的黄酮、多糖等,本研究发现了应用菊花提取液干预后小鼠的ERG功能、活体及离体视网膜形态均发生了明显提高和改善。这与Kim等[17]研究发现菊花可以改善MPP+诱导的神经元细胞活力的丧失,降低了凋亡率,增加了Bcl-2的表达的结论相一致。Sun等[18]在体外野生菊花的抗紫外线损伤的研究中也发现,野生菊花提取液可以降低细胞中ROS水平,有对抗紫外线损伤和皮肤老化的作用。我们进一步通过Tunel染色法同样发现,光损伤后细胞凋亡明显。模型组RGC层细胞、INL细胞、ONL细胞均有凋亡增加的趋势,其中RGC层及INL细胞凋亡较明显,而菊花干预的小鼠,RGC层细胞凋亡率显著降低。血生化检测中我们发现抗氧化物质CAT活性在给予菊花提取液干预后明显提高。
综上,我们可以推测菊花提取液对视网膜的这种功能及形态学上的保护可能通过对小鼠抗氧化应激刺激,减少细胞凋亡起作用。菊花提取液对视网膜光损伤具有一定的保护作用,增加了体内抗氧化物质的产生,并减少了视网膜细胞的凋亡,未来有可能成为一种预防性药物用于治疗AMD。

