α-茄碱通过ROS/线粒体途径促进鼻咽癌细胞凋亡的分子机制
吴贤敏,张杰,杨子飞,叶凡,张悦,陈晓云
温州医科大学附属第一医院 耳鼻咽喉头颈外科,浙江 温州 325015
鼻咽癌(nasopharyngeal carcinoma,NPC)是一种起源于鼻咽部鳞状上皮细胞的恶性肿瘤,具有较高的发病率和病死率,因其解剖位置隐蔽和症状非特异性等特点,70%~80%的NPC患者往往出现局部晚期症状时才得以确诊[1]。目前,NPC的主要治疗手段主要包括早期放疗和晚期放化疗。然而,放疗会引起许多并发症,例如前庭功能障碍,放射诱发的视振荡,感觉神经性听力下降,渗出性中耳炎(otitis media exudative,OME)和颞骨放射性骨坏死(osteoradionecrosis,ORN),甚至是危及生命的大出血[1-2]。一些化疗药物(如顺铂)对NPC患者的疗效已经得到证实,但其耳毒性等不良反应限制了它们在临床上的应用[3]。因此,寻找新型低毒高效的药物对于治疗NPC具有重要意义。
α-茄碱是一种三糖糖苷生物碱,主要存在于马铃薯块茎和茄属植物中[4-6]。近年来,关于α-茄碱对各种人类癌细胞株的体内、外抗增殖活性的研究均有报道[7-11],然而,其潜在的细胞和分子机制尚未被完全阐明。本研究探究了α-茄碱在体外对NPC CNE-2细胞的抑制作用,旨在阐明α-茄碱对肿瘤细胞生物学行为的影响及其具体细胞分子机制,以期为NPC的治疗提供新思路,为新型抗肿瘤药物的研发提供实验基础和理论依据。
1 材料和方法
1.1 材料 人鼻咽癌细胞系CNE-2购自中国科学院上海生命科学研究所细胞库。α-茄碱和青霉素G购自美国Sigma公司;CCK-8试剂盒、RIPA裂解缓冲液及TRIzol试剂均购自北京Protein Biotechnology 公司;Annexin V-FITC/PI凋亡检测试剂盒购自美国BD Biosciences公司;Mito-SOX试剂盒购自美国Life Technologies公司;SDS-PAGE凝胶配制试剂盒购自美国Bio-Rad公司;ECL显色液购自美国 Abcam公司;一抗、二抗均购自美国Sigma公司;cDNA合成试剂盒购自美国Thermo Fisher Scientific 公司;FastStart Universal SYBR Green Master (Rox)试剂盒购自美国Roche Life Science公司;戊二醛、锇酸及乙酸铀酰均购自美国Sigma-Aldrich公司;丙酮购自上海国药集团化学试剂有限公司;环氧树脂购自英国TAAB公司;枸橼酸铅购自美国Polysciences公司。
1.2 方法
1.2.1 细胞培养:将CNE-2细胞系维持在RPMI-1640培养基中(培养基中加入10%胎牛血清以及100 kU/L 的青霉素G),置于37 ℃,5% CO2的培养箱中培养,每3天进行一次细胞传代。
1.2.2 给药处理:制备CNE-2细胞悬液,接种于96孔板或6孔板中,放置在37 ℃,含5% CO2的培养箱预培养。按0、5、10、15 μmol/L的浓度梯度,计算用量后将α-茄碱分别加入含RPMI-1640培养基的离心管中混匀。弃去旧培养液,每孔加入含不同浓度(0、5、10、15 μmol/L)α-茄碱的培养基,作用一段时间(12、24、48 h)后,用于后续实验。
1.2.3 CCK-8法检测细胞增殖:取对数生长期的CNE-2 细胞,以每孔2 000个细胞接种在96孔板中。24 h 后,用不同浓度的α-茄碱(0、5、10和15 μmol/L) 作用CNE-2细胞。经过不同的作用时间(12、24、 48 h)后,加入CCK-8试剂,避光孵育2 h后在酶标仪 上检测各孔OD值。根据结果选择出适宜作用时间。
1.2.4 流式细胞术检测细胞凋亡和ROS水平变化:用不同浓度(0、5、10、15 μmol/L)的α-茄碱作 用CNE-2细胞后,用胰蛋白酶消化并重悬细胞,离 心5 min收集细胞。PBS洗涤细胞2次,并以1×106个/mL的浓度重悬于1×结合缓冲液中,与ANXA5-FITC和碘化丙啶轻轻混匀,在37 ℃,5% CO2的环境下避光孵育30 min后,立即使用流式细胞仪分析细胞。每个实验至少重复3次。使用Mito-SOX试剂盒检测ROS水平。用不同浓度的α-茄碱(0、5、10、15 μmol/L)处理细胞后,用胰蛋白酶消化,并离心5 min。随后将细胞重悬于含有Mito-SOX的溶液中10 min,用PBS轻柔洗涤2次,通过流式细胞仪进行分析。
1.2.5 Western blot检测细胞凋亡相关蛋白的表达:将CNE-2细胞裂解后,通过BCA蛋白质定量试剂盒 测量蛋白质浓度。在10% SDS聚丙烯酰胺凝胶上分离样品,并将蛋白质转移到PVDF膜上。室温封闭缓冲液封闭膜1 h,然后与稀释后的一抗在4 ℃冰箱中孵育过夜。将膜在TBST中洗涤3次,然后在与HRP偶联的二抗溶液中(1:5 000配制)孵育1 h,再用TBST洗涤3次,用ECL显色液显色。每个实验至少重复3次。
1.2.6 qRT-PCR检测凋亡相关基因的表达:用TRIzol试剂提取CNE-2细胞的总RNA,并使用cDNA合成试剂盒进行反转录获得cDNA。使用FastStart Universal SYBR Green Master(Rox)试剂盒,在Applied Biosystems CFX96 实时PCR系统上进行qRT-PCR。所有设计的靶向mRNA的引物均经过验证。 qRT-PCR的条件如下:95 ℃预变性15 s,1个循环;然后95 ℃变性15 s,60 ℃退火60 s,72 ℃延伸20 s,共40个循环。用GAPDH对每种mRNA表达量进行标准化。
1.2.7 透射电子显微镜(transmission electron microscope,TEM)观察细胞超微结构变化:收集CNE-2细胞,2.5%戊二醛中固定24 h,1%锇酸中固定1~2 h。丙酮脱水,包埋在环氧树脂中。超薄切片用柠檬酸铅和乙酸铀酰染色,用蒸馏水轻轻洗涤,最后在JEM 1230 TEM上进行观察。
1.3 统计学处理方法 使用Microsoft Excel和GraphPad Prism6 软件进行统计分析。计量资料以±s表示,2组比较采用双尾非配对t检验,多组比较采用单因素方差分析,然后进行Dunnett多重检验。P<0.05为差异有统计学意义。
2 结果
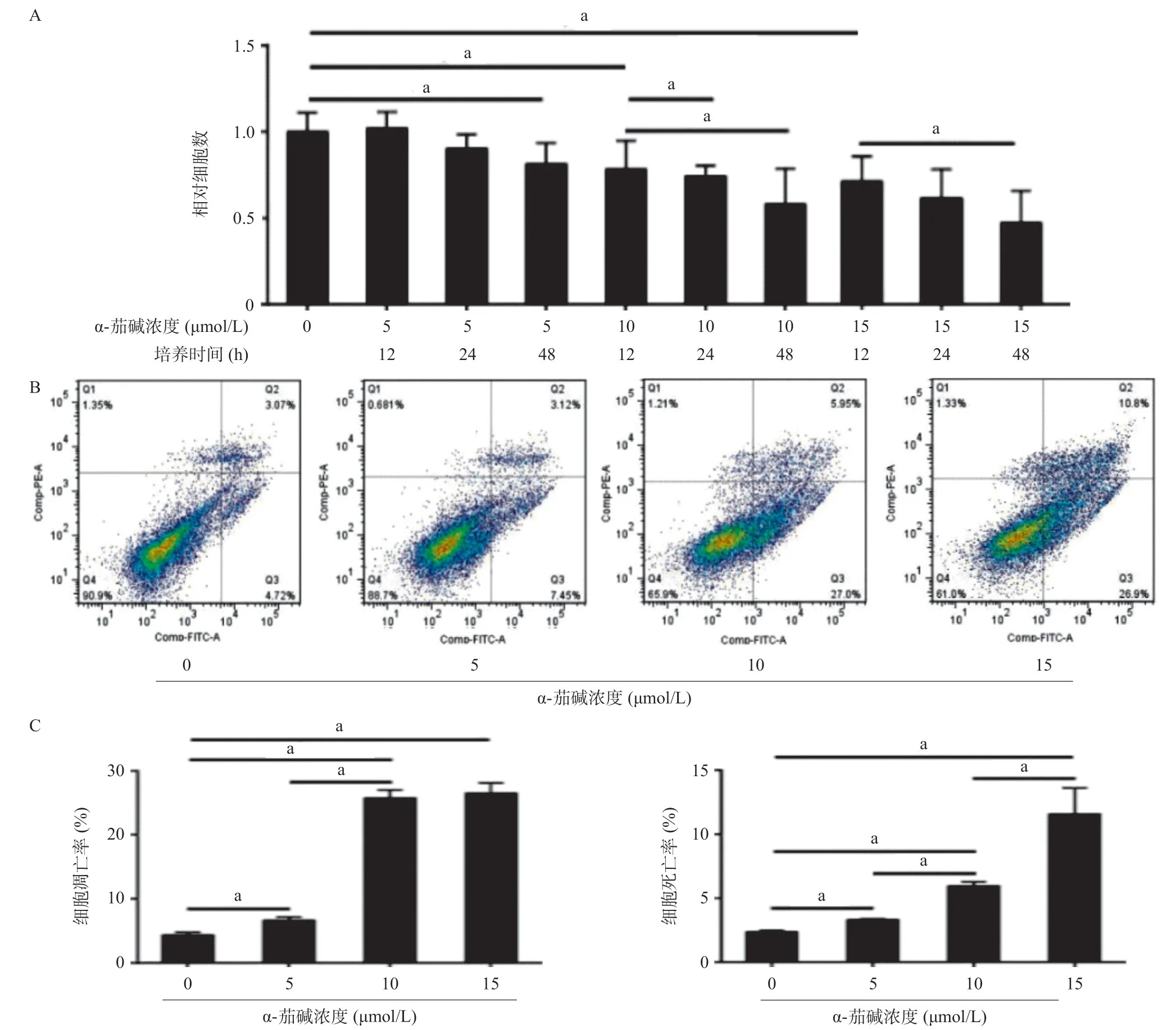
图1 α-茄碱对CNE-2细胞存活的影响
2.1 α-茄碱显著抑制CNE-2细胞的生长并诱导细胞凋亡 经不同的加药时间(12、24、48 h)以及不同浓度的α-茄碱(0、5、10、15 μmol/L)处理后,随着药物浓度和加药时间的增加,存活细胞数量显著减少(P <0.01)。当用5 μmol/L α-茄碱处理细胞12 h或24 h时,活细胞的比例与对照组比差异无统计学意义(P>0.05)。α-茄碱作用48 h对CNE-2细胞的抑制作用处于一个较为适宜的水平,因此在后续实验中也作用48 h。细胞活性检测结果表明,当药物浓度增加时,凋亡和死亡的CNE-2细胞的比例均显著增加(P<0.01)。见图1。
2.2 α-茄碱增加CNE-2细胞中ROS的产生 采用Mito-SOX Red线粒体超氧化物荧光探针(一种氧化还原荧光基团,可选择性检测线粒体超氧化物)检测α-茄碱处理48 h后CNE-2细胞中线粒体ROS水平。流式细胞术分析结果表明,与对照组比,当α-茄碱浓度增加时,线粒体ROS水平显著升高(P<0.01),见图2。
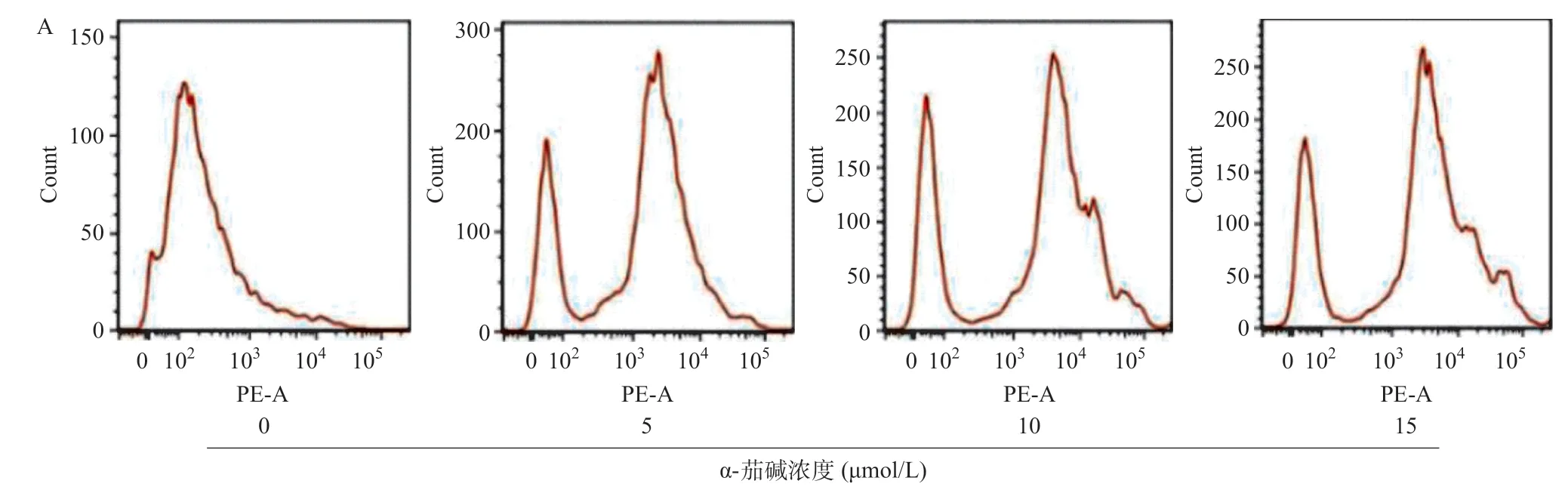

图2 α-茄碱作用后CNE-2细胞中ROS水平的变化
2.3 α-茄碱在CNE-2细胞中引起线粒体损伤 TEM显示CNE-2细胞线粒体损伤,表现为线粒体严重肿胀和线粒体嵴网络消失。正常细胞线粒体形态正 常,线粒体嵴丰富而清晰。我们还观察到,升高浓度的α-茄碱增加了功能障碍的线粒体的数量,同时减少了CNE-2细胞中自噬体的数量(见图3)。
2.4 α-茄碱影响凋亡相关基因的表达水平 10 μmol/L α-茄碱处理48 h后,CNE-2细胞中Aif(凋亡诱导因子)和Caspase-8的mRNA表达与对照相比明显增加 (P<0.01);FADD(Fas相关死亡域蛋白)的表达也增加,但与对照组相比差异无统计学意义(P>0.05)。α-茄碱处理后Bcl-2 表达量显著下降,尽管Bax的表达量没有显著变化,但Bcl-2/Bax比值显著降低 (P<0.05)。蛋白检测结果显示α-茄碱作用48 h后,Bcl-2表达及Bcl-2/Bax比值均明显低于对照组(P<0.05),这与qRT-PCR的实验结果基本一致。见图4。
3 讨论
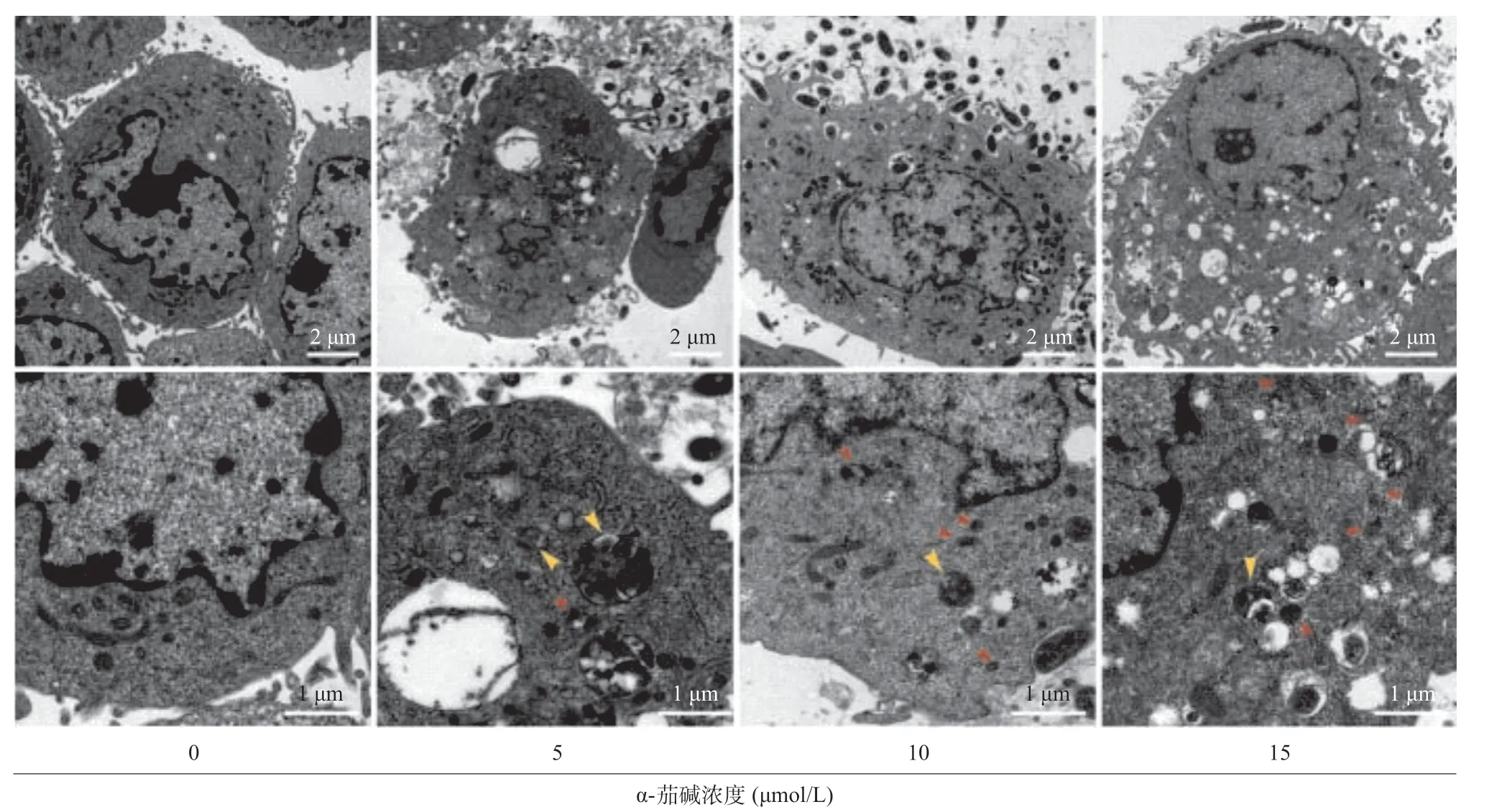
图3 α-茄碱作用后CNE-2细胞的超微结构变化(红色三角形为肿胀线粒体,黄色三角形为自噬体)
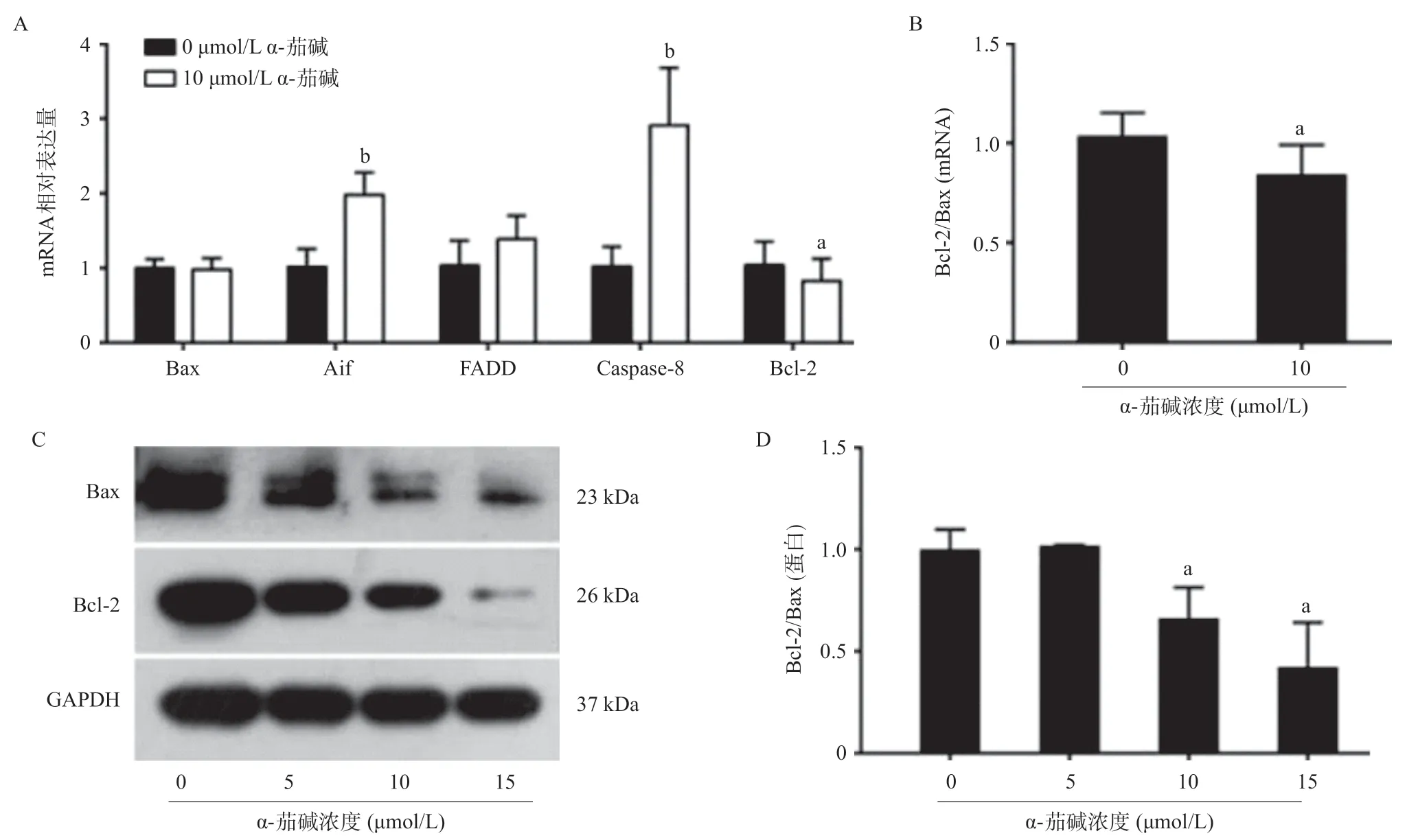
图4 不同浓度α-茄碱作用于CNE-2细胞48 h后凋亡相关基因mRNA及蛋白表达水平的变化
NPC是一种头颈部恶性肿瘤,具有明显的地区和种族分布特征,在东亚和东南亚尤为常见。遗传、种族、环境、饮食、EB病毒感染等因素均与NPC的发病相关[12]。目前,放射治疗是NPC的主要治疗方法。随着影像学技术的进步,调强放射治疗的出现以及同步放化疗在晚期肿瘤患者中的应用,NPC患者的生存率得到了显著提高,并发症相较以往也明显减轻[13]。然而,放疗仍会不可避免地损伤从颅底到颈部的受辐射区域的肿瘤相邻组织,进而导致一系列并发症,例如吞咽困难、听力下降、口干症,以及中耳炎等,严重影响患者的生活质量和治疗的依从性,有时甚至会引起危及生命的大出血[12-14]。因 此,开发特异和有效地靶向癌细胞的新型治疗药物具有重要的临床意义。α-茄碱是茄属植物中的主要糖苷生物碱,体外实验[15-18]及动物实验[9-10]均证实其具有良好的抗肿瘤效应。然而,目前α-茄碱对NPC的作用报道甚少,作用机制亦不明确。
细胞凋亡是抑制肿瘤细胞增殖的重要途径,可被多种细胞信号激活,其中氧化损伤引起的羟自由基等ROS是众多因素中至关重要的一种,ROS的生成增多能够增加细胞凋亡。线粒体途径作为细胞内源性凋亡的主要通路,由多种凋亡蛋白及抗凋亡蛋白调节,其中促凋亡蛋白Bax可以改变线粒体膜的通透性并促进细胞色素C的释放。与此相反,具有抗凋亡功能的Bcl-2 家族蛋白可以调节线粒体凋亡因子(如细胞色素C和凋亡诱导因子)的释放。当Bcl-2蛋白家族与Bax蛋白结合时,可以阻断细胞凋亡过程。Bcl-2 和Bax之间的比例失衡将导致细胞色素C的释放和Caspase-9的激活,进一步激活下游Caspase-3形成裂解的Caspase-3,最终导致细胞凋亡[19-20]。已有研究报道α-茄碱通过细胞凋亡途径来抑制肿瘤细胞增殖。有学者将α-茄碱用于食管恶性肿瘤细胞发现α-茄碱能够降低该细胞内Bcl-2 的表达,增加Bax表达并增加Caspase-3/7的活性[21]。有学者还发现在乳腺癌细胞上α-茄碱可以逆转细胞内Bcl-2/Bax比例并诱导细胞凋亡[10]。本研究通过Mito-SOX的流式细胞术分析显示,α-茄碱显著增加了线粒体ROS的生成水平,表明α-茄碱的抗肿瘤机制具有ROS依赖性;同时我们观察到Bcl-2/Bax比值的降低,Aif表达的增加以及线粒体的改变,表明α-茄碱在CNE-2细胞中诱导了线粒体介导的细胞凋亡。这些结果与先前的研究基本一致。然而,LEE等[22]在结肠癌细胞上发现α-茄碱会导致细胞色素C释放和Caspase-3的激活,但通过不依赖于ROS的线粒体凋亡途径介导细胞死亡。虽然这与我们以及之前的研究有所区别,但α-茄碱可以通过线粒体途径诱导肿瘤细胞凋亡可以得到证实,可能在不同肿瘤细胞上存在生物学差异性。
FADD(Fas相关死亡域蛋白)是细胞外源性凋亡途径的一个重要因子,能促进Caspase-8的活化,诱导死亡诱导信号复合物的形成,最终导致细胞发生凋亡[23]。我们的数据表明,α-茄碱可增加CNE-2细胞中的FADD和Caspase-8的表达,这也提示α-茄碱可以通过Fas介导CNE-2细胞外源性凋亡。
综上所述,本研究发现α-茄碱能引起CNE-2线粒体内ROS升高,进而导致线粒体损伤,最终引起细胞凋亡,而且其抗肿瘤效应随着药物浓度增加而增加,呈现出剂量依赖性。α-茄碱通过线粒体途径和Fas介导的死亡受体途径共同诱导细胞凋亡。总之,α-茄碱在体外对CNE-2细胞具有强大的抑制作用,可以作为NPC治疗的一种潜在的候选药物。

