基于CT血管成像的个体化自体动静脉内瘘三维数值模型
贾秀芬,刘瑾瑾,潘克华,郑尘非
温州医科大学附属第一医院,浙江 温州 325015,1.放射科;2.肾内科
血管通路是终末期肾衰患者维持血液透析的“生命线”,自体动静脉内瘘(arteriovenous fistula,AVF)由于方便、安全、使用寿命长等优点成为临床血管通路的第一选择[1]。AVF的功能不良同血透患者的病死率关联密切[2],故准确评估内瘘功能状态对维护、延长血管通路的使用十分关 键[3]。目前临床上取得在体AVF血流动力学参数主要依赖于多普勒超声和磁共振,两者可直接获得血流速度,但对结构复杂血流区的测量存在较大的误差[4]。计算机瘤体力学(computational fluid dynamics,CFD)已被证实可以真实模拟结构复杂血管的血流状况[5]。然而,鲜有研究基于CFD探讨建立活体AVF模型及血流动力学机制。本研究根据患者真实的CT血管成像(computed tomography angiography,CTA)原始数据建立个性化自体AVF的三维数值仿真模型来分析与AVF相关的血流动力学参数。
1 资料和方法
1.1 原始数据采集 选取1 例在温州医科大学附属第一医院行内瘘术的自体AVF作为研究对象,研究方案取得患者知情同意。采用GE Lightspeed 64排CT获取原始断层数据。患者仰卧位,患肢屈曲于胸前,进针肢举过头顶,获取定位片后以3.5~4.5 mL/s流速经肘正中静脉高压注射80 mL非离子型对比剂碘海醇(350 mgI/mL),随后立即注射0.9%氯化钠溶液30 mL。扫描范围包括内瘘区的流入动脉端、吻合口和流出静脉端。采用智能阈值触发扫描,ROI被设定在升主动脉水平,触发阈值150 Hu, ROI中CT值达阈值时延迟15 s增强扫描。层厚 0.625 mm,层间距0.625 mm,管电压120 kV,管电流200~220 mAs,检查结束后,安排患者当天进行血透加速输入体内的碘剂排出。获取的原始数据直接以DICOM格式存储。本研究经医院伦理委员会审核批准。
1.2 建模环境 于Windows平台中创建自体AVF的三维有限元模型。配置:惠普P7370Intel(R) Core(TM)2 Duo CPU 2.00 GHz,内存2.00 GB,Windows7操作系统。利用软件:医学三维图像生成及编辑处理软件Mimics10.0(比利时Materialise 公司),有限元分析软件ANSYS 11.0,ANSYS Workbench 11.0,CFX 11.0(美国ANSYS公司)。
1.3 自体AVF三维数字化模型的构建 用Mimics软件直接读取DICOM格式的CT原始断层图像,联合运用阈值分割和手动分割取得感兴趣区部位[6],包括瘘口动脉端、瘘口、静脉端,进而对图像实行三维实体重建(见图1A),之后进行自体AVF的网格优化,本模型在构建时生成有限元单元数1183169(见图1B),最终把取得的重建模型数据以ANSYS文件及MESH文件保存、输出。

图1 自体AVF三维数字化模型
1.4 血流动力学模型
1.4.1 控制方程:设定血液是层流、不可压缩黏性的牛顿流体,其包含连续方程、能量方程和动量方程[7]。本研究忽略能量的传递,如热量,故不考虑能量方程。另假设不计重力,故控制流动的方程采用不可压缩的Navier-Stokes方程。
1.4.2 边界条件:假定血流和管壁之间没有滑移和物质交换,把血管壁设定为刚性,将血管壁弹性和厚度对血流动力学机理的影响忽略不计。
2 结果
前臂自体AVF CTA(见图2A)显示吻合口未见明显狭窄(约5.1 mm),吻合口静脉端近段瘤样扩张(约20.2 mm×27.2 mm),瘤内未见血栓形成。本研究借助CTA原始断层数据联合Mimics软件成功构建了具有真实血管解剖结构和血流数据的在体AVF三维数值模型,其是网格优化模型和有限元分析处理前模型,具有良好的结构相似性和生物学形态,可以多角度、真实重现AVF。根据血流流线图(见图2B),AVF吻合口的动脉端血流绝大多数进入静脉端扩张的瘤体内。血流在近吻合口动脉端最大(图2B中显示红色区域),进入瘤体后减速,因为瘤体体积的扩大,依据几何空间的特点,血流主要分为主血流和次血流两部分,进入扩张瘤体内后沿着瘤壁顺着流线的方向流向远端,绝大部分流向出口(红色箭头),称为主血流区,小部分沿着外侧壁径直流向出口(黑色箭头),称为次血流区。主血流区内有小部分血流朝瘤体中心发展成小涡流后再流向出口(黄色箭头)。次血流则沿着瘤壁直接流向出 口。主血流流量大、分布广,对静脉端瘤样扩张的作用是主要的。
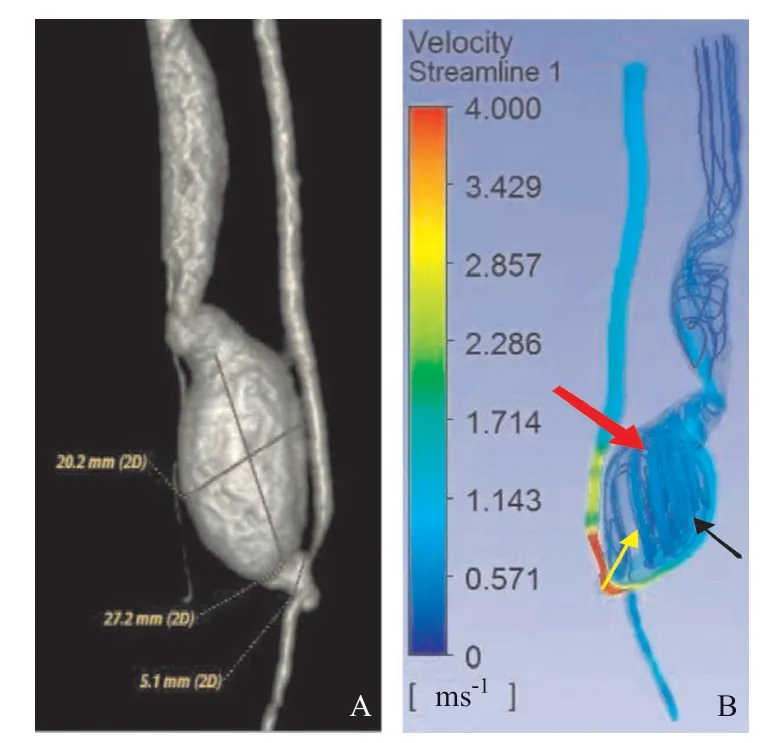
图2 动静脉内瘘CTA(A)及血流流线图(B)
3 讨论
良好而稳定的血管通路为终末期肾病患者长期血透的必备条件,自体AVF为目前首选的透析通 路[8]。有研究显示采用自体AVF的血透患者其生存时间明显高于其他血管通路[9]。自体内瘘术改变了术区的血流动力学,且由于长期反复穿刺透析,容易引起内瘘并发症的发生,最终引起血管通路功能的丧失[10]。当前AVF功能不良是困扰医师和患者的首要问题。对于血液透析患者来说,其外周血管的质量较差,故符合内瘘手术条件的血管非常有限,如发生并发症后重新造瘘,将进一步减少可供利用的 血管资源[11],因此,定期内瘘监测非常重要[12-13]。
3.1 自体AVF的影像学监测方法 当前各国针对自体AVF功能不良的影像学监测方法主要包含多普勒超声、CT血管造影、MR血管造影、DSA等[2,14]。多普勒超声可以观察患者的血管形态,监测内瘘血管的管径变化、管腔狭窄程度、流速等[15],经济、简便,但其对操作者的诊断水平、操作时手法等依赖性较高,且不能充分显示深部的血管和静脉流入段血栓,不能直接显示血管通路的全景图等,从而影响超声检查的敏感性和可靠性[16-17]。MR血管造影具有无创、不注射造影剂等优点,近年来亦被应用于血管造影,但检查费用高、耗时、噪音大、相对和绝对禁忌证多[18-19],空间分辨率相对较低,并且大多数透析患者的血管壁质量较差,容易存在伪影干扰而图像失真。DSA是诊断血管功能不全的“金标准”,但其有创、操作复杂、辐射较大、费用高、可引起血管痉挛等缺点,限制了临床的广泛应用。
随着多层螺旋CT技术的发展,对AVF患者进行CTA检查技术目前非常成熟,且基层医院普遍配备螺旋CT,其临床应用价值高。CTA具有较高的空间、时间分辨率,扫描时间短,运用多种后处理重建技术如容积再现、最大密度投影、曲面重建等可以三维立体全景式显示内瘘血管,相对于DSA其无创、经济、方便,是透析患者首选的检查技术之一,但CTA对病灶血管的显示主要局限在形态学方面,无法提供血流动力学信息。
3.2 CFD模型评价自体AVF的应用价值 CFD是通过计算手段,对流体进行数值模拟的一类学科。当前AVF CFD研究多局限于动物模型或基于理想化的实验模型。然而AVF是非正常生理状态下血管结构,其流体环境有高流量、低阻力、锐转角等独有的特征,任何细微的几何结构改变都能引起血流状态巨大改变,故实验研究模型无法准确显示真实AVF的血流动力学特征。
目前CFD技术已日趋成熟,CTA影像在某种程度上能代替DSA,而且临床上操作方便无创,基于CTA原始数据的有限元模型已经成为创建三维有限元模型的主要方法[20]。通过CFD模型可以无创地获得内瘘的真实血流动力学信息(含血流线图、血流压力、血管壁剪切力、流速等),可以更好地定量分析内瘘区血流运动模式及血流-血管壁相互作用情况,以便更好理解实际瘘口的血流动力学机制。
本研究借助于活体真实的CTA数据,在充分考虑AVF影像学特征的基础上,利用CFD技术重建血管、血流成功构建了AVF的三维数字化模型,分析了内瘘区血流动力学参数。其图像来源于真实的活 体,有限元的模型几何准确度高,能直观、重复地模拟AVF及其血流动力学参数,是揭示AVF功能不良的形成机制及预测并发症形成的有效手段。血流流线图中可以观察到内瘘区血流流速在近吻合口动脉端最大,静脉端则在近瘤颈部流速最大,提示瘤颈区血流状态可能与瘤样扩张的形成有关,这与范志远等[6]提到在血管分叉及弯曲处,高流速和不稳定的涡流破坏血管壁内皮细胞从而引起内皮细胞发生形态和功能变化相一致;在扩张的瘤体中血流流速整体下降,并见其内分为主血流区和次血流区两种状态,主血流流量大、分布广,推测瘤体内的低流速与静脉端的瘤样扩张的发展相关。
本研究借助CFD技术构建的AVF模型为功能不全患者复杂的内瘘提供可视化的真实数字模型,从而为临床医师在实践中对自体AVF的使用及维护提供客观的参考依据,为临床上进一步研究AVF功能不良的起因和发展提供一个新的角度。
本研究是在定常情况下建立的三维刚性自体AVF模型,忽略了血管壁本身的弹性因素,故今后对弹性AVF模型仍需做进一步探索和研究,以便能更加真实地反映在体内AVF的血流信息。

