一种温敏型凝胶子宫灌注液的制备及药物浓度的监测
于 洋,华成云,许 颖,冯云云,刘 宇,黄显会
(华南农业大学兽医学院,广东广州510642)
子宫内膜炎是母猪在生产过程中或产后受到大肠埃希菌、链球菌、葡萄球菌等病原微生物侵袭而引发的炎症[1]。患病后会导致母猪泌乳量减少、发情周期紊乱、屡配不孕,增大母猪的淘汰率[2],给养猪场带来巨大的经济损失,因此选择合适的药物和给药途径治疗母猪子宫内膜炎十分重要。多西环素是四环素类广谱抗菌药,目前在兽医临床上主要用于治疗畜禽由大肠埃希菌、沙门氏菌、支原体等病原微生物感染的疾病[3],与其他同类药物相比具有抗菌活性强、体内分布广、生物利用度高等优点[4]。有研究指出,多西环素对奶牛子宫内膜炎有很好的治疗效果[5],而且组织穿透能力强,因此常用于治疗子宫内膜炎等器官深部感染性炎症。
子宫内膜炎是发生在子宫这种深部器官的炎症,若采取肌肉注射的方式,药物很难到达作用部位起到治疗效果,因此一般采用子宫灌注的方式对母猪子宫内膜炎进行治疗。但普通的子宫灌注液到达子宫内时为液体状态,易流动导致药物损失,从而降低治疗效果,因此研制出一种定位准确且能减少药物损失的制剂尤为重要。温度敏感型原位凝胶是一种新型给药系统,以液体状态给药后,受给药部位温度的变化能发生相转变形成半固体凝胶[6],目前已广泛应用于鼻腔[7-9]、眼部[10-11]、阴道[12]等部位给药。与传统子宫灌注液相比,温度敏感型原位凝胶子宫灌注液到达子宫后变为半固体状态,更易黏附在子宫内,不易流失,在提高患病部位局部药物浓度的同时还具有缓释效果。
本研究选择温敏型原位凝胶给药系统,以多西环素为主药、泊洛沙姆407(P407)和泊洛沙姆188(P188)为主要的温敏材料,经处方筛选和优化后,研制出一种多西环素温敏型原位凝胶子宫灌注液,对其进行了体外溶蚀考察和质量评价,并对给药后该制剂在子宫内的药物浓度进行了监测,为临床使用多西环素治疗母猪子宫内膜炎提供新途径。
1 材料与方法
1.1 药品与试剂
多西环素标准品:w为90.5%,批号YD171101008,由中国兽药药品监察所提供;多西环素原料药:w为90.9%,批号YD180201030,由扬州联博药业有限公司提供;P407:批号WPWL404B,由德国BASF公司提供;P188:批号WPWL537B,由德国BASF公司提供;乙腈:色谱纯,批号LOT122269,由Fisher Scientific公司提供;甲醇:色谱纯,批号LOT120511,由Fisher Scientific公司提供;9 g/L 生理盐水:批号D17070602,由四川科伦药业股份有限公司提供;PBS缓冲液:批号LOT8118291,由Fisher Scientific公司提供;盐酸、冰乙酸、乙酸铵、氯化镁等均为国产分析纯。
1.2 仪器
分析天平:AUX120型,日本SHIMADZU(岛津)公司;药品稳定性试验箱:Blue pard 型,上海一恒科学仪器有限公司;高效液相色谱仪:岛津SIL-20A,Shimadzu 公司;恒温水浴振荡器:SHA-C 型,常州澳华仪器有限公司;pH 计:PHSJ-25型,上海雷磁仪器厂;涡旋仪:XW-80A 型,上海沪西分析仪器厂有限公司;磁力搅拌器:MSI 型,马来西亚IKA 公司。
1.3 多西环素温敏型原位凝胶的制备
1.3.1 处方筛选 以多西环素为主药、P407和P188为温敏材料,对抗氧化剂、金属络合剂、pH调节剂等辅料进行初步筛选。多西环素温敏凝胶一般在pH 4.0左右的环境中稳定,用于弱酸性环境的常见抗氧化剂有亚硫酸氢钠和焦亚硫酸钠,常见金属络合剂有氧化镁、氯化镁、氯化钙、乙二胺四乙酸二钠等。通过单因素试验最终确定金属络合剂为氯化镁,抗氧化剂为亚硫酸氢钠,pH 调节剂为乙醇胺。
选择合适温度的泊洛沙姆溶液,对泊洛沙姆溶液、金属络合剂、抗氧化剂、p H 调节剂的不同比例进行4因素3水平的正交试验,按照L9(34)正交表设计试验方案,选择出各辅料合适的用量,确定最佳处方。
1.3.2制备工艺 采用“冷法”工艺[13]制备。按照处方量称取多西环素原料药1 g、P407 10 g、P188 2.5 g、氯化镁2.3 g 和亚硫酸氢钠0.1 g;将P407和P188加入到34 mL 4℃的超纯水中搅拌均匀,4℃条件下静置24 h 待P407和P188充分溶胀形成澄清溶液,得到空白凝胶溶液;随后将多西环素原料药和其他辅料加入到配制好的空白凝胶溶液中,涡旋,超声搅拌使其充分溶解;用乙醇胺调节溶液pH,放置于4℃条件下,待气泡除去,形成的澄清溶液即为多西环素温敏型原位凝胶。
1.3.3胶凝温度的测定 采用倒置试管法[13]测定。取2~3 mL多西环素温敏型原位凝胶置于玻璃试管中,插入温度计,将玻璃试管放入恒温水浴锅中,缓慢升温;将试管倒置,试管中溶液不再流动时的温度即为胶凝温度。
1.3.4性状观察 观察并记录多西环素温敏型原位凝胶的形态及颜色变化。
1.4 多西环素温敏型原位凝胶子宫灌注液药物含量测定
参照《中华人民共和国兽药典(2015版)》[14]高效液相色谱法测定。色谱条件:色谱柱为Phenomenex/Kinetex EVO C18柱(4.6 mm×250 mm,5μm);流动相为醋酸盐缓冲液(0.25 mol/L 醋酸铵溶液、0.10 mol/L乙二胺四乙酸二钠和三乙胺按照体积比100∶10∶1配制,用冰醋酸或氨水调节p H至8.8)和乙腈,体积比为84∶16;检测波长280 nm;流速1 mL/min;柱温35℃;进样量20μL。测定方法:精密称取多西环素(w为2%)温敏型原位凝胶子宫灌注液0.5 g,置于100 mL 棕色容量瓶中,加0.01 mol/L盐酸溶液溶解并标定至100 mL,摇匀,制备成质量浓度为100μg/mL的多西环素溶液,作为供试溶液;精密称取多西环素标准品110.45 mg 于100 mL棕色容量瓶中,加0.01 mol/L 盐酸溶液溶解并定容至刻度,摇匀,4 ℃保存,制得质量浓度为1000 μg/mL的多西环素标准储备液;精密量取20μL供试品溶液,注入高效液相色谱仪,记录色谱图;将标准储备液用0.01 mol/L盐酸溶液稀释10倍后,精密量取20μL,注入高效液相色谱仪,记录色谱图;按外标法以峰面积计算供试品中多西环素的含量。
1.5 体外溶蚀及多西环素释放测定
1.5.1体外溶蚀 采用无膜溶出模型[15]研究多西环素温敏凝胶子宫灌注液的溶蚀及药物的体外释放情况。精密称取多西环素温敏凝胶子宫灌注液5 g,加入预先称质量的玻璃试管中,称质量,在(37±0.5)℃条件下平衡5 min,完全形成凝胶后加入2 mL 37℃的释放介质,在恒温水浴振荡器中以100 r/min 振荡,分别在1、2、4、6、8、12、24、36、48 h 后立即倾倒出全部释放介质,称质量并记录;然后重新于(37±0.5)℃条件下平衡5 min,加入2 mL 37℃的释放介质,如此反复操作,直至溶蚀完。释放介质分别为pH=7.2的PBS缓冲溶液和9 g/L生理盐水,每种释放介质设置3个平行管,取平均值。相邻时间点的样品质量差即为此期间的凝胶溶蚀量。各时间点多西环素温敏型原位凝胶子宫灌注液的累积溶蚀率(M)按公式(1)进行计算。

式中,Mt为t时刻多西环素温敏原位凝胶累积溶蚀量,g;M0为多西环素温敏原位凝胶初始质量,g。
1.5.2体外释药 取不同时间点的溶蚀液,全部倒入100 mL 容量瓶中,用0.01 mol/L的盐酸溶液稀释定容至100 mL,经0.22μm 滤膜过滤,制备成供试品溶液,按照“1.4”色谱条件上机检测进行药物含量测定,并将每次测得的多西环素释放量累加后与凝胶中多西环素的总质量相比,按公式(2)计算多西环素温敏型原位凝胶子宫灌注液的累积释药率(Q)。

式中,Qt为t时刻多西环素温敏型原位凝胶中多西环素的累积释放量,g;Q0为多西环素温敏型原位凝胶中多西环素的总质量,g。
1.5.3溶蚀行为与释药行为的关系 将多西环素温敏型原位凝胶子宫灌注液的累积溶蚀量、多西环素累积释放量与时间按照零级动力学方程、一级动力学方程和Higuchi 动力学方程进行拟合,探究最佳溶蚀及释药模型。随后以凝胶制剂的累积溶蚀率为横坐标、多西环素累积释放率为纵坐标作图,探究制剂溶蚀与释药行为之间的关系。
1.6 多西环素温敏型原位凝胶子宫灌注液稳定性试验
1.6.1影响因素试验 强光照射试验:将3批多西环素温敏型原位凝胶子宫灌注液放置于药品稳定性试验箱中,光照强度为(4500±500)lx,在第0、5、10天取样,观察其外观性状、p H、胶凝温度,按照“1.4”色谱条件上机检测多西环素含量变化。
高温试验:将3批多西环素温敏型原位凝胶子宫灌注液放置于密闭洁净恒温箱中,恒温箱温度为40℃,在第0、5、10天取样,观察其外观性状、pH、胶凝温度,按照“1.4”色谱条件上机检测多西环素含量变化。
高湿试验:将3批多西环素温敏型原位凝胶子宫灌注液放置于密闭洁净容器中,容器环境条件为25℃、相对湿度90%,在第0、5、10天取样,观察其外观性状、pH、胶凝温度,按照“1.4”色谱条件上机检测多西环素含量变化。
1.6.2加速试验 将3批多西环素温敏型原位凝胶子宫灌注液放置于人工气候培养箱中进行180 d试验,培养箱环境条件为(30±2)℃、相对湿度(65±5)%,试验期间第0、30、60、90、180天取样,观察其外观性状、p H、胶凝温度,按照“1.4”色谱条件上机检测多西环素含量变化。
1.6.3长期稳定性试验 将3批多西环素温敏型原位凝胶子宫灌注液放置于人工气候培养箱中进行180 d 试验,培养箱环境条件为(25±2)℃、相对湿度(60±10)%,分别于第0、90、180天取样,考察其外观性状、pH、胶凝温度,按照“1.4”色谱条件上机检测多西环素含量变化。
1.7 母猪子宫内药物浓度监测试验
1.7.1给药与采样 试验动物:5头二元杂母猪,体质量均200 kg 以上,自由采食和饮水。
给药方法:采用子宫灌注的方式给药,灌注液制剂的给药剂量为50 g/头,在第1次给药后,间隔1 d 进行第2次给药。
取样方法:分别于第1次给药12、24、36 h 后,第2次给药前;第2次给药8、12、24、36、48、72、96 h后进行采样。用深部输精管深入子宫颈处,灌入20 mL灭菌水,抽动20次深部输精管,3 min 后用注射器吸取样品,做好记号,放入−20℃冰箱中保存。
1.7.2样品前处理方法 取母猪子宫试液解冻,混匀。精密吸取0.5 mL 于2 mL 离心管中,加入1 mL 甲醇,涡旋混匀5 min 后振荡10 min,4℃、12 000 r/min 离心10 min,吸取上清液,经0.22μm 微孔滤膜过滤至2 mL 棕色进样瓶中,按照“1.4”色谱条件上机检测。
2 结果与分析
2.1 处方筛选结果
通过单因素分析试验筛选各辅料合适的用量范围,选择对制剂稳定性影响较大的4个因素作为考察因素进行正交试验,每个因素考察3个水平。以多西环素的含量变化作为主要评价指标,25℃避光条件下,在制备制剂后的第0和7天取样测定制剂中多西环素的含量,计算多西环素的含量变化。正交试验设计和具体结果见表1。其中,平均值1、2、3分别代表了4个考察因素为1、2、3水平时多西环素含量变化的综合平均值,极差代表了各因素对制剂稳定性的影响幅度。
根据极差越大影响程度越大的原则,通过极差分析,各因素对制剂稳定性的影响程度依次为抗氧化剂>金属络合剂>pH调节剂>泊洛沙姆溶液。对各均值进行分析,均值越小代表含量变化越小,制剂越稳定,得到各因素的最佳水平分别为泊洛沙姆溶液:18%(w)P407、3%(w)P188;络合物摩尔比:5∶1>3∶1>1∶1;亚硫酸氢钠含量(w):0.20%>0.10%>0.15%;pH:4.0>3.0>初始pH。因此,该制剂的最佳处方配比应为18%(w)P407、3%(w)P188,金属络合剂氯化镁与多西环素的摩尔比例为5∶1,亚硫酸氢钠含量(w)为0.20%,pH 为4.0。但18%(w)P407和3%(w)P188的机械强度较弱,形成凝胶后溶蚀较快,达不到很好的缓释作用,且通过极差分析结果可知,泊洛沙姆溶液对该制剂稳定性的影响非常小,综合对各因素的考察结果,最后选用了20%(w)P407和5%(w)P188,该比例形成的凝胶机械强度更大缓释效果也更明显。经优化最终组方确定如下:50 g制剂含P407 10 g、P188 2.5 g、氯化镁2.3 g、亚硫酸氢钠0.1 g,用乙醇胺调pH 至4.0±0.2,余量为超纯水。

表1 正交试验设计和结果1)Table 1 Design and result of orthogonal experiment
2.2 胶凝温度及性状观察
多西环素温敏型原位凝胶子宫灌注液室温条件下为均匀淡黄色澄清液体(图1a),室温放置180 d颜色未发生改变,也未有沉淀出现。胶凝温度大约在30℃,当温度超过30℃时呈现半固体凝胶状态,如图1b所示。
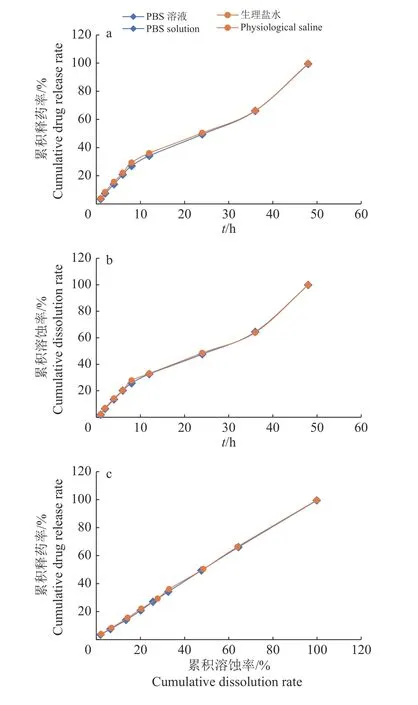
图2 体外溶蚀与释药结果Fig.2 Results of in vitro dissolution and drug release

图1 多西环素温敏凝胶性状Fig.1 Characteristics of doxycycline thermo-sensitive gel
2.3 体外溶蚀与释药
多西环素温敏凝胶在PBS缓冲液和生理盐水中的溶蚀及释药情况见图2a、2b。无论在PBS缓冲液还是生理盐水中,多西环素温敏凝胶累积溶蚀和累积释药时间均达48 h,证明该制剂缓释效果良好。
制剂累积溶蚀率与累积释药率对时间的拟合结果显示,在释放介质中制剂溶蚀与释药均符合零级动力学过程,与时间有良好的线性关系,得到的线性方程为:PBS溶液释放介质中,y=0.990 8x+1.399 1,R2=0.9996;生理盐水释放介质中,y=0.987 7x+2.087 4,R2=0.999 4。累积释药率与制剂累积溶蚀率进行线性回归,由图2c可知,在2种释放介质中,制剂累积溶蚀率和累积释药率均具有良好的线性关系,累积释药率随制剂累积溶蚀率的增加而增加,制剂溶蚀决定了释药情况。
2.4 稳定性试验
2.4.1影响因素试验 在强光照射和高湿条件下多西环素温敏原位凝胶均较稳定,但高温对制剂中的多西环素含量影响较大。
2.4.2加速试验和长期稳定性试验 加速试验和长期稳定性试验结果分别见表2和表3。在180 d加速试验和长期稳定性试验中,多西环素温敏凝胶的pH及胶凝温度均未有明显变化,多西环素含量稳定,证明该制剂较为稳定。
2.5 母猪子宫药物浓度监测
监测结果显示,给药后母猪子宫内的药物质量浓度始终维持在一个很高的水平,其中第1次给药36 h 后子宫内药物质量浓度最低,为44.05μg/mL,第2次给药12 h 后最高,为472.91μg/mL,另外第2次给药96 h 后子宫内药物质量浓度仍能保持在很高的水平,表明该制剂缓释效果良好,具体数据见表4。

表 2多西环素温敏型原位凝胶子宫灌注液加速试验结果Table2 Resultsof acceleration test of doxycycline thermo-sensitive in situ gel uterine perfusate
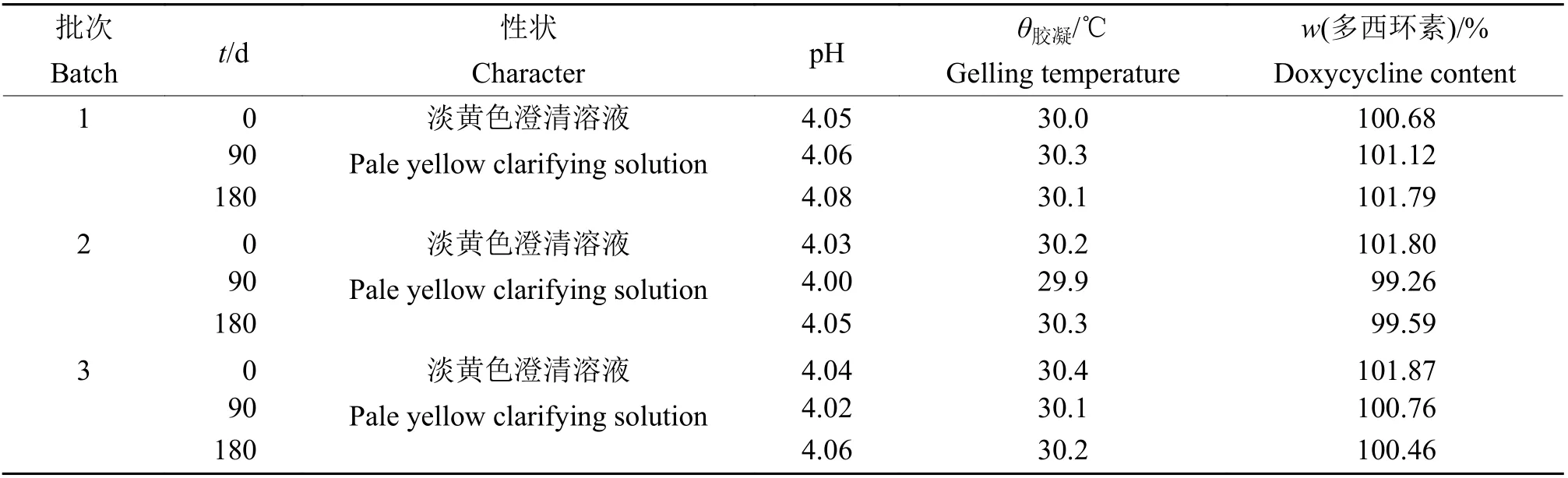
表3 多西环素温敏型原位凝胶子宫灌注液长期稳定性试验结果Table 3 Results of long-term stability test of doxycyclinethermo-sensitive in situ gel uterineperfusate
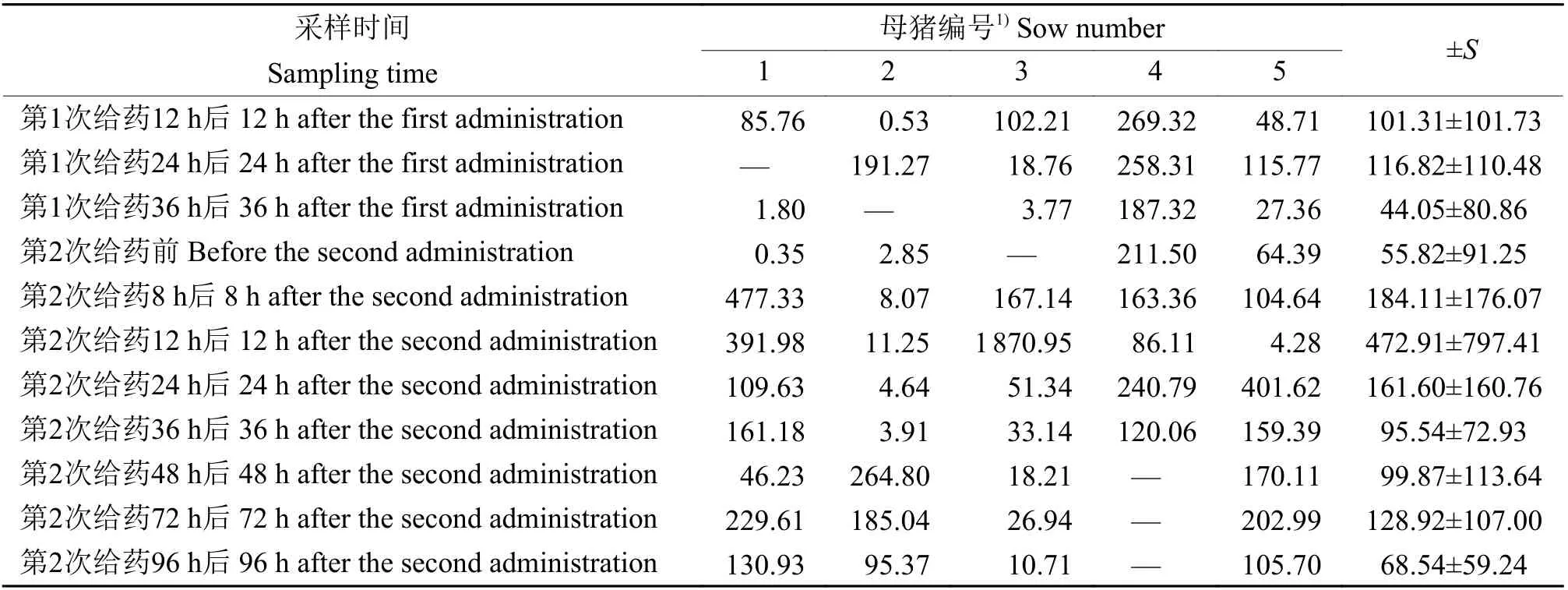
表4 多西环素温敏型原位凝胶子宫灌注液在母猪子宫内的药物质量浓度Table 4 Drug massconcentration of doxycycline thermo-sensitive in situ gel uterineperfusate in sow uterusρ/(μg·mL−1)
3 讨论
P407具有良好的温度敏感性和生物相容性,是制备温度敏感型原位凝胶理想的辅料[16],但仅使用P407会使制得的凝胶机械强度低,胶凝温度低,溶蚀快,作用时间短。有研究表明在P407中加入P188可以显著改善凝胶的机械强度和胶凝温度[17-18],因此本试验加入P188作为胶凝温度调节剂来改善胶凝温度。同时P407和P188比例的选择也是整个处方设计的关键,有研究指出在原位凝胶给药体系中P407最佳质量分数为20%[19-20],综合各方面因素,最终选择20%(w)P407和5%(w)P108作为凝胶基质,在改善胶凝温度的同时还可以增强机械强度达到缓释效果。另外,作为主药的多西环素具有不稳定和易氧化的特点,因此处方中加入了氯化镁作为金属络合剂、亚硫酸氢钠作为抗氧化剂增强多西环素温敏型原位凝胶的稳定性。
泊洛沙姆凝胶常用的制备方法有“热法”和“冷法”[21]。与“热法”相比,“冷法”虽然制备时间较长,但不会使不耐高温的药物受损。考虑到多西环素不耐高温,所以本试验采用“冷法”制备凝胶。
《中华人民共和国药典》[22]对原位凝胶体外溶蚀量和释药量的考察方法并未给出明确的规定,目前常用的评价模型有2种,即有膜溶出模型和无膜溶出模型[23]。本试验制备的药物凝胶进入体内后将与子宫黏膜直接接触,相比于有膜溶出模型,无膜溶出模型解除了半透膜对药物的阻滞作用,能更准确地模拟药物凝胶在子宫内真实的溶蚀和释放情况。因此,本试验采用无膜溶出模型考察凝胶的体外溶蚀量和释药量。
对药物进行用药部位浓度的监测,可以大致了解药物在用药部位的浓度随时间变化的情况,为后期进行临床药动学和药效学研究提供科学的参考依据,因此本研究对制备的药物凝胶在母猪子宫内的药物浓度进行了监测。考虑到子宫内黏液量有限,为了方便取样,最终优化了试验方案,在子宫内灌注20 mL 灭菌水后取样。
病原菌感染是猪子宫内膜炎的主要病因,但引发该病的病原微生物较为复杂,有研究对子宫内膜炎的致病病菌进行了分离鉴定,发现大肠埃希菌、链球菌、葡萄球菌和沙门氏菌为主要的致病菌[24-25]。多西环素作为广谱抗菌药,对以上4种细菌均有一定的抑制作用,王春阳[26]研究发现多西环素对大肠埃希菌、链球菌、葡萄球菌、沙门氏菌的最小抑菌浓度(Minimal inhibitory concentration,MIC)分别为16、2、4、32μg/mL。本次试验制备的多西环素凝胶在第2次给药96 h 后药物在子宫内的质量浓度为68.54μg/mL,大于多西环素对以上4种致病菌的MIC值,表明该制剂在第2次给药96 h 后对猪子宫内膜炎主要致病菌仍具有良好的抑制作用,缓释效果明显。此外,传统的液体子宫灌注剂虽具有给药方便的优点,但液体制剂进入子宫后易流失,导致药物在子宫内的浓度会有较大的波动,不能有效地停留在患病部位发挥治疗作用,而且作用时间短,需要多次给药才能达到治疗效果,大大增加对子宫的刺激。本研究将药物制备成凝胶灌注剂,既保留了传统液体制剂给药方便的优点,同时药物到达子宫后可由液态转变为凝胶状态,长时间黏附在子宫内发挥治疗作用。药物浓度监测结果显示在第2次给药96 h 后子宫内仍保持较高的药物浓度,有效减少给药次数,在治疗母猪子宫内膜炎的同时还能减弱对子宫的刺激。
4 结论
本研究成功制备了一种可用于治疗母猪子宫内膜炎的多西环素温敏型原位凝胶,制备方法简单,性状稳定,符合《兽药研究技术指导原则汇编》[27]中的兽用化学药物稳定性研究技术指导原则的要求。与传统给药剂型相比,制剂到达子宫后能黏附在子宫内,减少药物损失,同时还具有缓释效果。多西环素温敏型原位凝胶制剂的成功研制为新兽药的进一步研究提供了科学依据,同时也为临床使用多西环素治疗母猪子宫内膜炎提供了一种新途径。

