鸡源复合益生菌对肉仔鸡免疫球蛋白及Toll 样受体通路的影响
贺濛初,李思婷,王 志,舒迎霜,桂雪儿,朱 杰,李锦春,吴金节
(1安徽农业大学动物科技学院,安徽 合肥230036;2宣城市木子禽业专业合作社,安徽 宣城 242000)
肠道疾病为雏鸡的常见多发病[1],目前预防雏鸡肠道感染的主要措施是在饲料饮水中添加抗生素。随着我国对畜禽饲料饮水中添加促生长类抗生素的限制,“减抗”、“替抗”产品的研发迫在眉睫。益生菌作为最常用的微生态制剂,具有无毒、无耐药性、无残留、提高机体免疫力、预防鸡消化道疾病等特点[2],单一的益生菌如乳酸杆菌Lactobacillus、芽孢杆菌Bacillus subtilis对鸡腹泻有较好的预防作用,而复合益生菌能更好地防治肠道感染[3]。Toll样受体(Toll-like receptor,TLR)是一类I型跨膜糖蛋白模式识别受体,TLR 在家禽各个器官中都参与抗病原菌感染作用,其中TLR2和TLR4分别起到识别革兰阳性菌的肽聚糖和革兰阴性菌的脂多糖的作用[4],并通过影响下游的Myd88依赖通路[5],改变TRAF-6和AP-1蛋白的表达,影响血清中免疫球蛋白的含量[6]。而血清中的IgG、IgM作为非特异性免疫的重要一环,对于识别和清除体内外来抗原具有重要作用[7],血清中IgG、IgM水平的适度上升代表着机体对病原抵抗力的上升[8]。
本试验在1日龄雏鸡饲料中添加乳酸菌与芽孢杆菌,观察添加益生菌对雏鸡血清中免疫球蛋白和肠道组织中TLR2、TLR4、Myd88、TRAF-6、AP-1等Toll样受体通路蛋白表达的影响,探究饲料中添加益生菌对鸡肠道Toll 样受体通路及其下游免疫因子的调控作用,研究益生菌的作用机制。
1 材料与方法
1.1 试剂与仪器
试剂:MRS肉汤及琼脂培养基、LB肉汤及琼脂培养基购自杭州百思生物科技有限公司,生理盐水、磷酸、氢氧化钠、多聚甲醛、无水乙醇、异丙醇购自无锡展望化工有限公司,DEPC水购自MDL 公司,细菌基因组DNA 提取试剂盒购自南京擎科生物公司,ELISA 试剂盒购自上海源叶生物有限公司,UltraPure Agarose、SuperScript ⅢRT反转录kit 和Sybrqpcr mix 购自ABI-invitrogen公司。
仪器:MIC-4 qPCR 仪购自BMS公司,微量移液器购自Eppendorf 公司,TGL-18R 台式高速离心机购自珠海黑马医学仪器有限公司,超净工作台购自苏州智净净化设备有限公司,电泳仪、凝胶成像仪购自Biorad 公司。
1.2 试验动物及分组
分离益生菌和试验用鸡均由安徽宣城市木子禽业专业合作社提供。试验用鸡为1日龄白羽肉杂鸡。90只雏鸡随机分为3组,分别为对照组、益生菌低剂量组和益生菌高剂量组,每组3个重复,每个重复10只鸡。其中,对照组饲喂基础日粮(表1),低剂量组在每千克基础日粮中添加复合益生菌109cfu,高剂量组在每千克基础日粮中添加复合益生菌2×109cfu。
1.3 益生菌分离鉴定
分别选取7、14、28日龄健康鸡,剖检后无菌采集十二指肠和空肠内容物。
乳酸菌分离:将1 g 新鲜肠道内容物用生理盐水进行10−4、10−5、10−6梯度稀释,并分别滴加到含0.75%(w)CaCO3的MRS固体选择培养基上,涂布均匀。把培养基小心装入厌氧罐,放入37℃的恒温箱中连续培养24 h。观察待检菌落的形成、发育和溶钙环的大小。挑取有明显溶钙环的单个菌,在MRS选择培养基上进行厌氧培养。在37℃恒温箱中培养24 h,观察细菌生长情况。再次接种培养,直到形成形态均一、分布均匀的单一菌落为止[9]。

表 1基础日粮组成及营养水平(风干基础)Table 1 Composition and nutrient levelsof basal diets(air-dry basis)
芽孢杆菌分离[10]:将1 g 新鲜肠道内容物用生理盐水进行10−4、10−5、10−6梯度稀释,并分别取100 μL涂布于普通营养琼脂培养基,37 ℃恒温条件下培养24 h。镜检培养基上的单个菌落。挑取芽孢杆菌单菌落在普通营养琼脂平板上画线培养,每个单菌落平板画线重复2~3次,得到纯的芽孢杆菌。将芽孢杆菌接种于营养琼脂斜面,保存备用。分离的菌株纯化扩增后,按照细菌基因组DNA提取试剂盒说明书上的方法,提取细菌的基因组DNA,并送往南京擎科生物公司测序鉴定菌株。
1.4 免疫球蛋白ELISA 检测
分别选取7、14、21日龄鸡,翅静脉采血,分离血清,−20℃保存。按照ELISA 试剂盒详细步骤要求,检测血清IgG、IgM含量。
1.5 免疫组织化学(IHC)法检测肠道通路蛋白
每组随机选取10只21日龄鸡放血致死,采取十二指肠,保存于体积分数为20%的多聚甲醛溶液中,制成蜡块并切片。采用IHC方法,应用标准的三步法进行检测。设置阴性对照,一抗分别为TLR2、TLR4、Myd88、TRAF-6、AP-1的特异性单克隆抗体,二抗为生物素标记山羊抗鼠IgG 抗体。染色后在200倍光学显微镜下进行观察并拍照,同一视野重复3次,并将所拍图像在Image-Pro Plus 6.0图像分析系统上进行光密度值分析。
1.6 RT-q PCR 法检测十二指肠Toll 样受体通路蛋白的mRNA 相对表达量
Trizol 法提取鸡十二指肠组织中的RNA,使用分光光度计检测RNA 纯度,之后反转录为cDNA进行qPCR 检测,qPCR 反应体系为20μL:模板2μL,上游引物0.5μL,下游引物0.5μL,qPCR MIX 10μL,dd H2O 7μL。qPCR 反应引物(表2)由南京擎科公司合成[11]。
1.7 Western blot 法检测Toll 样受体通路蛋白表达量
将各组鸡十二指肠在冰上研磨,加入混有蛋白酶抑制剂以及蛋白磷酸酶抑制剂的RIPA 裂解液,漩涡振荡器混合均匀,置于冰上20 min 使细胞充分裂解。13000 r/min 离心10 min,收集上清液。按照BCA 蛋白浓度测定试剂盒说明书进行操作,并根据标准曲线算出蛋白浓度。将提取的蛋白质样品煮沸5 min,在SDS-PAGE 凝胶中电泳,然后转移至PVDF膜。用牛血清白蛋白(Bull serum albumin,BSA)在室温下封闭膜4 h 后,放入一抗,在4℃条件下孵育过夜。将膜洗涤3次,并用二抗在室温下水平振荡孵育45 min,洗膜后放入凝胶成像系统(BIO-RAD)中成像。
1.8 数据处理
试验数据均以“平均值±标准差”表示,利用统计软件SPSS 19.0进行单因素方差分析,并用Duncan’s法对数据进行多重比较,运用数据软件GraphPad Prism7.0进行柱状图的绘制。Westernblot 结果采用AlphaEase FC软件进行灰度值分析。

表 2 qPCR 引物参数Table 2 qPCR primer parameters
2 结果与分析
2.1 益生菌菌株与性质
经测序鉴定,所分离出的菌株是动物乳酸杆菌BNCC134981和蜡状芽孢杆菌Bacillus cereusVP11。将2种细菌分别在发酵罐中培养至108cfu / mL,然后冻干成干粉。干粉中的活细菌量为1012cfu / g,并且2种细菌以1∶1的质量比混合,直接添加到日粮中并搅拌均匀。
2.2 白羽肉杂鸡料肉比变化
由表3可知,第7天时,益生菌高剂量组鸡平均体质量和平均日采食量分别比对照组高12%和10%(P<0.05),分别比益生菌低剂量组高11%和10%(P<0.05)。各组间料肉比差异不显著。第14天时,益生菌低剂量组和高剂量组平均体质量分别比对照组高8%和11%(P<0.05),各组间平均日采食量差异不显著;益生菌低剂量组和高剂量组料肉比分别比对照组低6%和8%(P<0.05)。第21天时,益生菌低剂量组和高剂量组鸡平均体质量分别比对照组高8%和12%(P<0.01),益生菌高剂量组平均体质量比益生菌低剂量组高4%(P<0.05),各组间平均日采食量差异不显著;益生菌低剂量组与高剂量组料肉比分别比对照组低9%和12%(P<0.01)。
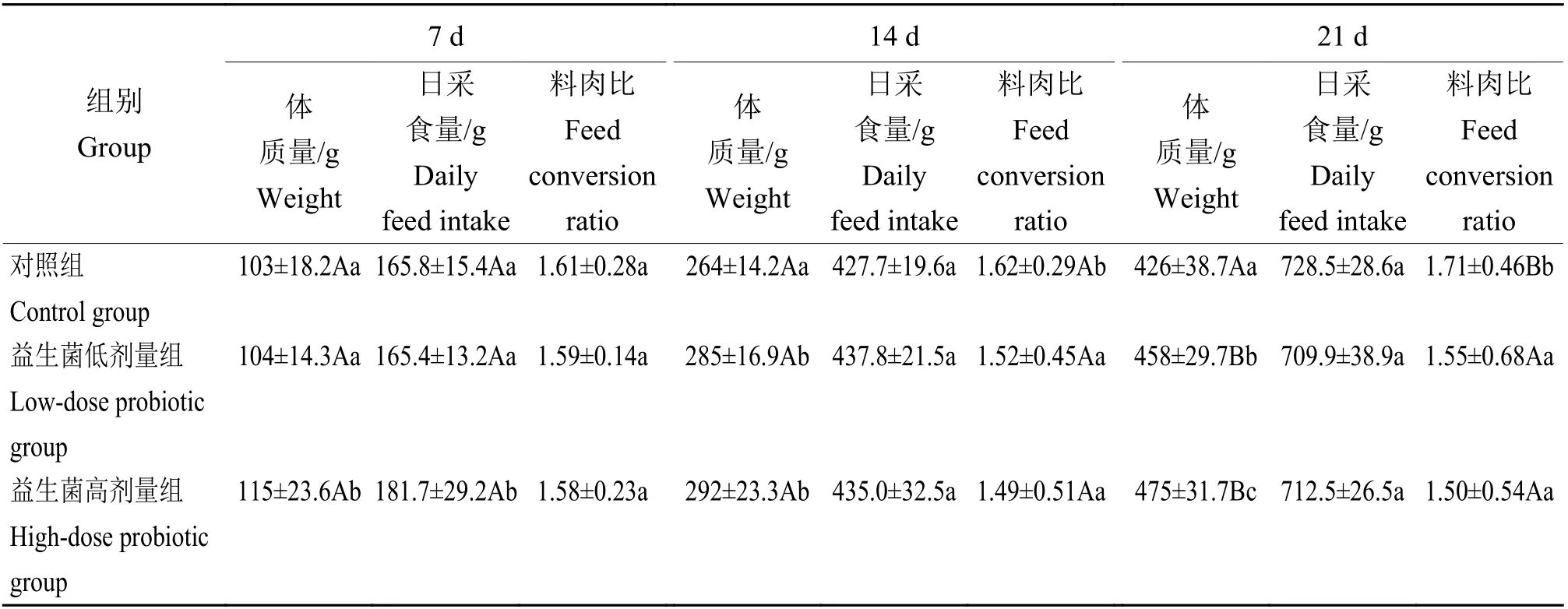
表 3益生菌对鸡生长性能的影响1)Table 3 Effect of probioticson growth performance of chicks
2.3 鸡血清免疫球蛋白IgG 与IgM 含量的变化
由表4可知,第7天时,各组间IgG、IgM 含量差异不显著。第14天时,益生菌低剂量组血清IgG、IgM含量分别比对照组高21%(P>0.05)和23%(P<0.05),益生菌高剂量组血清IgG、IgM含量分别比对照组高28%和44%(P<0.01),益生菌高剂量组血清Ig G、Ig M含量显著高于益生菌低剂量组(P<0.01)。第21天时,益生菌低剂量组血清IgG、IgM 含量分别比对照组高28%和44%(P<0.01),益生菌高剂量组血清IgG、IgM含量分别比对照组高40%和58%(P<0.01),益生菌低剂量组与高剂量组相比差异不显著。
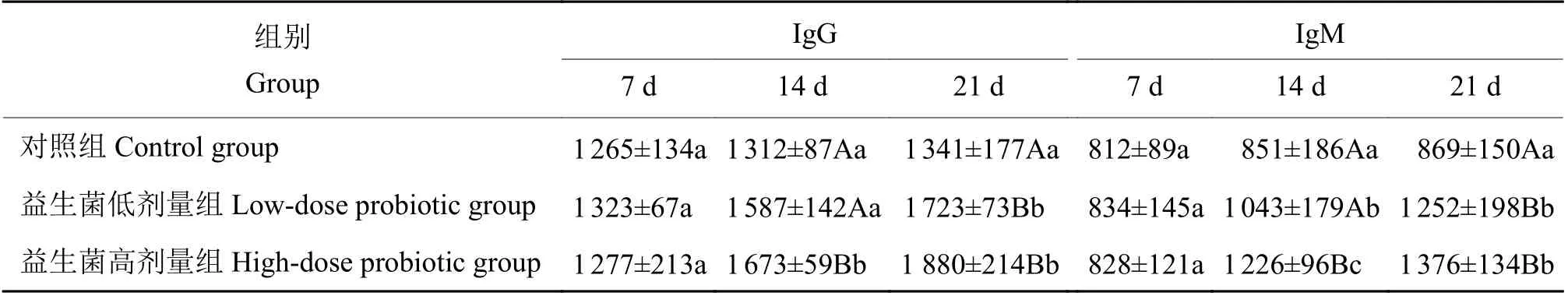
表4 益生菌对鸡血清IgG 和IgM 含量的影响1)Table 4 Effect of probiotics on IgG and IgM contents in chicken serumρ/(μg·mL−1)
2.4 肠道通路蛋白分布
IHC 检测结果见图1。由图1 可见,TLR2、TLR4、Myd88、AP-1、TRAF-6蛋白皆在十二指肠中表达,其主要表达区域为肠绒毛外侧与肠壁细胞中。

图1 鸡十二指肠Toll 样受体通路蛋白的免疫组化图Fig.1 Immunohistochemical photographsof Toll-likereceptor pathway proteinsin duodenum of chicks
由图2可知,益生菌低剂量组十二指肠TLR4、AP-1蛋白光密度均比对照组高28%(P<0.01)。益生菌高剂量组十二指肠TLR2、TLR4、AP-1和TRAF-6蛋白光密度分别比对照组高36%、41%、61%和39%(P<0.01)。益生菌高剂量组十二指肠5种蛋白的光密度均显著高于益生菌低剂量组(P<0.05)。
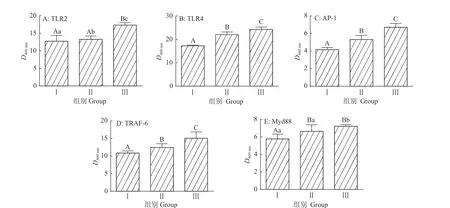
图2 益生菌对Toll 样受体通路蛋白光密度的影响Fig.2 Effect of probioticson optical density of Toll-like receptor pathway protein
2.5 肠组织通路蛋白mRNA 相对表达量
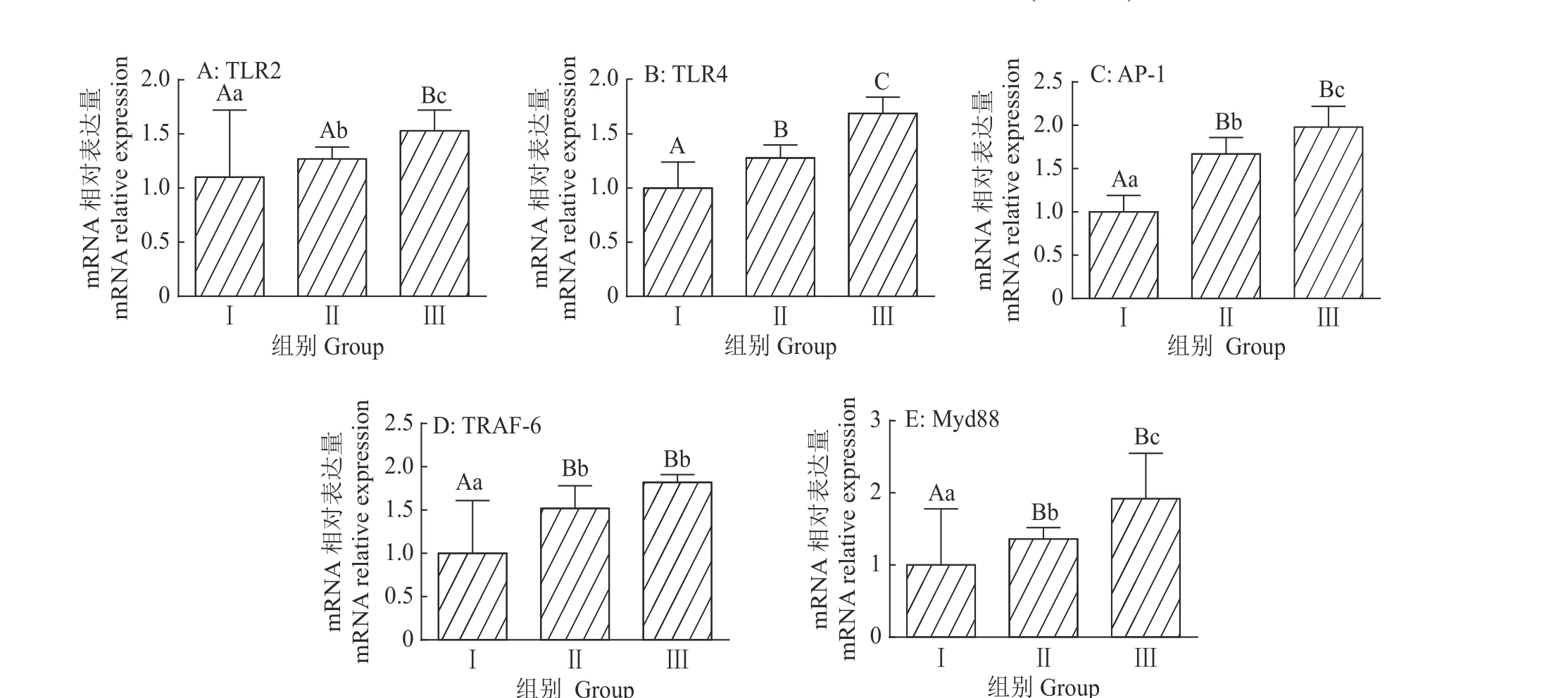
图3 益生菌对Toll 样受体通路蛋白mRNA 相对表达量的影响Fig.3 Effect of probiotics on themRNA relativeexpression of Toll-likereceptor pathway protein
如图3所示,与对照组相比,益生菌低剂量组十二指肠TLR4、AP-1的mRNA 相对表达量升高28%和67%(P<0.01),益生菌高剂量组十二指肠TLR4、AP-1的mRNA 相对表达量升高69%和98%(P<0.01)。益生菌高剂量组十二指肠AP-1、TLR2、TLR4的mRNA 相对表达量显著(P<0.05)或极显著(P<0.01)高于益生菌低剂量组。
2.6 肠组织通路蛋白表达量
由图4、5可知,与对照组相比,益生菌低剂量组十二指肠TLR2蛋白表达量升高21%(P<0.05),TLR4、AP-1、TRAF-6和Myd88蛋白表达量分别升高33%、106%、56%和45%(P<0.01),益生菌高剂量组十二指肠TLR2、TLR4、AP-1、TRAF-6和Myd88蛋白表达量分别升高60%、106%、163%、121%和72%(P<0.01)。益生菌高剂量组十二指肠5种蛋白的表达量均显著(P<0.05)或极显著(P<0.01)高于益生菌低剂量组。

图4 Toll 样受体通路蛋白的电泳图Fig.4 Electr op hor etic p atter n of Toll-lik e r ecep tor pathway protein
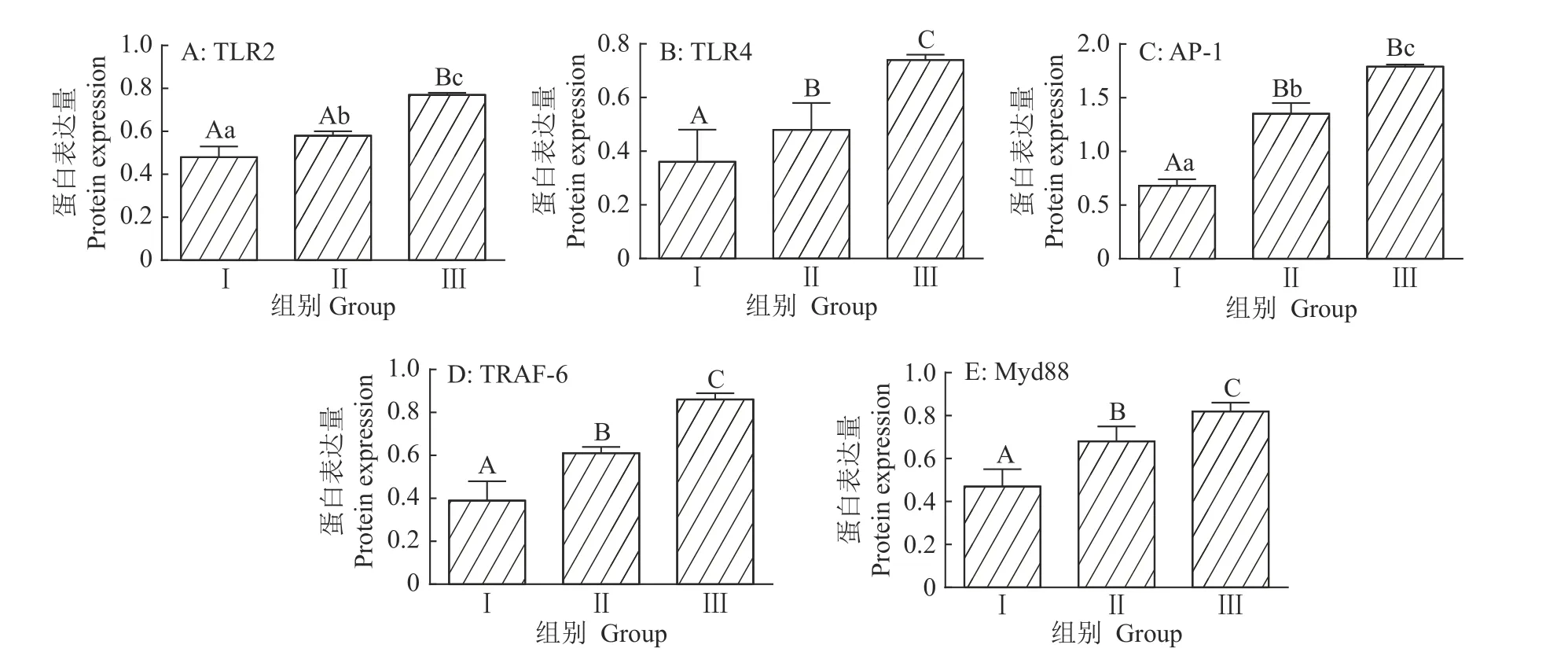
图5 益生菌对Toll 样受体通路蛋白表达量的影响Fig.5 Effect of probiotics on the expression level of Toll-like receptor pathway protein
3 讨论与结论
本试验结果表明,在饲料中添加益生菌可降低肉鸡饲养的料肉比,且益生菌高剂量组与益生菌低剂量组差异不显著。有研究显示,在饲料中添加芽孢杆菌、乳酸菌、丁酸梭菌等益生菌可提高肉鸡生产性能,包括增加日采食量、减少料肉比、提高体质量等[12-13]。其主要作用为改善肠道健康,以增强对饲料的吸收[2,12]。
王佳丽等[3]通过体内试验证实,在饲料中添加益生菌可显著提高肉鸡血清中免疫球蛋白含量。唐志刚等[14]研究发现添加益生菌可提高肉鸡胸腺指数、法氏囊指数,且血清IgG、IgM、IgA 含量随之升高,以此增强肉鸡机体免疫能力。本试验在饲喂第14天时,益生菌高剂量组血清免疫球蛋白含量显著高于益生菌低剂量组,表明高剂量的益生菌在短期提高机体免疫力方面有更好的效果;而饲喂第21天时,益生菌高剂量组血清免疫球蛋白含量与益生菌低剂量组差异不显著,表明大剂量的益生菌可以使雏鸡体内免疫球蛋白更快地达到正常雏鸡的峰值,且不会突破峰值引起炎症反应。
Zhou 等[15]研究表明,饲喂黄芪多糖可调节TLR4受体通路,并增加Myd88依赖的信号通路表达。Myd88依赖通路通过调节下游蛋白TRAF-6、AP-1的表达来参与机体多项免疫反应[16]。本试验中,在饲料中添加益生菌后,益生菌低剂量组与高剂量组鸡肠道TLR2、TLR4、Myd88、TRAF-6和AP-1蛋白的表达量和mRNA 相对表达量显著或极显著升高,且随着益生菌剂量的增加,通路蛋白及其基因的表达量也随之上升,表明添加益生菌对雏鸡肠道TLR2、TLR4通路及相关蛋白有上调作用。本试验中,血清中IgG、IgM 含量随着添加益生菌剂量增加而升高,且其变化趋势与TLR2表达相一致,表明TLR2受体蛋白的表达与IgG 等免疫球蛋白分泌正相关。在炎症模型中,中药、益生菌等抗生素替代品主要作用为抑制炎症通路,从而减少炎症因子分泌,减轻炎症反应。刘瑞等[17]研究证明,在雏鸡模型中,因雏鸡免疫器官未发育完全,体内免疫因子含量低于正常水平,因此使用黄芪多糖等可促使免疫器官发育,提高Toll样受体通路蛋白含量,这与本研究结果一致。
大量研究报道,饲料中添加益生菌可增加鸡的免疫力和生长性能[18-19],但是对于益生菌对Toll 样受体信号表达的研究,主要还停留在小鼠模型和细胞层面。本研究通过体内试验,证实益生菌可改善肠道内TLR2和TLR4介导的Toll 样受体通路蛋白表达,增加血清中IgG、IgM 的含量。但Toll样受体通路蛋白表达与血清中免疫球蛋白含量是否有直接关联作用,需进一步研究。
综上,饲料中添加益生菌能有效降低白羽肉杂鸡仔鸡料肉比,提高血清中IgG、IgM 含量,通过正向调控仔鸡体内TLR2与TLR4通路表达及相关蛋白含量,增强机体免疫力。

