马波沙星的研究进展
彭文绣
(中国兽医药品监察所,北京 100081)
马波沙星(Marbofloxacin,MBF),又称麻保沙星,是由瑞士罗氏公司研制开发的一种新型动物专用氟喹诺酮类抗菌药,具有抗菌谱广、杀菌活性强、与其他抗菌药物交叉耐药少等特点[1]。1995年,该药首次在英国上市,主要用于猫、犬细菌性疾病的防治[2]。我国于2014年批准该药为国家二类新兽药,用于敏感菌所致的犬呼吸道感染。已有文献主要围绕MBF在不同动物体内的药动学特征进行报道[3-9],这些研究表明,MBF内服及肠外给药后吸收迅速且完全,体内分布广泛,生物利用度高,提示了该药在畜禽泌尿道、皮肤及深部组织感染等方面的防治具有巨大潜力。为满足今后工作需求,促进MBF标准物质的研制,兽医临床用药的规范以及检验检测方法的建立与选择,本文从MBF的理化性质、合成途径、作用机制与体外抗菌活性、安全性以及含量或残留检测方法等方面进行综述,以期为我国深入开展其相关研究与应用提供参考。
1 理化性质
MBF化学名为9-氟-2,3-二氢-3-甲基-10-(4-甲基-1-哌嗪基)-7-氧代-7H-吡啶-[3,2,1-ij](4,1,2)苯并噁二嗪-6-羧酸,结构式见图1,分子式C17H19FN4O4,分子量362.35,为黄色或淡黄色结晶粉末,熔点为268~269 ℃,微溶于水,略溶或微溶于二氯甲烷,极微溶于96%的乙醇[10]。

图1 马波沙星的化学结构式
2 合成途径
传统工艺中以2,3,4,5-四氟苯甲酸为原料,经酰氯化、缩合、水解、环合等9步反应得到目标化合物,总收率为32%[11]。严智等[12]进一步改进工艺,将2,3,4,5-四氟苯甲酸酰氯化后产物与3-(N-甲基-甲酰肼基)-丙烯酸乙酯偶联、环合,再与4-甲基哌嗪缩合、水解、环合,氨水中和,经7步反应制得最终产物,总收率为47.7%。单国洋等[13]以2,3,4,5-四氟苯甲酰氯为起始原料,与3-(4-甲基哌嗪-1-基)-丙烯酸乙酯反应,再与N-甲基甲酰基肼胺化,胺化物再经环合、缩哌、碱解,最后环合得到MBF。该方法安全高效,关键步骤可采用一锅法技术,废水废气排放减少,总收率可提高到51%,所得产物质量符合要求,纯度≥99.9%,具有较高的工业化价值。
3 作用机制与体外抗菌活性
MBF是通过抑制细菌DNA回旋酶(又称II型拓扑异构酶)A亚基活性,阻止细菌DNA的合成和复制而导致细菌死亡。除II型拓扑异构酶外,MBF还对细菌细胞内的IV型拓扑异构酶具有抑制作用[10,14]。这一作用机制不同于其他抗菌药物,故MBF产生交叉耐药的可能性很小。
MBF抗菌谱广,对革兰氏阳性菌具有较强的抗菌活性,对大多数革兰氏阴性杆菌和球菌、某些厌氧菌也比较敏感。Josef Bolte等[15]通过研究牛乳腺炎病原体对常用抗生素的敏感性发现,MBF抑制50%与90%克雷伯氏菌属生长的最低药物浓度(50% minimun inhibitory concentration, MIC50; 90% minimun inhibitory concentration, MIC90)分别为0.03 μg/mL与0.125 μg/mL,对大肠埃希氏菌的MIC50、MIC90分别为0.03 μg/mL与1.0 μg/mL,明显低于头孢喹肟、阿莫西林克拉维酸钾、磺胺甲噁唑/甲氧苄氨嘧啶的MIC值。A.Bousquet-Melou等[16]对马临床分离的病原菌体外抑菌活性进行研究后发现,MBF对肠杆菌科(包括沙门氏菌、大肠埃希氏菌、肺炎杆菌)的MIC范围为0.008~0.03 μg/mL,MIC90为0.027 μg/mL;对链球菌科(包括兽疫链球菌、马链球菌)的MIC范围为0.5~2.0 μg/mL,MIC90为1.667 μg/mL;对金黄色葡萄球菌的MIC范围和MIC90分别为0.12~0.25 μg/mL、0.21 μg/mL;对铜绿假单孢菌的MIC范围为0.12~2.0 μg/mL。Aude A.Ferran等[17]报道了MBF对犬源性金黄色葡萄球菌的MIC为0.125 mg/L,假中间葡萄球菌的MIC为0.25 mg/L。M.Grobbel等[18]首次研究了MBF对牛和猪临床分离的病原体体外抗菌活性(表1),测得其对牛曼氏杆菌、大肠埃希氏菌、支气管炎博德特菌的活性明显强于恩诺沙星。Peter Silley等[19]报道了MBF对猫、犬厌氧菌的体外抗菌活性(表2),其活性相当或略强于恩诺沙星、二氟沙星和依巴沙星。岳永波等[20]报道MBF对猪临床分离病原菌大肠杆菌、金黄色葡萄球菌和链球菌均有较低的最小抑菌浓度,其MIC50和MIC90分别为8和64 μg/mL、4和64 μg/mL、1和16 μg/mL,对临床分离大肠杆菌、金黄色葡萄球菌和链球菌的抑菌活性明显高于诺氟沙星、环丙沙星、庆大霉素和强力霉素,对临床分离大肠杆菌的抑菌活性高于恩诺沙星。

表1 马波沙星对牛和猪临床分离的病原菌的体外抗菌活性
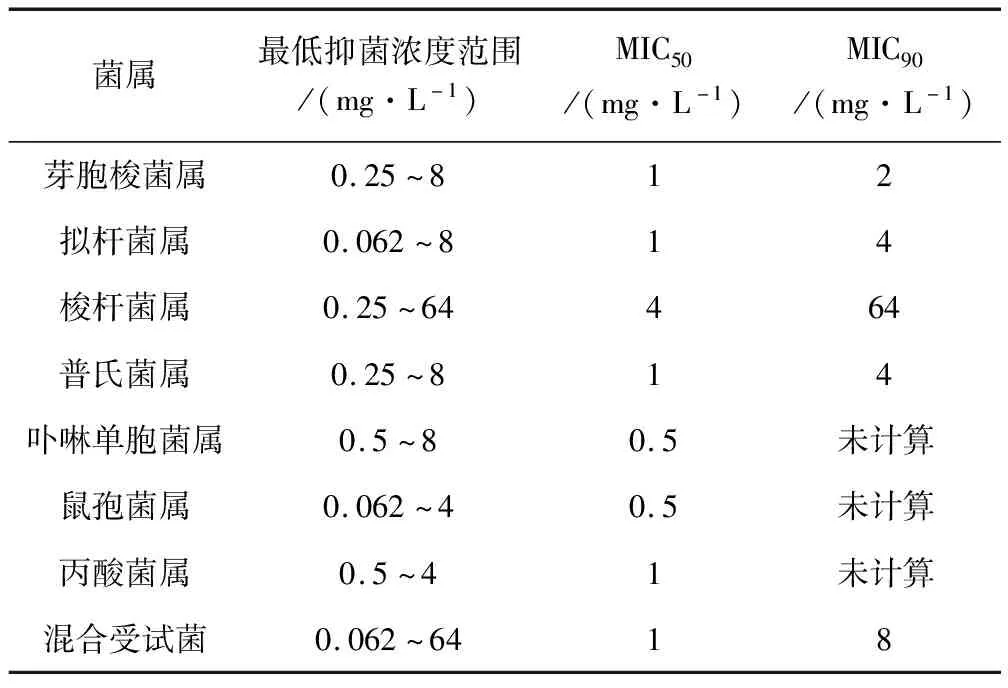
表2 马波沙星对猫、犬厌氧菌的体外抗菌活性
4 安全性
沈建忠等[21]选用Wistar大鼠和昆明系小鼠对MBF的遗传毒性进行研究。试验结果表明,MBF对Wistar大鼠口服半数致死量(median lethal dose,LD50)大于5000 mg/kg,对昆明系小鼠口服 LD50为1000 mg/kg。该药在抑菌剂量之下对鼠伤寒沙门氏菌无致突变作用;以低、中、高三组剂量(125、250和500 mg/kg)灌胃给药,小鼠骨髓有微核多染红细胞率未显著升高且不会导致因雄性小鼠生殖细胞染色体畸变而造成的早期胚胎死亡。20 mg/kg和100 mg/kg剂量的MBF对母鼠的生殖机能和胎鼠的生长发育无明显影响,对胎鼠不产生致畸作用,500 mg/kg剂量MBF对胎鼠体长和骨骼发育有一定影响,但不存在剂量反应关系。这些结果表明,MBF无明显的致突变性和致畸性。
张玲玲等[22]对国产MBF的体外毒性进行了研究,分别对小鼠进行急性经口毒性试验、急性毒性试验、精子畸形试验、骨髓微核试验和亚慢性毒性试验。结果显示,国产MBF经口LD50为887.8 mg/kg,属低毒物质,精子畸形试验和骨髓微核试验结果均为阴性,说明MBF无致突变作用。当按照178、89和18 mg/kg的剂量连续灌胃30 d,小鼠未见死亡,脏器系数、血常规及生化指标较阴性对照组虽有显著变化,但均在正常值范围内,国产MBF按推荐剂量使用安全,无致畸和致突变作用。
魏丽娟等[23]评价了MBF注射液在靶动物猪中的安全性。从试验结果可以看出,使用1~5倍推荐剂量的10% MBF注射液的受试母猪均未出现明显的临床症状,血常规及生化指标未发生显著改变,各推荐剂量组对母猪的组织/器官均无明显影响,在2.5~50.0 mg/kg的剂量范围内,MBF安全有效。
5 含量或残留检测方法
为了客观、科学地评价MBF在动物体内的消除规律,制定合理的临床给药方案以及保证动物源性食品的质量安全,已有研究者建立方法对MBF的药物含量或残留进行检测。
5.1 酶联免疫检测法 酶联免疫法特异性和灵敏度高,不需要昂贵的仪器设备,适用于大量样品的快速筛选。目前,还未见MBF残留快速检测试剂盒上市。已有的研究中[24],以MAR-HRP为异源酶标抗原建立的直接竞争酶联免疫法,可以同时检测牛奶中氧氟沙星、MBF、氟罗沙星三种喹诺酮类药物的含量。若以诺氟沙星为抗体,通过条件优化,抗体包被量为1 μg/mL,酶标抗原稀释比例为1∶50000,0.5%乳粉作为封闭液,封闭和竞争时间各为30、60 min,建立的诺氟沙星直接竞争酶联免疫检测方法,可同时检测牛奶中包含MBF在内的十六种喹诺酮类药物的残留。赵贵山等[25]利用制备的MBF单克隆抗体与稀释的MBF溶液混合均匀,通过间接竞争法检测药物残留,检测的MBF浓度范围为100~5000 pg/mL。该方法制备出针对MBF的特异性强和亲和力高的单克隆抗体,为MBF酶联免疫检测法的推广提供了物质基础。
5.2 荧光分光光度法 MBF核心部分为喹啉,具有较大的共轭结构和刚性,可产生较显著的荧光,适合采用荧光分光光度法进行测定。该方法具有专属性强、样品用量少、操作简便等特点,常用于微量甚至痕量物质的定量分析。谢军[26]利用阳离子表面活性剂十六烷基三甲基溴化铵增强MBF体系的荧光强度,在pH 5.0的盐酸-柠檬酸钠缓冲液中,以303 nm为最大激发波长、506 nm为最大发射波长测定血液中MBF含量。检测线性范围为5.5×10-8~3.0×10-6mol/L,检测限为4.6×10-8mol/L,相对标准偏差1.5%。
5.3 胶体金免疫层析技术 胶体金免疫层析技术是以胶体金作为示踪标志物应用于抗原抗体的一种新型的免疫标记技术。它具有使用方便快速,便于基层和现场使用;成本低,不需要特殊的仪器设备;不需要使用有潜在致癌性的酶显色底物或放射性同位素等优点,适用于药物残留的快速筛查。
孙晓峥等[27]将环丙沙星与牛血清白蛋白偶联制备人工抗原,免疫小鼠后筛选得到特异性单克隆抗体。以纯化后的单克隆抗体标记胶体金颗粒作为金标垫,以环丙沙星-牛血清白蛋白偶联物和兔抗鼠 IgG作为检测限和质控限,组装检测氟喹诺酮类抗生素残留的胶体金免疫层析试纸条,用于临床氟喹诺酮类抗生素残留的快速检测和大量样品的筛选。该法特异性强、灵敏度高、广谱性好、临床适用性强,肉眼于10 min内即可判定结果。
5.4 超高液相色谱法 超高效液相色谱法的原理与高效液相色谱法基本相同,但其分析速度、灵敏度及分离度高于高效液相色谱,大大缩短了分析时间,减少了溶剂用量,降低了分析成本。赵莉等[28]建立了超高效液相色谱法检测猪肉中MBF残留。该方法以氧氟沙星为内标,样品经三氯甲烷提取后吹干、复溶,正己烷除脂,紫外检测器检测,方法的线性范围为10~1000 μg/kg(r=0.9994),检出限为5 μg/kg,定量限为10 μg/kg,平均回收率为85.80%~103.20%,其分析速度、灵敏度及分离度分别是高效液相色谱法的9、3、1.7倍。
5.5 高效液相色谱法、高效液相色谱串联质谱法 高效液相色谱法是检测此类药物残留分析方法中最重要和最基本的方法,液质联用则有助于提供混合物的相对分子质量与结构信息。贾国宾等[29]建立的高效液相色谱法可测定猪肝脏、肌肉、肾脏、脂肪等组织中MBF的残留量。惠芸华等[30]建立的方法可以同时测定水产品中包含MBF在内的9种氟喹诺酮类药物残留量。宫小明等[31]优化样品前处理方法,采用梯度洗脱和程序波长建立了一种能够同时检测8种氟喹诺酮类多残留的高效液相色谱法。这些方法采用的仪器均比较普及,通用性强,可满足基层检测需求。钱卓真等[32]建立的水产品中19种喹诺酮类药物的液相色谱-串联质谱法,可涵盖所有用于鱼类病害防治的喹诺酮类药物。该方法用酸化乙腈提取水产品中喹诺酮类药物,正己烷脱脂,在电喷雾电离源,正离子扫描模式下运用外标法定量检测。19种药物的标准曲线线性回归系数均在0.99以上,线性范围为2~200 ng/mL,MBF的检出限为0.5 μg/kg、定量限为1.0 μg/kg,可满足实验室批量样品分析的需求。
6 结 论
从长期积累的经验以及在畜禽、宠物领域的研究结果可以看出,MBF具有给药方便,广谱、低毒、高效等特点,已成为继恩诺沙星之后,畜禽及宠物疾病领域又一动物专用氟喹诺酮类抗菌新药[33],在防治动物疾病方面发挥着极为重要的作用。
尽管研究已证实,MBF安全剂量范围宽,极少引起诸如恶心、呕吐、腹泻、痉挛等不良作用[34],且无明显生殖和遗传毒性,长期使用,对动物血常规、生化指标、组织/器官形态无显著影响,但张福涛发现[35],MBF在24 h内能够以剂量和时间依赖方式引起体外幼龄犬关节软骨细胞存活率下降,凋亡升高。目前,未见针对这一潜在不良反应所进行的系统性研究,建议后续可开展相关动物试验,补充完善MBF的安全性资料。
文献报道的MBF对不同细菌的体外抗菌活性和MIC值对该药抗菌谱的界定、给药剂量的选择具有一定参考价值,有助于临床兽医经验性治疗的开展。需要注意的是,随着药物长期使用,细菌耐药性也不断发生变化,为确保治疗安全有效,有条件的地区应定期更新抗菌药对不同细菌体外抗菌活性的研究资料,或在疾病治疗前进行药敏性试验,优先选择有效的窄谱药物,按照疗程规范使用,避免频繁换药,以延缓抗菌药物耐药性的产生。
有关MBF在动物组织残留的问题已引起人们的关注,寻找更为方便快捷的检测方法尤为重要。文献中,不同研究者建立的含量或残留检测方法具有药物涵盖范围广、操作简便、灵敏度高的优点,可满足不同领域、不同层面、不同场合的工作需求,为后续研究奠定基础。现有公告及《食品安全国家标准 食品中兽药最大残留限量》(GB 31650-2019)还未对MBF限量值作出明确规定,有关部门应加快制定完善兽药残留检测的程序和依据,加强MBF的使用监管,促进药物科学合理应用,进一步保障畜禽养殖业的稳态发展。

