鹅星状病毒、鹅细小病毒双重PCR检测方法的建立及初步应用
苗 艳,朱庆贺,陈 亮,兰世捷,冯万宇,李 丹,黄宝银,沈思思,史同瑞
(黑龙江省农业科学院畜牧兽医分院,黑龙江齐齐哈尔 161000)
雏鹅痛风是一种由新型鹅星状病毒(Goose astrovirus, GoAstV)引起的以内脏尿酸盐沉积为主要特征的疾病[1],4~21日龄雏鹅易感,发病率80%左右,致死率30%~50%[2-4]。该病首次于2017年爆发,近年来在黑龙江、辽宁、江西、湖南、福建、河北、江苏、安徽、山东、河南、广东、四川等省都有爆发该病的报道,目前尚无有效疫苗可用,给养鹅业造成巨大经济损失[5-7]。鹅细小病毒病是一种由鹅细小病毒(Goose parvovirus, GPV)引起的急性、接触性、致死性疾病,以发生渗出性肠炎为主要特征,主要侵害4~20日龄雏鹅。该病传播速度快,发病率和致死率都较高,对养鹅业威胁巨大,严重限制了养鹅业的发展,目前中国、英国、瑞典等多个国家和地区都对该病进行了报道[8-10]。
GoAstV和GPV是对水禽养殖威胁严重的两种病毒,目前已有二者混合感染的报道[11-12],因此急需一种能够快速、特异鉴别诊断这两种病毒的方法用于流行病学调查和疾病防控。目前用于检测GPV的方法有ELISA、TaqMan PCR和环介导等温PCR等[13-15];用于检测GoAstV的方法主要是TaqMan PCR[16]。PCR检测方法较ELISA、TaqMan PCR和环介导等温PCR等检测方法具有简单、易操作、检测时间短、成本低等特点,而且也具有较高的特异性和敏感性;而双重PCR可在同一体系中同时对两种病原进行检测。因此,本研究根据GoAstV和GPV基因序列保守区域设计合成了两对特异性扩增引物,对PCR反应体系及反应条件进行优化,研究建立了一种可同时检测GoAstV和GPV的双重PCR检测方法。
1 材料与方法
1.1 材料
1.1.1 病毒株 鹅星状病毒病、鹅细小病毒病阳性病料均由实验室分离并保存。
1.1.2 主要试剂 总RNA提取试剂盒购自元亨生物技术有限公司;Taq酶、M-MLV、RNase Inhibitor购自宝日医生物技术(北京)有限公司;质粒提取试剂盒和胶回收试剂盒均购自天根生化科技(北京)有限公司;PMD19-T购自大连宝生物工程有限公司。
1.1.3 主要仪器 多功能基因扩增仪,FlexCycler2型,德国耶拿分析仪器股份公司;电子分析天平,ME204/02型,梅特勒-托利多(上海)有限公司;电泳仪(DYY-6D型)、紫外仪(WD-9403D型),北京六一生物科技有限公司;双光速紫外可见分光光度计,UV-1900 PC型,上海佑科仪器仪表有限公司。
1.2 方法
1.2.1 引物的设计与合成 根据GenBank上已发表的GoAstV和GPV的基因序列,通过DNAStar软件比对筛选出各自序列的相对保守区域,利用Oligo7.0、primer5.0设计引物。引物由吉林省库美生物科技有限公司合成,引物序列及扩增长度见表1。
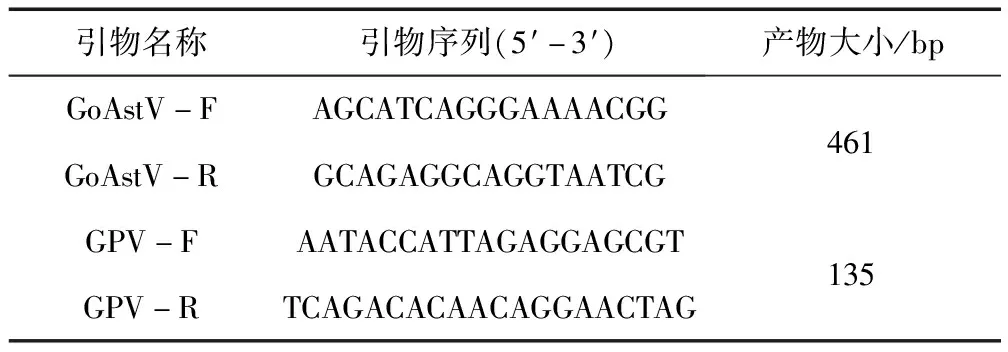
表1 PCR引物设计结果
1.2.2 样品的处理和模板的制备 取GoAstV和GPV的组织病料样品放入研钵中充分研磨,向研钵中加入适量0.9%的生理盐水稀释病料,取稀释好的病料以8000 r/min离心5 min,取上清150 μL于干净的EP管中备用。GoAstV和GPV总RNA和总DNA的提取分别按照RNA提取试剂盒和DNA提取试剂盒说明书上所述方法进行,再将所提取的GoAstV总RNA按照反转录酶说明书上所述方法反转录为cDNA,-20 ℃贮存备用。
1.2.3 阳性重组质粒的制备 取所制备的模板DNA进行PCR,PCR反应体系如下(25 μL):无菌水16.3 μL,10 × pfu buffer 2.5 μL;Taq DNA Polymerase 0.2 μL;dNTP(2.5 mmol/L)2 μL;上下游引物(10 μmol/L)各1.0 μL;模板DNA 2 μL。反应条件为:95 ℃预变性5 min;94 ℃变性30 s,47.9 ℃退火30 s,72 ℃延伸30 s,循环35次;72 ℃延伸10 min。PCR扩增产物通过1.5%琼脂糖凝胶电泳鉴定,胶回收试剂盒回收、纯化。将所回收的PCR产物与PMD19-T载体连接并转化至Dh5α感受态细胞中,PCR鉴定为阳性的重组质粒送至生工生物工程(上海)股份有限公司进行测序,将测序结果显示正确的阳性重组质粒保存于-20 ℃中备用。
1.2.4 PCR反应条件的优化(引物浓度和退火温度)以所制备的GoAstV和GPV两种病毒的阳性重组质粒为模板,按照1.2.3中的PCR反应体系和反应条件进行扩增,对其中的退火温度和引物浓度进行优化,即退火温度在47~52 ℃之间选取了7个梯度进行优化,两种病毒的引物浓度组合情况见表2,其他条件不变。
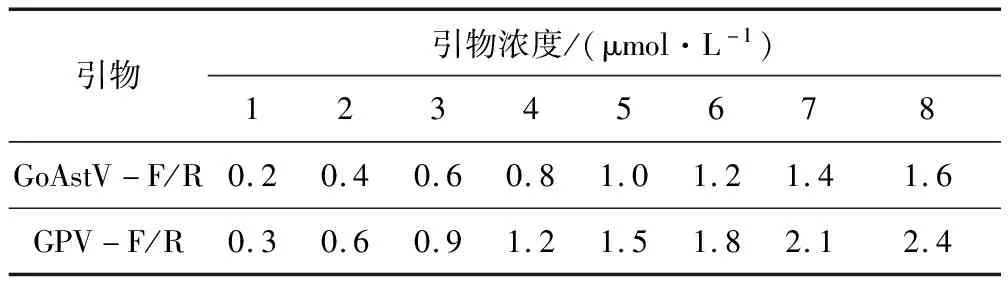
表2 引物浓度优化组合
1.2.5 特异性检测 以GoAstV和GPV阳性重组质粒为标准阳性,用上述所建立的双重PCR检测方法对GPMV、GAIV、GADV和GoCV 的DNA或cDNA模板进行扩增,以检测所建立双重PCR方法的特异性。
1.2.6 敏感性检测 分别用紫外分光光度计测定GoAstV和GPV阳性重组质粒的浓度,计算模板质粒的拷贝数,将阳性重组质粒进行10倍梯度稀释,共9个梯度,即1.25×108copies~1.25×100copies。
1.2.7 临床样品的检测 共采集50份临床鹅组织样品,按照1.2.2中的方法处理样品,并提取和制备模板,用上述实验中所建立的PCR检测方法对临床样品进行检测,其中人工混合的两种病毒的阳性样品作为阳性标准品对照。
2 结果与分析
2.1 PCR扩增和阳性重组质粒的鉴定 以所制备的GoAstV病毒的cDNA和GPV病毒的DNA为模板,按照1.2.3中的方法对GoAstV和GPV进行PCR扩增,结果分别特异性扩增出目的片段,大小分别为461 bp和135 bp,与预期大小一致。扩增产物经1.5%的琼脂糖凝胶电泳,结果见图1。两种病毒目的片段阳性的重组质粒测序分析结果表明,成功构建了以上两种病毒的pMD19-T阳性重组质粒。
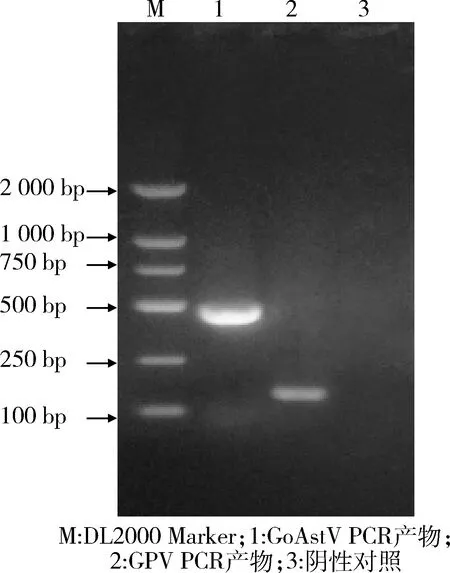
M: DL2000 Marker;1: GoAstV PCR产物;2: GPV PCR产物;3: 阴性对照
2.2 PCR反应条件的优化 当退火温度为47.9 ℃,GoAstV和GPV引物浓度分别为1.0 μmol/L和1.5 μmol/L时,各目的基因片段均能得到较好的扩增,优化产物经1.2%的琼脂糖凝胶电泳,结果见图2和图3。

M: DL2000 Marker;1: 47.0 ℃;2: 47.3 ℃;3:47.9 ℃;4: 48.9 ℃;5: 50.1 ℃;6: 51.1 ℃;7: 51.7 ℃;8: Negative control

M: DL2000 Marker;1-8:组合1-组合8;9: 阴性对照
2.3 PCR的特异性 所建立的双重PCR检测方法能够特异性扩增GoAstV和GPV两种病毒的单一阳性样品和混合阳性样品,而对GPMV、GAIV、GADV和GoCV阳性样品均无扩增(图4),表明所建立的双重PCR检测方法具有较好的特异性。

M: DL2000 Marker;1: GoAstV+GPV;2:GoAstV;3: GPV;4: GPMV;5: GAIV;6: GADV;7:GoCV;8: Negative control
2.4 PCR的敏感性 所建立的双重PCR检测方法对GoAstV和GPV的最低检测拷贝数分别为1.25×103copies和1.25×105copies,结果如图5所示,表明所建立的双重PCR检测方法敏感度较高。
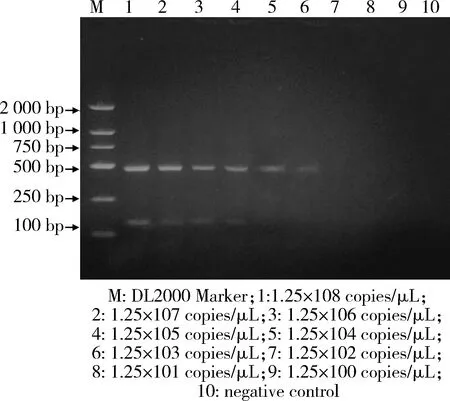
M: DL2000 Marker;1:1.25×108copies;2: 1.25×107copies;3: 1.25×106 copies;4: 1.25×105 copies;5: 1.25×104 copies;6: 1.25×103 copies;7: 1.25×102 copies;8: 1.25×101copies;9: 1.25×100 copies;10: Negative control
2.5 PCR对临床样品的检测 对所采集的50份临床鹅组织样品进行检测,共检测出GoAstV 35份、GPV 2份,GoAstV和GPV混合感染2份,结果如表3所示,表明所建立的双重PCR检测方法能够用于GoAstV 和GPV临床样品的检测。

表3 临床样品检测结果
3 讨论与小结
GoAstV是一种2017年新出现的病毒,自发现以来已被广泛报道;GPV是一种引起水禽(鸭、鹅)高发病率和死亡率的病毒。本研究根据GoAstV和GPV在相应文献中提到的最保守基因进行设计两对特异性引物,所扩增出的条带大小相差在200 bp以上,易于区分,成功建立了一种可以同时对GoAstV和GPV进行检测的双重PCR检测方法,且特异性强、敏感性高,对GoAstV和GPV阳性重组质粒的最低检测拷贝数分别为1.25×103copies和1.25×105copies。临床样品的检测结果显示,GoAstV的检出率达70%以上,说明GoAstV的感染率较高,危害严重。所检出的两份GPV都与GoAstV呈混合感染,说明GPV和GoAstV可能常易伴发感染。由于目前样品检测数目的限制,还需进一步进行临床样品的收集和检测。本研究中所建立的双重PCR检测方法能够用于监测GoAstV和GPV在中国的流行情况,并可作为诊断这两种疾病的工具。

