基于无标记金纳米簇的新型荧光生物传感器在赭曲霉毒素A快速检测中的应用
孔德莉,罗 思,彭瑞晨,刘嘉睿,文 茜
(中南林业科技大学食品科学与工程学院,湖南 长沙 410004)
真菌毒素是真菌产生的次级代谢产物,能够污染许多食物,包括肉类、啤酒、谷物类等食物[1-2]。赭曲霉毒素是曲霉菌属和青霉菌属产生的次级代谢产物,其中赭曲霉毒素A(ochratoxin A,OTA)是对人类的生活生产危害最大的真菌毒素之一[3-4]。目前,关于毒素的传统检测方法主要有高效液相色谱(high performance liquid chromatography,HPLC)法、薄层色谱(thinlayer chromatograghy,TLC)法和气相色谱(gas chromatography,GC)法等[5-7]。此类方法虽然都有较高的稳定性和灵敏度[8],但都需要昂贵的仪器,繁琐的处理步骤(包括萃取、清洗和浓缩等),因而限制了它们的普及和应用[9-10]。近年来,基于适配体(aptamer,Apt)与靶标特异性结合进而构建的复合生物传感器被广泛地应用于食品、生物小分子和肿瘤标记物的检测等相关领域[11-13]。而基于霉菌毒素Apt的生物传感器主要有荧光传感器、比色传感器、化学发光传感器、电化学传感器等几种[9,14-16]。其中荧光检测方法是目前最常见也是最普及的检测方法之一[17],由于其操作简单、微型化且不受外界环境干扰而为食品中风险因子的现场检测提供了有效途径[18]。
金纳米簇(gold nanocluster,AuNCs)具有独特的尺寸依赖性光物理性质,较强的抗光漂白性,良好的生物相容性,是一种新型荧光探针[19-21];金纳米颗粒(gold nanoparticles,AuNPs)由于其特殊的结构及优良的光电效应,已成为一种优良的比色指示剂和高效的荧光猝灭剂;而核酸Apt又较之抗体具有更好的亲和力和特异性,且具有成本低,易于合成和修饰,稳定性强等特点[22-24],三者都在肿瘤标志物、酶、重金属离子和霉菌毒素等生物分析检测中有着广泛的应用[12,25]。Wang Mengke等[26]报道了AuNCs@AuNPs Apt传感器开发的荧光分析法已被报道用于胰蛋白酶的检测。然而,将DNA为模板的AuNCs与以DNA修饰的AuNPs相结合构建核酸Apt生物传感器用以检测食品生产、加工和储存运输中有害因子的研究还未得到广泛的探索。
Wen Qian等[19]开发了一种以肽定向快速(约20 min)合成AuNCs的方法,该方法是使用了辅助配体3-巯基丙酸(mercaptopropionic acid,MPA)和强还原剂NaBH4。本实验在Wen Qian等[19]研究基础上,以DNA Apt为模板,采用与肽模板化相同的方法直接快速合成AuNCs,以OTA的DNA Apt为模板,在5’端添加C12序列(CCC CCC CCC CCC),设计了一条包含Apt序列(OTA)的DNA链作为AuNCs定向快速(20 min)合成的模板,得到了OTA Apt功能化的AuNCs(OTA-AuNCs)。以无标记快速合成的核酸Apt模板AuNCs与其核酸Apt部分互补的单链cDNA修饰AuNPs之间构建的一种新型荧光复合纳米生物传感器用于快速检测靶标毒素——OTA。以AuNCs这种新型纳米材料作为研究介质,一方面利用AuNCs自身所特有的荧光性质,以OTA的底物核酸Apt作为识别分子,合成的无标记以核酸Apt为模板的AuNCs;另一方面,引入与此核酸Apt部分互补的cDNA标记修饰的AuNPs,利用AuNPs所具有的荧光猝灭性质,当Apt-AuNCs@cDNA-AuNPs复合纳米传感器形成时,Apt-AuNCs(能量供体)的荧光会被cDNA-AuNPs(能量受体)所猝灭;如此时加入OTA,由于Apt与靶标之间具有更强的亲和力,Apt-AuNCs会优先与毒素靶标相结合,而从Apt-AuNCs@cDNA-AuNPs复合纳米传感器中分离出来,使得整个体系的荧光强度得到恢复,由此,可根据AuNCs的荧光恢复强度定性及定量的检测靶标毒素(OTA)。此外,该新型荧光复合生物传感器还可以改变不同的靶标(如OTA、黄曲霉毒素B1、T-2毒素、伏马毒素等)的底物核酸Apt进而快速合成不同模板的功能性AuNCs,准确识别各靶标毒素,达到定性及定量分析检测多种靶标毒素的目的。该方法合成快速简便、操作简单、灵敏度高、选择性强、稳定性好且具有较低的检测限,预期在食品安全检测方面具有良好的应用前景,也为复杂生物领域中与食品相关各领域中的有害因子检测提供一种新的思路和平台。
1 材料与方法
1.1 材料与试剂
氯金酸(纯度99.95%)、MPA(纯度99.0%)美国Sigma公司;柠檬酸三钠、硼氢化钠、氯化钠、柠檬酸、Tris、盐酸 国药集团化学试剂有限公司;OTA、T-2毒素、黄曲霉毒素B1郑州分子科贸有限公司;实验中所有试剂均为分析纯。Apt(OTA):CCCCCCCCCCC CGATCGGGTGTGGGTGGCGTAAAGGGAGCATCGGA CA;cDNA:TGTCCGATGCTCCCTTTACGCCACCCAC ACCCGATC-(C)3-SH。
1.2 仪器与设备
F-4600荧光可见分光光度计 日本日立公司;UV-vis紫外-可见分光光度计 日本岛津公司;JEM-2100透射电子显微镜 日本电子公司;纳米粒度和电位分析仪 英国马尔文仪器有限公司。
1.3 方法
1.3.1 DNA模板AuNCs的合成
200 μL DNA溶液(5 μmol/L)以及1.0 mL氯金酸溶液(2.5 mmol/L)混合,所得溶液于磁力搅拌下加入150 μL MPA溶液(30 μmol/L),同时加入1 mol/L氢氧化钠溶液(约10 μL)将混合物的pH值调整至5以下。将混合物持续搅拌10 min,加入150 μL冰水浴中新鲜制备的硼氢化钠(1 mmol/L),再持续搅拌10 min,即得到DNAAuNCs[19]。反应完成后,将所得AuNCs用超纯水洗涤,除去过量的MPA和DNA,并将该AuNCs溶液于室温下避光保存待用。
1.3.2 AuNPs的合成
AuNPs(13 nm)根据文献报道的柠檬酸钠还原法合成[27]:在三颈烧瓶中加入99 mL超纯水和1 mL氯金酸溶液(25 mmol/L),磁力搅拌下加热回流,反应液充分沸腾时,快速加入5 mL 1%柠檬酸三钠溶液。待溶液变为深酒红色,即得到AuNPs原液,冷却至室温后至4 ℃冰箱避光保存。
1.3.3 cDNA标记AuNPs
根据Zhang Xu等[28]报道的快速稳定巯基DNA修饰AuNPs进行,并通过紫外表征。10 μL(不同浓度的c-DNA)添加到200 μL的金纳米溶液,然后旋涡混合器混匀,此时加入8 μL柠檬酸-HCl缓冲溶液(pH 3.0)(500 mmol/L)放置于室温,孵育5 min,然后加入182 μL超纯水,即得到cDNA-AuNPs溶液。
1.3.4 OTA的检测
100 μL 3 nmol/L的cDNA标记金纳米溶液,2.5 μmol/L核酸Apt修饰的AuNCs溶液混匀,之后将100 μL一系列不同浓度的赭曲霉毒素(包含10 mmol/L Tris-HCl缓冲溶液,pH 7.4),添加到上述溶液中,37 ℃孵育60 min后,最终的混合物即用F-4600荧光光谱仪进行荧光扫描(激发波长350 nm、发射波长580 nm)。将反应体系中无靶标毒素OTA的荧光强度记为F;将反应体系中有OTA的荧光强度记为F’;荧光恢复强度为ΔF。
1.3.5 传感器特异选择性检测
选择常见食品生产、加工和储存运输过程中常见的毒素,如:黄曲霉毒素B1、OTA、T-2毒素等及其混合物作为干扰物质代表(1 ng/mL,75%甲醇溶液溶解),以对应波长580 nm处荧光强度为指标,评估该OTA核酸Apt模板合成的AuNCs和cDNA标记AuNPs构建荧光复合纳米生物传感器检测靶标毒素OTA的特异选择性。
1.3.6 玉米样品加标检测
实际玉米面粉样品的前处理方法参照国标HPLC法[29]。首先在125 mL体积分数70%甲醇溶液中加入25 g玉米面粉和5 g氯化钠粉末,超声混匀30 min。将定性滤纸过滤过的该混合溶液收集于干净的100 mL具塞量筒中备用,此滤液记为提取液A。准确移取15 mL提取液A与30 mL蒸馏水混匀,以微纤维滤纸过滤,此滤液记为提取液B,再在提取液B中加入不同浓度的OTA标准品,剧烈振荡10 min。之后,将该混合溶液于4 000 r/min低温高速离心机中匀速离心10 min,留取上清液于-20 ℃冰箱保存备用。
检测时,在复合荧光纳米传感器中加入收集到的上清液,记录在580 nm波长处荧光强度,重复测定3 次,考察该方法的加标回收率,并通过结果评价该构建的生物传感器检测玉米样品中OTA的准确度和实际样品的可行性。
1.4 数据处理
每组数据均重复3 次,利用Origin 2018软件处理数据作图。
2 结果与分析
2.1 实验设计与工作原理
基于无标记AuNCs的新型荧光生物传感器的检测原理如图1所示:以靶标毒素(OTA)的底物核酸Apt作为识别分子,快速合成无标记核酸Apt的AuNCs,同时引入了与其底物核酸Apt链部分互补的cDNA标记修饰的AuNPs,形成Apt(OTA)-AuNCs@cDNA-AuNPs复合纳米传感器。利用AuNPs的荧光猝灭性质,当无靶标毒素(OTA)存在时,Apt-AuNCs和cDNA-AuNPs杂交互补形成稳定的结构,Apt-AuNCs(能量供体)的荧光就会被cDNA-AuNPs(能量受体)所猝灭;当靶标毒素(OTA)存在时,由于Apt与靶标之间具有更强的亲和力,Apt-AuNCs会优先和毒素靶标结合而分离出来,此时整个Apt(OTA)-AuNCs@cDNA-AuNPs复合纳米传感体系的荧光强度将得到恢复。通过测定相对荧光强度,可准确定性及定量检测靶标毒素OTA。

图2 纳米材料表征图Fig.2 Characterization of nanomaterials
如图2A所示,以OTA底物核酸Apt链为模板合成的AuNCs分散性良好,粒径均匀(平均粒径约2 nm),高分辨透射电镜图像表明,其晶格条纹(~2.3)与晶面的原子立方晶面间距(111)一致。由图2B所示,Apt(OTA)-AuNCs的最大发射波长为580 nm,激发波长为350 nm。为进一步确定合成AuNCs的荧光现象,采用激发375 nm的紫外灯进行照射表征。由图2B插图可见,可观察到合成的核酸Apt为模板的AuNCs具有红色荧光,可确定AuNCs合成成功。如图2C所示,合成的AuNPs在520 nm波长处有最大紫外吸收峰值。如图2D所示,合成的AuNPs是酒红色,均匀分散无团聚,平均粒径约13 nm。
2.1.1 cDNA标记AuNPs的表征
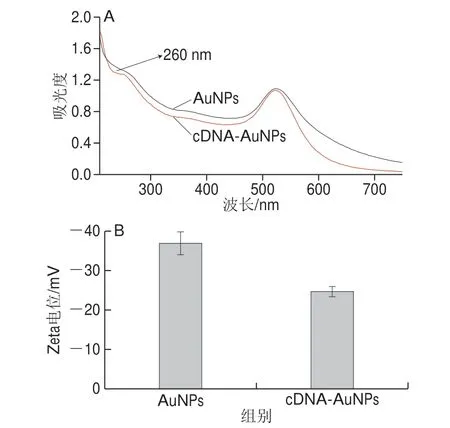
图3 cDNA标记AuNPs的表征Fig.3 Characterization of cDNA-labeled AuNPs
设计cDNA的3’端具有巯基,通过Au-S键与AuNPs结合形成cDNA-AuNPs偶联物。与裸AuNPs相比,cDNA-AuNPs的吸收光谱出现了新的细微的吸收峰,如图3A所示,其波长为260 nm,由此验证cDNA与金纳米表面的结合成功。Zeta电位测定结果也进一步证明了cDNA与AuNPs的结合,如图3B所示,裸AuNPs的Zeta电位值约为-36.87 mV,而cDNA标记AuNPs后的Zeta电位值转变约为-24.7 mV,进一步证明了cDNA成功标记在AuNPs的表面。
2.1.2 cDNA-AuNPs和Apt-AuNCs的荧光共振能量转移表征
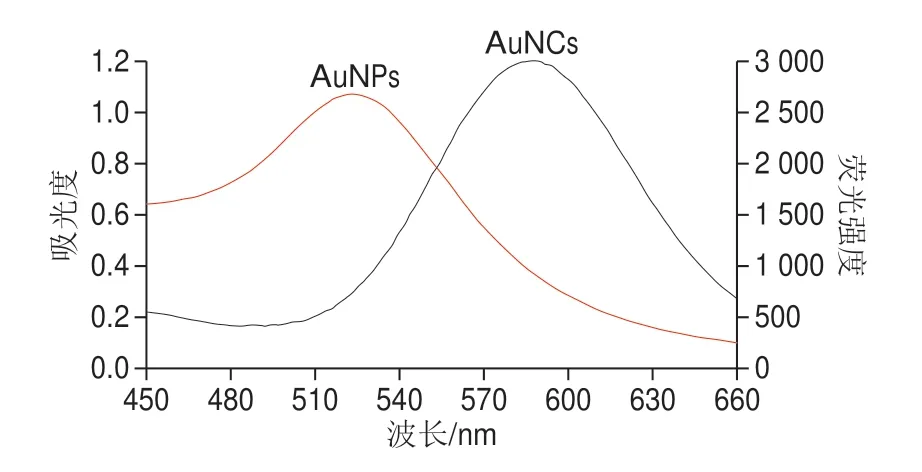
图4 AuNPs的紫外吸收光谱图的表征和AuNCs的荧光光谱表征Fig.4 UV-vis absorption spectra of AuNPs and fluorescence emission spectra of Apt(OTA)-AuNCs
由图4可知,cDNA-AuNPs的吸收光谱与Apt-AuNCs的发射光谱有很好的重叠,说明Apt-AuNCs(能量供体)与cDNA-AuNPs(能量受体)之间可能发生荧光共振能量转移,由于两条链(核酸Apt与核酸Apt部分互补的cDNA)在一定的条件下可以发生部分杂交互补,Apt-AuNCs与cDNA-AuNPs之间的距离缩短,形成Apt-AuNCs@cDNAAuNPs复合物,从而形成了荧光共振能量转移平台平台,达到了荧光共振能量转移平台距离的要求。
2.1.3 生物传感器检测靶标毒素(OTA)的可行性验证
本研究中基于OTA底物核酸Apt模板快速合成的AuNCs,如图5曲线a所示,在580 nm波长处具有最大的荧光发射峰值。当靶标毒素(OTA)单独与该AuNCs同时存在时,混合溶液的荧光强度与AuNCs本身的荧光强度并区别不大,说明靶标毒素(OTA)本身对AuNCs的荧光不会产生影响(图5曲线b)。在cDNA-AuNPs存在下,AuNCs上的底物核酸Apt与AuNPs上标记的cDNA互补结合杂交形成dsDNA,此时Apt-AuNCs与cDNA-AuNPs之间形成了荧光共振能量转移体系,AuNCs的荧光被猝灭(图5曲线d)。然而,若此时在Apt-AuNCs@cDNA-AuNPs复合纳米传感体系中加入靶标毒素(OTA),则如图5曲线c所示,核酸Apt与靶标OTA之间更强的亲和力致使Apt-AuNCs会优先与靶标相结合而远离cDNA-AuNPs,从而使得整个体系的荧光强度恢复。

图5 复合生物传感器可行性的荧光光谱表征Fig.5 Fluorescence spectral characterization of biosensor feasibility
2.2 实验条件的优化
2.2.1 修饰AuNPs的巯基DNA浓度优化
AuNPs上修饰巯基DNA是本研究中重要的步骤。如图6所示,不同浓度的cDNA加入到AuNPs溶液中(pH 3),通过紫外光谱检测得知:当cDNA浓度为1 μmol/L时,其修饰AuNPs溶液较为稳定,因此本研究最终选择cDNA的浓度为1 μmol/L。
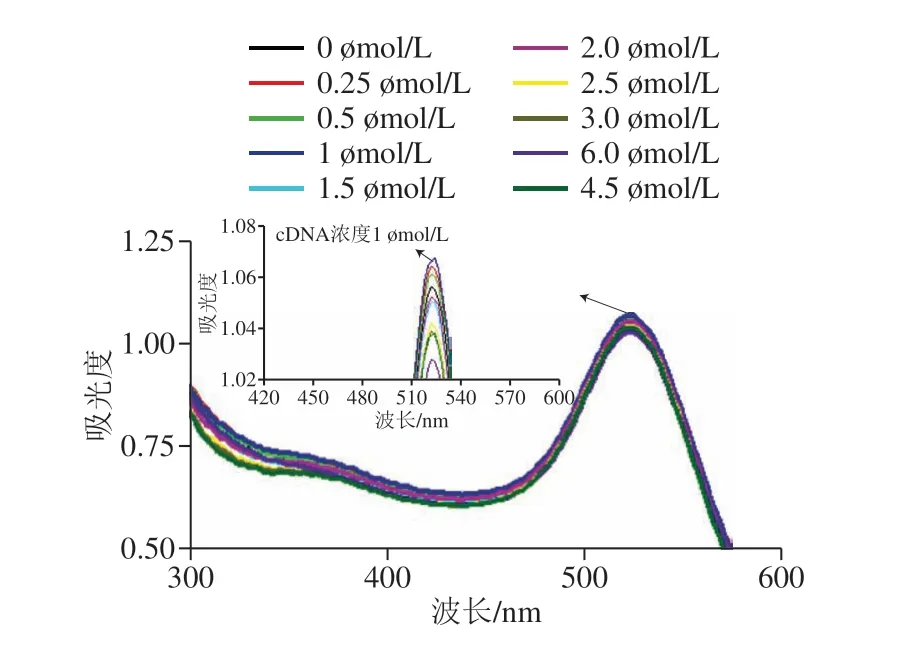
图6 不同浓度的cDNA标记AuNPs的紫外表征Fig.6 UV-vis absorption spectra of AuNPs labeled with different concentration of cDNA
2.2.2 cDNA-AuNPs的浓度优化
引 入c D N A 标 记A u N P s 后,A p t-A u N C s 与cDNA-AuNPs之间发生荧光共振能量转移,如图7所示,固定Apt-AuNCs浓度,随着cDNA-AuNPs浓度的增加(浓度范围为0~3.5 nmol/L),Apt-AuNCs@cDNA-AuNPs复合纳米传感体系的荧光强度迅速下降,当cDNA-AuNPs浓度为3 nmol/L时,此体系荧光强度猝灭效果最好。
由于cDNA-AuNPs浓度是反应体系中一个重要的因素,因此还进一步设计了实验方案用以确认最优浓度。设定cDNA-AuNPs浓度范围为0~3.5 nmol/L,每个选取浓度重复测定3 次。每个固定浓度的c D N AAuNPs,分别在有、无OTA存在时(OTA质量浓度为0.5 ng/mL)进行实验,此Apt-AuNCs@cDNA-AuNPs复合纳米传感体系的荧光恢复强度,如图8所示,随着cDNA-AuNPs浓度的升高,体系荧光强度是逐渐恢复上升的。当浓度为3 nmol/L时,荧光恢复强度达到最大,当浓度上升到3.5 nmol/L时,荧光强度又下降。综上所述,本研究中确定cDNA-AuNPs的最优浓度为3 nmol/L,此时Apt-AuNCs@cDNA-AuNPs传感器的荧光靶标恢复性能最好。
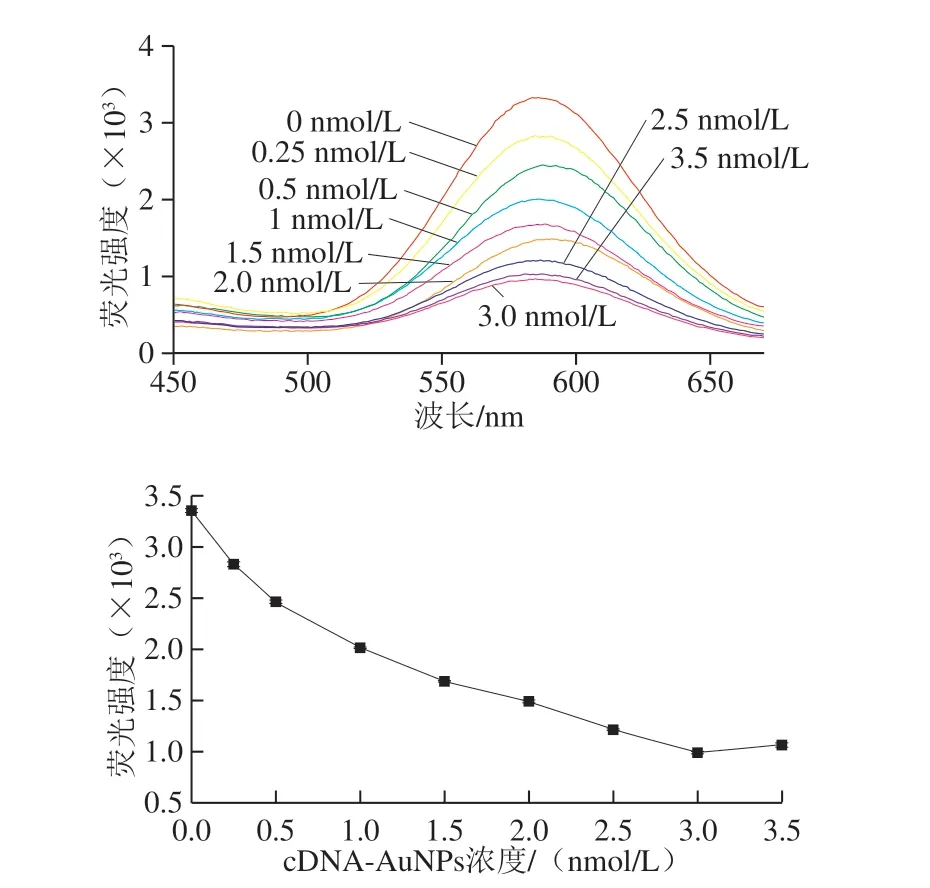
图7 不同浓度cDNA-AuNPs猝灭AuNCs的荧光图谱Fig.7 Fluorescence spectra of Apt(OTA)-AuNCs/cDNA-AuNPs systems with different concentrations of cDNA-AuNPs
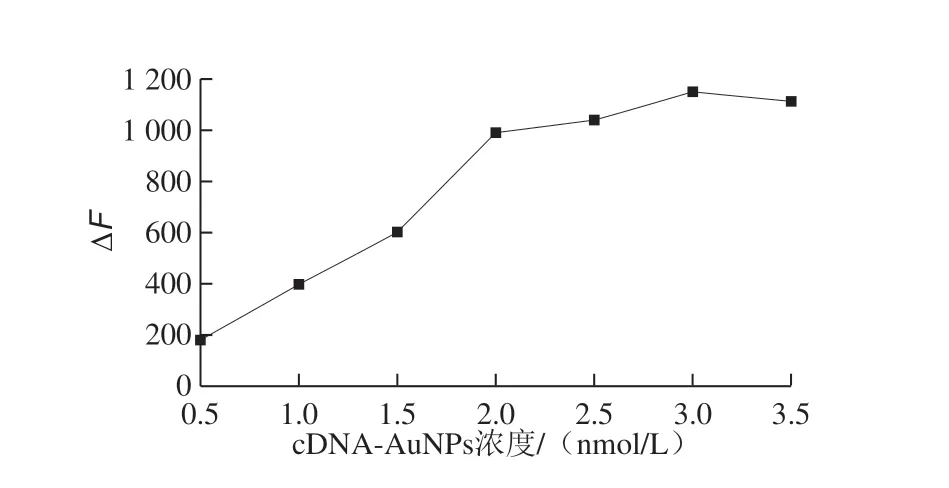
图8 cDNA-AuNPs浓度的优化Fig.8 Optimization of cDNA-AuNPs concentration
2.2.3 Apt-AuNCs@cDNA-AuNPs与靶标毒素(OTA)的孵育时间优化
靶标毒素(OTA)的孵育时间可能会对实验中荧光强度的恢复程度有一定影响,为了探究实验结果,固定Apt-AuNCs和cDNA-AuNPs的浓度,设定不同的孵育时间,使得反应体系OTA质量浓度为0.5 ng/mL,以此探究该因素对荧光恢复强度的影响。如图9所示,随着孵育时间的延长,荧光强度恢复程度逐渐上升,当孵育时间为60 min时,荧光恢复强度达到最大,而当孵育时间为70 min时,荧光强度又开始下降。由此可知孵育时间为60 min时,AuNCs上的核酸Apt与靶标毒素(OTA)结合最充分,此时多数AuNCs上的核酸Apt不与互补cDNA链发生杂交,体系荧光恢复强度最好。
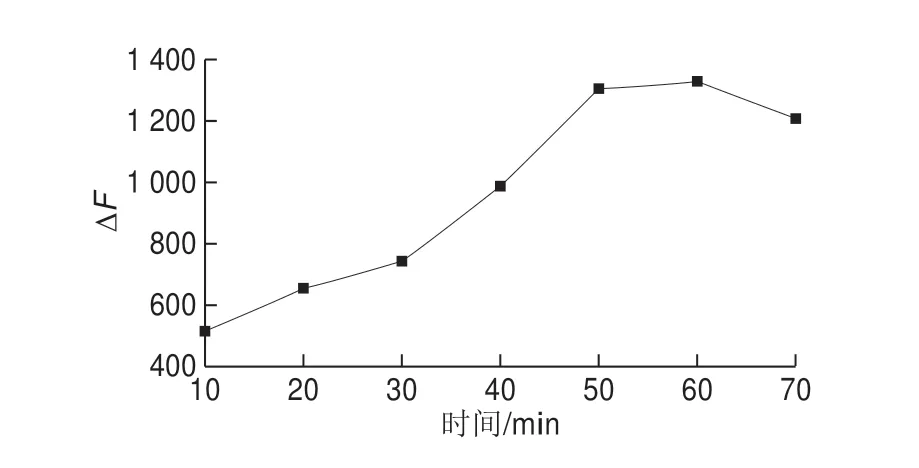
图9 孵育时间的优化Fig.9 Optimization of incubating time
2.3 Apt-AuNCs@cDNA-AuNPs对靶标毒素(OTA)的荧光检测结果

图10 不同浓度OTA对应的荧光光谱图(A)及OTA浓度与580 nm波长处的荧光强度线性关系(B)Fig.10 Fluorescence spectra of the assay at various concentrations of OTA (A) and linear relationship between fluorescence intensity and OTA concentration (B)
本研究基于生物传感器荧光共振能量转移原理,以靶标毒素(OTA)的底物核酸Apt为模板合成AuNCs作为能量供体,cDNA标记AuNPs作为能量受体,在无靶标毒素(OTA)存在时,荧光共振能量转移发生,体系荧光强度降低;随着质量浓度的逐渐增加,该构建的复合生物纳米传感体系在580 nm处对应的荧光强度逐渐升高,进而可准确定性和定量检测靶标毒素(OTA)。在上述最佳实验条件下,将一系列不同质量浓度的OTA标准品加入到含有一定浓度的核酸Apt修饰的AuNCs与cDNA标记AuNPs的混合缓冲溶液中(10 mmol/L Tris-HCl缓冲溶液,pH 7.4)孵育反应,测定OTA的标准曲线,如图10所示,该方法在靶标毒素(OTA)0.01~2.5 ng/mL范围内与荧光强度对应峰值(FI)呈良好的线性关系,回归方程为FI=689.84lgC(OTA)+8 315.31,R2=0.988 4,检出限为0.025 ng/mL。这个结果远低于国标中谷物类OTA限量标准的0.5 ng/mL。根据本研究中所构建的复合荧光生物传感器所得到的检测下限,该荧光生物传感器具有良好的灵敏度和相对较低的检出限(检出限为0.025 ng/mL)。
2.4 Apt-AuNCs@cDNA-AuNPs复核生物传感器的特异选择性
为了评估该构建的复合荧光生物传感器对靶标毒素(OTA)的特异选择性。选择3 种食品检测中常见的毒素:OTA、黄曲霉毒素B1、T-2毒素,将它们分别加入或混合后加入检测体系中,监测系统荧光强度的变化情况。使体系中毒素的终质量浓度为1 ng/mL,同时以Tris-HCl缓冲溶液代替毒素作为空白对照,结果如图11所示:空白对照的荧光强度很低,这时体系中无靶标存在,Apt-AuNCs@cDNA-AuNPs发生强烈的荧光共振能量转移,荧光强度降低;黄曲霉毒素B1、T-2毒素时产生的荧光强度峰值与空白对照相似,说明以OTA的底物核酸Apt模板合成的AuNCs@cDNAAuNPs传感器对这2 种毒素并无响应;而只有当靶标毒素(OTA)存在时,才产生了非常显著的荧光特异性响应。由此表明,该核酸Apt生物传感器对靶标毒素(OTA)具有良好的特异选择性。
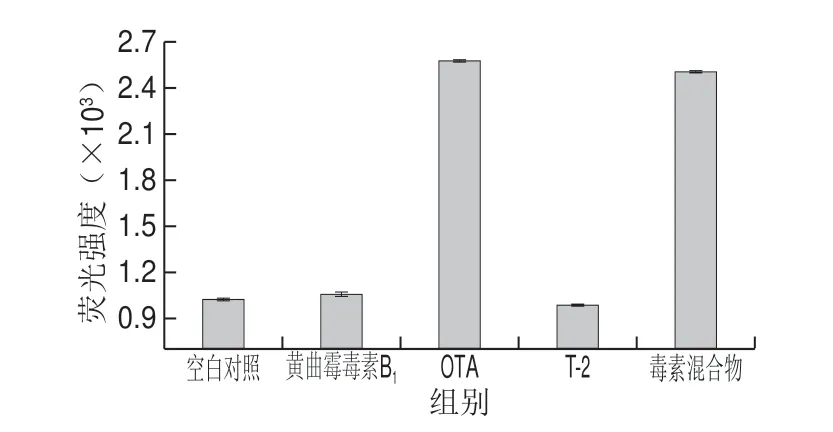
图11 核酸Apt传感器对OTA的特异选择性验证Fig.11 Selectivity of the assay toward OTA (1 ng/mL) and against other toxins
2.5 Apt-AuNCs@cDNA-AuNPs复合生物传感器的实际样品检测结果
在玉米提取液中,添加4 个不同质量浓度的OTA标准溶液,使得体系中的O T A 终质量浓度分别为0.25、0.5、0.75 ng/mL和1 ng/mL。采用构建好的复合荧光生物传感器检测玉米面中OTA的含量,进而确定复合荧光生物传感器对玉米面提取液中不同质量浓度OTA的加标回收率和精密度,每组实验重复测定3 次,按照标准曲线计算得到相应的含量,如表1所示。结果表明,该复合荧光生物传感器检测得到的回收率在88%~113%范围内,相对标准偏差在8.06%~11.05%之间,符合检测体系标准(12%)以下,说明该构建的复合荧光生物传感器具有良好的加标回收率和精密度。
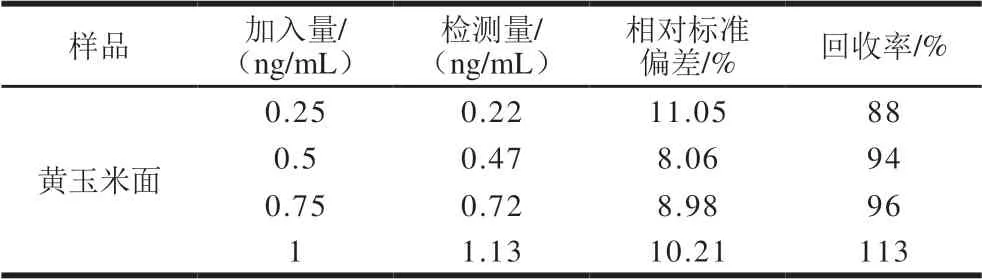
表1 实际样品中不同质量浓度OTA的回收率和精密度Table 1 Recovery and precision of aptasensor for real samples spiked with different concentrations of OTA
3 结 论
本研究旨在构建快速检测OTA的复合荧光Apt生物纳米传感器。研究中发现,所制备的Apt-AuNCs@cDNA-AuNPs复合荧光生物传感器,当无靶标毒素存在时,cDNA标记AuNPs可以猝灭以核酸Apt为模板修饰AuNCs的荧光,发生荧光共振能量转移现象,导致系统荧光强度降低;而一旦加入靶标毒素,Apt-AuNCs上的底物核酸序列倾向于与结合力更强的靶标毒素结合而从Apt-AuNCs@cDNA-AuNPs的复合体中分离出来,致使体系的荧光强度得到恢复。利用该原理,本实验设计了以靶标毒素(OTA)的底物核酸Apt序列为模板,快速合成制备了发射波长为580 nm的AuNCs,以靶标毒素(OTA)的底物核酸Apt序列的互补链修饰的AuNPs作为荧光猝灭剂,2 种纳米材料相结合形成Apt(OTA)-AuNCs@cDNA-AuNPs复合荧光生物传感器,用以实现了对靶标毒素(OTA)的准确定性及定量检测。在实际样品的检测过程中,该复合荧光生物传感器针对OTA的残留和加标检测,均展现出了良好的精密度、准确性和特异性。本研究还可利用改变靶标物对应的底物核酸Apt序列,合成对应的Apt模板AuNCs,以此可广泛应用于食品生产、储存、运输等各领域其他霉菌毒素及有害因子的检测,也可以用于农作物的重金属残留、生物医学中蛋白小分子的检测,具有一定的通用性。总之,该复合荧光生物传感器的构建有望为食品中霉菌、毒素等有害因子的检测提供一种新型的研究思路,可以实现靶标物的现场快速检测,提高检测效率,这对食品安全质量检测控制以及保证人类生命健康有着潜在的应用价值和社会意义。

