绿茶提取液制备金纳米粒子及其在VC比色分析中的应用
张 源,贾静娴,郑 贺,丁文琪,杨蕊宁
(唐山师范学院化学系,唐山市绿色专用化学品重点实验室,河北 唐山 063000)
VC又称抗坏血酸,是人体必需的营养物质,充当辅酶因子、抗氧化剂、神经递质等角色,参与生理代谢过程[1]。VC过量或不足均引发疾病,因此准确检测VC具有重要意义[2]。VC检测方法主要有高效液相色谱法[3]、荧光分析法[4]、电化学方法[5]等,这些方法检测结果可靠,灵敏度高,但存在抗干扰差、依赖仪器设备等不足,不能实现现场实时快速检测。因此建立快速准确、满足现场检测、成本低廉的VC检测方法十分重要[6]。目前基于纳米材料的可视化检测[7-9]成为研究热点,该法可通过裸眼观察溶液颜色实现目标分析物的定性及半定量分析,结果直观形象,结合紫外-可见光度计检测实现目标分析物的定量分析,快速简便,实用性强。
纳米金材料因特殊的物理化学性质和较大摩尔吸收系数而被用于比色分析农药[10]、金属离子[11]、蛋白质[12]、细菌[13]、病毒[14]等。制备性能稳定的金纳米粒子用于比色分析,可避免金纳米粒子在基质复杂的样品中受到高盐、强酸碱等影响而发生非特异性团聚。目前金纳米粒子的制备方法主要有化学还原法[15]、物理研磨法[16]、生物合成法[17]等。其中最常用的是化学还原法,采用柠檬酸钠[18]、硼氢化钠[19]等作为还原剂,但该法存在一些不足,如制备需高温、反应时间长、制备的金纳米粒子易团聚,不利于后续应用。虽然可采用加入分散剂的方式如十六烷基三甲基溴化铵改善金纳米粒子的稳定性[20],但可能引起生物毒性而限制金纳米粒子的应用;也可加入修饰剂如谷胱甘肽提高金纳米粒子的稳定性[21],虽然制得的金纳米粒子生物相容性好,但是制备过程繁琐耗时。因此,研发快速省时、条件温和、成本低廉的方法制备性能稳定、生物相容性好的金纳米粒子十分必要。
植物中富含蛋白质、脂肪、有机酸等天然活性成分[22],既可作为还原剂还原HAuCl4合成金纳米粒子,又可作为保护剂修饰在金纳米粒子表面,提高金纳米粒子的稳定性和生物相容性。木瓜汁[23]、猕猴桃汁[24]、废弃葡萄皮[25]、中药黄连[26]等已被用于绿色制备金纳米粒子。茶叶中富含茶多酚、茶多糖、蛋白质和氨基酸等[27],其中茶多酚包括黄酮类、酚酸类、花色苷等三十多种多酚类物质。茶叶提取液已被用于制备铜纳米粒子[28]、银纳米粒子[29]、铁纳米粒子[30]等,而用于制备金纳米粒子的报道较少[31],目前鲜见关于绿茶提取液合成的金纳米粒子用于VC比色分析的研究报道。
本研究以绿茶提取液为还原剂和保护剂快速绿色制备金纳米粒子,并与传统方法制备的金纳米粒子进行比较,评估金纳米粒子的稳定性。以绿茶提取液制备的金纳米粒子作为催化剂和晶种,与VC和AgNO3溶液混合,利用VC还原AgNO3生成银单质,覆盖在金纳米粒子表面形成金银核壳纳米粒子(AuNPs@Ag),作为核的金信号被覆盖,而作为壳的银信号产生。随着VC含量的增加,银信号越来越强,溶液颜色发生变化,结合紫外-可见光度计检测,实现VC的定性及定量分析。如图1所示,据此建立纳米金比色检测VC的新方法,为药品、食品检测提供技术支持。
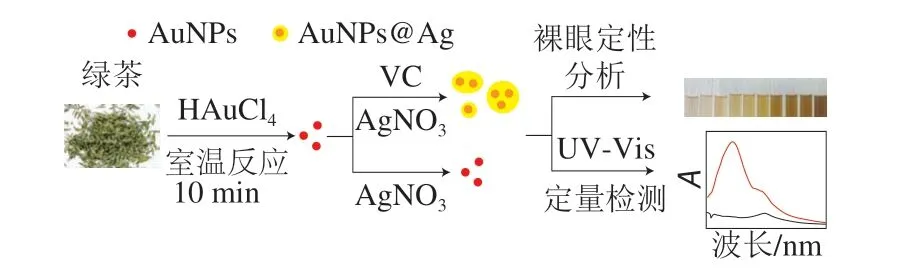
图1 绿茶提取液制备金纳米粒子用于比色检测VC示意图Fig.1 Schematic illustration of the preparation of AuNPs with green tea extract and the colorimetric detection of vitamin C
1 材料与方法
1.1 材料与试剂
市购绿茶毛尖,原产地河南信阳;HAuCl4•3H2O、AgNO3、苯酚、浓硫酸和水合茚三酮 上海国药集团化学试剂有限公司;蔗糖、葡萄糖、赖氨酸、谷氨酸、天冬氨酸、没食子酸、甘氨酸 上海阿拉丁生化股份有限公司;茶多酚(纯度98%) 北京酷尔化学科技有限公司;其余所用试剂均为分析纯;实验用水均为超纯水。
1.2 仪器与设备
UV-2600紫外-可见分光光度计、CT15RT冷冻离心机上海天美科学仪器有限公司;Sigma-300场发射扫描电镜德国卡尔蔡司有限公司;TENSOR-37傅里叶变换红外光谱仪 德国布鲁克科学仪器公司。
1.3 方法
1.3.1 绿茶提取液配制
称取茶叶50 g,加入95 mL纯水,室温搅拌30 min后用0.22 μm水系滤膜过滤,收集滤液,定容至100 mL,绿茶提取液质量浓度为0.5 g/mL,于-20 ℃保存,用前解冻。制备金纳米粒子时稀释50 倍。
1.3.2 绿茶提取液主要成分分析
参考GB/T 8313ü 2018《茶叶中茶多酚和儿茶素类含量的检测方法》[32],福林-酚比色法测定绿茶提取液中茶多酚含量。配制没食子酸标准溶液,质量浓度分别为10、20、30、40 μg/mL和50 μg/mL。移取绿茶提取液或没食子酸溶液1 mL,加入5 mL 10%福林-酚溶液,反应5 min后加入4 mL 7.5% Na2CO3溶液,室温放置60 min后,测定吸光度A765nm。
参考GB/T 8314ü 2013《茶 游离氨基酸总量的测定》[33],茚三酮比色法测定绿茶提取液中氨基酸的含量。配制谷氨酸标准溶液,质量浓度分别为0.2、0.3、0.4、0.5 mg/mL和0.6 mg/mL。移取绿茶提取液或谷氨酸溶液1 mL,依次加入0.5 mL pH 8磷酸缓冲溶液和0.5 mL 2%茚三酮溶液,沸水浴中加热15 min,冷却定容至25 mL,测定吸光度A570nm。
采用苯酚-硫酸方法[34]检测绿茶提取液中茶多糖的含量。配制葡萄糖标准溶液,质量浓度分别为0.025、0.05、0.1、0.15 mg/mL和0.2 mg/mL。移取绿茶提取液或葡萄糖溶液1 mL,加入1 mL 5%苯酚溶液,混匀后迅速滴加5 mL浓硫酸溶液,40 ℃加热30 min,冷却至室温测定吸光度A488nm。
1.3.3 绿茶提取液合成金纳米粒子
10 mL玻璃管中依次加入0.6 mL 0.01 g/mL绿茶提取液和0.1 mL 0.01 g/mL HAuCl4溶液,加水定容至10 mL,室温反应30 min,溶液为紫红色,即制得金纳米粒子。采用紫外-可见吸收光谱、傅里叶变换红外光谱和扫描电镜对金纳米粒子进行表征。改变绿茶提取液用量、NaOH溶液用量、反应温度和反应时间等金纳米粒子制备条件,测定400~700 nm波长范围内纳米金溶胶的紫外-可见吸收光谱,得到金纳米粒子制备的最佳条件。
1.3.4 柠檬酸钠为还原剂制备金纳米粒子
参考文献[35]方法,以柠檬酸钠为还原剂制备金纳米粒子,所用玻璃器皿经王水浸泡2 h后用大量自来水冲洗,超纯水润洗。50 mL 0.1 g/L HAuCl4溶液加热至沸腾后,快速加入0.01 g/mL 1.5 mL柠檬酸钠溶液,搅拌加热10 min,冷却至室温,即制得金纳米粒子。该传统方法制得的金纳米粒子,用于比较绿茶提取液为还原剂合成的金纳米粒子的稳定性。
1.3.5 金纳米粒子的稳定性评价
分别考察2 种方法制备的金纳米粒子在不同条件下的稳定性。首先评估金纳米粒子的热稳定性,在不同温度(20、30、50、70 ℃和100 ℃)条件下,测定纳米金溶胶在波长530 nm处吸光度;其次评估金纳米粒子的耐盐性能,在不同盐浓度(0、0.05、0.1、0.2 mol/L和0.3 mol/L)条件下,测定纳米金溶胶在波长530 nm处的吸光度;最后评估金纳米粒子的耐酸碱性,在不同pH值(3、4、5、6、7、8、9、10、11和12)条件下,测定纳米金溶胶在波长530 nm处的吸光度,采用NaOH和HNO3溶液调节纳米金溶胶pH值。
1.3.6 纳米金比色检测VC
10 mL比色管中依次加入0.3 mL纳米金溶胶、1.4 5 m L 纯水、0.5 m L 甘氨酸-氢氧化钠缓冲溶液(pH 9.6)、0.5 mL 0.01 mol/L AgNO3溶液和0.5 mL 20 mg/L VC溶液,室温反应30 min,观察溶液颜色,拍照记录实验现象,并测定紫外-可见吸收光谱。其余操作不变,用0.5 mL超纯水取代VC溶液为空白对照组。分别改变AgNO3用量、缓冲溶液pH值和反应时间等以得到比色检测VC的最佳实验条件。
1.3.7 纳米金比色检测VC方法特异性
为考察纳米金比色检测VC方法的特异性,分别用0.5 mL 200 mg/L甘氨酸、谷氨酸、赖氨酸、硫酸镁、柠檬酸、柠檬酸钠、葡萄糖、碳酸钾、天冬氨酸、蔗糖、混合溶液1(含上述10 种干扰物质)、混合溶液2(含上述10 种干扰物质和VC)代替0.5 mL 20 mg/L VC,并按1.3.6节方法检测。观察溶液颜色,测定紫外-可见吸收光谱。
1.3.8 方法分析性能评价
采用逐级稀释法配制质量浓度0、0.4、2、4、8、10、20、40、60、80、100 mg/L和120 mg/L VC溶液。取0.3 mL纳米金溶胶,依次加入1.35 mL水、0.5 mL甘氨酸-NaOH缓冲溶液(pH 10.6)、0.6 mL 0.01 mol/L AgNO3溶液,最后加入0.5 mL不同浓度VC溶液,摇匀,室温反应20 min后,拍照记录实验现象,并测定紫外-可见吸收光谱。以VC质量浓度为横坐标,溶液在波长410 nm处吸光度(A410nm)为纵坐标,建立标准曲线。平行做10 组超纯水代替VC的空白对照实验,测定A410nm,以计算方法的检出限(检出限为3 倍空白信号的标准偏差除以标准曲线斜率)。
1.3.9 实际样品分析
当地药店购买2 种不同厂家生产的VC药片(剂量均为100 mg/片),将药片研磨,超纯水溶解,配制成VC理论质量浓度为5 mg/L样品溶液;通过标准加入法进行加标回收率实验,将已知量的VC标准溶液加入至样品溶液中,配制VC理论质量浓度为6、25 mg/L和55 mg/L加标样品溶液。市售脉动饮料(VC质量浓度为200 mg/L),超纯水稀释配制VC理论质量浓度为5 mg/L样品溶液,并配制VC理论质量浓度为6、25 mg/L和55 mg/L加标样品溶液。按照1.3.8节方法操作,并计算加标回收率。绿茶提取液成分不同,会影响制备的金纳米粒子的性质,从而影响VC的检测结果。为了保证方法的准确性,绘制标准曲线和检测样品时需使用同一批绿茶提取液制备的纳米金溶胶。
1.4 数据处理与分析
相关实验做3 次平行,使用Origin 8.6软件统计并分析实验数据。
2 结果与分析
2.1 绿茶提取液主要成分分析结果
实验结果表明绿茶提取液中茶多酚含量为46.84 μg/g,与文献报道的酒石酸亚铁比色法测得茶叶提取液中茶多酚(0.111~0.253 mg/g)相比[36],本方法测得绿茶提取液中茶多酚含量略低,这可能与绿茶提取液配制温度有关,本实验室温下配制,而文献中加热煮沸。绿茶提取液中未检测到氨基酸,但红外光谱图显示绿茶提取液中含有—NO2和—NH基团,这可能是茶叶中与蛋白质结合在一起的酸性糖蛋白,即茶多糖。经计算绿茶提取液中茶多糖的含量为34.91 μg/g。
2.2 金纳米粒子的合成

图2 金纳米粒子和纳米金溶胶相关分析图Fig.2 UV-Vis spectrum, FT-IR spectrum and SEM image of AuNPs colloid prepared with tea polyphenols
如图2A所示,只有绿茶提取液加HAuCl4的溶液为紫红色,单独的绿茶提取液或HAuCl4溶液均为无色,紫外-可见分光光度计检测可知,紫红色溶液最大吸收波长为530 nm,这是金纳米粒子独有的表面等离子体共振特征。如图2B所示,茶多酚的Oü H伸缩振动和茶多糖的Nü H伸缩振动位于3 400~3 205 cm-1;ü CH2—和—CH3的Cü H伸缩振动位于2 925 cm-1;茶多糖、茶多酚C=C和C=O伸缩振动位于1 650 cm-1;芳香族化合物—NO2伸缩振动位于1 534 cm-1;—OH面内弯曲振动位于1 450 cm-1;茶多酚、多元醇、酰胺Cü O伸缩振动位于1 399 cm-1;环的分子骨架振动位于1 236 cm-1;Cü Oü C反对称伸缩振动位于1 146 cm-1;Cü N伸缩振动位于1 036 cm-1。傅里叶变换红外光谱谱图可知绿茶提取液中含有茶多酚、茶多糖等。反应后制备体系上清液中,1 532、1 234 cm-1和1 035 cm-1处吸收峰强度降低,表明有少量残余茶多糖,而Oü H的伸缩振动、面内弯曲振动以及Cü O伸缩振动峰消失,推断绿茶提取液中起还原作用的主要是茶多酚。制备的金纳米粒子中,3 400 cm-1处弱吸收峰,表明金纳米粒子表面有少量的—O H 和—N H 基 团;苯 环 上C ü H 伸 缩 振 动 位 于1 035 cm-1;C=O伸缩振动位于1 626 cm-1;Cü O伸缩振动位于1 400 cm-1;Cü Oü C反对称伸缩振动位于1 120 cm-1;这些结果表明绿茶提取液中茶多酚的ü OH被氧化后的产物吸附在金纳米粒子表面,充当保护剂。如图2C所示,可看出制备的金纳米粒子为球形,分散良好。以上实验结果表明由绿茶提取液成功制备金纳米粒子。
茶多酚的羟基具有还原性,与Au3+发生氧化还原反应生成Au0,羟基氧化产物RO吸附在金纳米粒子表面。即:+3R-OHn→Au0+4Cl-+3nH++3RO(n表示—OH个数)。为了验证推测的绿茶提取液制备金纳米粒子的还原机理,使用茶多酚制备纳米金溶胶。将0.1 mL 0.01 g/mL HAuCl4溶液分别与1、3、5 mL和7 mL 20 mg/L茶多酚溶液混合,定容至10 mL,70 ℃反应30 min。如图2D所示,当20 mg/L茶多酚体积在3 mL以上时可制备纳米金溶胶,随茶多酚体积的增大,金纳米粒子的最大吸收波长稍有变小。茶多酚作为还原剂成功制备纳米金溶胶,但是需要加热且反应时间稍长。而绿茶提取液可在室温条件下快速制备纳米金溶胶,这表明绿茶提取液中茶多酚起还原作用,但是其他成分如茶多糖等在金纳米粒子的制备中也有贡献。
2.3 绿茶提取液制备金纳米粒子实验条件优化
固定0.1 mL 0.01 g/mL HAuCl4溶液,定容10 mL,通过改变0.01 g/mL绿茶提取液用量0.03~2 mL,0.1 mL NaOH浓度0~0.1 mol/L,反应温度20~100 ℃,反应时间2~26 min,测定制备的纳米金溶胶的紫外-可见吸收光谱,以A530nm最大的条件为最佳。如图3A所示,随绿茶提取液用量增加,A530nm先增大后减小,当绿茶提取液用量为0.8 mL时A530nm最大,表明此时金纳米粒子含量最大。碱性条件对纳米颗粒的形成及生长具有重要影响[37],因此考察NaOH用量对合成金纳米粒子的影响,从图3B可知,加入不同浓度NaOH溶液,A530nm均在1.0左右,考虑到操作方便,后续选择不加碱。不同温度下,A530nm均在0.8以上(图3C),可在室温条件下制备金纳米粒子。随时间的延长(图3D),4 min时A530nm已在0.9以上。绿茶提取液制备金纳米粒子的最佳条件为绿茶提取液用量0.8 mL,室温反应10 min。
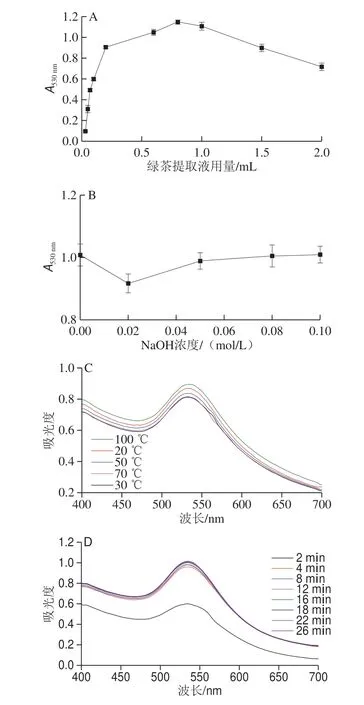
图3 金纳米粒子制备条件优化Fig.3 Optimization of synthesis conditions of AuNPs
2.4 金纳米粒子稳定性
制备性能稳定的纳米材料非常重要,在高盐、强酸碱环境中易团聚的纳米材料应用领域受限,难以用于实际样品分析。当金纳米粒子发生团聚时,颗粒粒径、形状和间距都发生变化,金纳米粒子表面等离子共振特征吸收峰波长和强度均发生变化,据此本研究以A530nm作为指标,考察温度、离子强度和pH值对金纳米粒子稳定性的影响,并与柠檬酸钠制备的金纳米粒子进行比较,结果如图4所示。如图4A所示,在不同温度下,A530nm均保持不变,说明2 种方法制备的金纳米粒子均耐高温。如图4B所示,当NaCl浓度低于0.3 mol/L时,绿茶提取液制备的金纳米粒子A530nm基本不变,而柠檬酸钠合成的金纳米粒子A530nm明显下降。如图4C所示,绿茶提取液制备的金纳米粒子A530nm没有发生变化,而pH值在6以下和9以上时柠檬酸钠合成的金纳米粒子A530nm有所下降。这些结果表明在高盐和强酸碱环境中柠檬酸钠制备的金纳米粒子发生了团聚,而绿茶提取液合成的金纳米粒子稳定性更佳,有利于后续应用,这可能与绿茶提取液中多成分充当保护剂有关。

图4 2 种金纳米粒子稳定性Fig.4 Stability of AuNPs prepared by two different methods
2.5 纳米金比色检测VC
绿茶提取液制备的金纳米粒子用于比色分析VC的原理[38]:将纳米金溶胶与VC和AgNO3混合,金纳米粒子作为晶种和催化剂,VC还原AgNO3生成银单质,覆盖在金纳米粒子表面,生成金银核壳纳米粒子,作为核的金信号减弱,作为壳的银信号增强,裸眼观察溶液颜色变化实现VC定性及半定量分析,结合紫外-可见分光光度计实现VC定量分析。使用紫外-可见分光光度计和扫描电镜表征进行验证,如图5A所示,与对照组相比(纯水取代VC),加入VC后溶液由淡红色变为黄色,最大吸收波长由530 nm蓝移至410 nm;如图5B所示,金银核壳纳米粒子粒径比金纳米粒子明显增大。以上结果表明纳米金比色检测VC方法可行。

图5 加入VC前后体系的紫外-可见吸收光谱图(A)和加入VC后体系的扫描电镜图(B)Fig.5 UV-Vis spectra of AuNPs in the absence and presence of vitamin C (A),and SEM image of AuNPs@Ag in the presence of vitamin C (B)
2.6 纳米金比色检测VC条件优化
纳米金比色检测VC方法的灵敏度依赖于AgNO3用量、pH值和反应时间。固定加入0.3 mL纳米金溶胶,0.5 mL 20 mg/L VC,定容2.75 mL,通过改变0.01 mol/L AgNO3溶液用量50~700 μL,缓冲溶液pH 9.0~10.6,反应时间0~39 min,测定金银核壳纳米粒子的紫外-可见吸收光谱,以A410nm最大的条件为最佳。如图6所示,纳米金比色检测VC最佳条件为AgNO3溶液用量为600 μL,甘氨酸-NaOH缓冲溶液pH值为10.6,反应时间40 min。使用甘氨酸-NaOH缓冲溶液,不仅为反应体系提供碱性环境,且与Ag+配位,避免生成AgOH沉淀。


图6 纳米金比色检测VC条件优化Fig.6 Optimization of experimental conditions for the colorimetric detection of vitamin C using AuNPs
2.7 纳米金比色检测VC方法特异性
为考察纳米金比色检测VC方法的特异性,混合溶液1、混合溶液2代替VC,结果如图7所示。只有加入VC和混合溶液2时,溶液颜色由浅粉变为黄色,且产生明显A410nm信号,表明该方法具有良好的特异性。
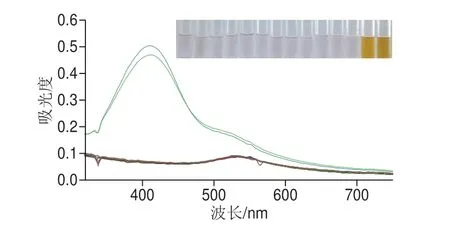
图7 纳米金比色检测VC方法特异性Fig.7 Specificity of AuNPs for vitamin C detection
2.8 纳米金比色检测VC方法分析性能评价

图8 加入不同质量浓度VC溶液颜色图Fig.8 Changes in color and absorbance at 410 nm in the presence of different concentrations of vitamin C
在最优实验条件下考察方法分析性能,由图8可知,从左到右VC质量浓度分别为0、0.4、2、4、8、10、20、40、60、80、100 mg/L和120 mg/L。当VC质量浓度2 mg/L时,溶液颜色由浅粉变为淡黄色,随着VC质量浓度增大,颜色越来越深。通过紫外-可见吸收光谱检测,以VC质量浓度为横坐标,A410nm为纵坐标,绘制标准曲线,线性方程为y=0.024 4x+0.098 2,R2=0.994 6,线性范围为0.4~120 mg/L,检出限为0.14 mg/L。相对标准偏差为1.4%(n=8,VC质量浓度为2 mg/L)。
2.9 实际样品中VC的比色分析

图9 纳米金比色检测实际样品中VC含量Fig.9 Color changes observed for real samples with different concentrations of vitamin C

表1 实际样品中VC的检测(n= 3)Table 1 Summary of results obtained from determination of vitamin C in real samples (n= 3)
为了考察本方法的应用性,测定VC药片和市售饮料中VC的含量。如图9所示,随着VC质量浓度的增加,体系颜色越来越深。根据紫外-可见光谱检测结果,计算加标回收率(表1)在92.2%~115.0%之间。对于牛奶等复杂基质样品中VC的检测,复杂基质破坏金纳米粒子的稳定性而限制本方法的应用,因此本方法的应用性还需进一步研究与改进。本方法可用于简单基质样品中VC的分析,特别是裸眼观察体系颜色即可实现VC的快速定性分析。
3 结 论
本实验以绿茶提取液为还原剂和保护剂,与HAuCl4室温反应10 min,成功制备金纳米粒子,方法简单快速,成本低廉,绿色环保。且与传统方法制备的金纳米粒子(柠檬酸钠为还原剂)相比较,本方法制得的金纳米粒子具有更好的稳定性。以绿茶提取液制备的金纳米粒子为晶种和催化剂,用于VC的比色分析,在最优条件下,VC质量浓度在2 mg/L以上,裸眼观察溶液颜色实现VC定性及半定量分析;紫外-可见分光光度计测量实现VC定量分析,检出限为0.14 mg/L。并将建立的方法用于VC药片和市售饮料中VC的分析,加标回收率令人满意。该研究以绿茶提取液为原料制备金纳米粒子,制备的金纳米粒子可用于实际分析,具有应用价值,同时也可为其他新型纳米材料的绿色制备技术提供基础资料。

