玉米淀粉-玉木耳多糖复配体系理化及结构性质
李 妍,崔维建,赵城彬,吴玉柱,王思琪,曹 勇,许秀颖,刘景圣
(吉林农业大学食品科学与工程学院,小麦和玉米深加工国家工程实验室,吉林 长春 130000)
玉木耳(Auricularia corneaEhrenb.)[1]是吉林农业大学李玉院士团队从毛木耳菌株中驯化培育出的具有稳定遗传性状的白色变异菌种,是一种富含多糖类物质的胶质菌,具有广阔的发展前景[2-3]。现阶段对玉木耳的相关研究较少,仅涉及玉木耳的成分检测及食品研发、玉木耳多糖(A.corneaEhrenb.polysaccharide,ACEP)的提取优化与功能活性测定[4-6],鲜见ACEP与食品成分间相互作用的研究。
玉米淀粉(corn starch,CS)作为增稠剂、稳定剂和黏着剂等广泛应用于食品工业,具有低成本和生物相容性等特点。长期以来,国内外学者都十分重视CS资源的开发与利用。然而,天然CS存在一些缺陷,包括易老化回生、稳定性差等,不能满足某些食品加工的要求[7]。有研究发现,非淀粉多糖的添加可以改善淀粉食品的口感和质地,增加黏度,提高产品稳定性,控制水分流动,延缓淀粉回生。这些性质的改善取决于多糖类型、浓度、分子质量、混合比例、混合方法等多种因素[8]。Liu Suchen等[9]发现凉粉草多糖可以提高小麦淀粉糊化初期的热稳定性,提高淀粉的流变性能;蔡旭冉等[10]发现胶体与淀粉之间的电荷相互作用对复配体系的糊化性质和流变学性质起重要的作用;Achayuthakan等[11]发现在CS中添加瓜尔豆胶和黄原胶可以增加黏度和弹性,并限制淀粉基体系的回生和脱水收缩;Luo Denglin等[12]发现菊粉能够增加小麦淀粉糊化温度,降低峰值黏度并抑制直链淀粉回生。但目前鲜见将ACEP与CS复配的研究报道。
本实验选用不同添加量的ACEP,制备CS-ACEP复配体系,并对其糊化特性、热特性、流变及结构性质进行研究,分析体系中ACEP与CS间的相互作用,进一步补充了多糖与淀粉复配体系的研究数据,以期为ACEP作为功能性配料添加到富含淀粉类食品中提供理论依据。
1 材料与方法
1.1 材料与试剂
ACEP(总糖78.32%、蛋白质7.95%、水分10.55%)由实验室自制;CS(总淀粉82.36%、直链淀粉28.29%、脂肪0.52%、蛋白质0.38%、水分11.42%) 上海金穗生物科技有限公司。
1.2 仪器与设备
3JK-1型快速黏度分析仪 澳大利亚Perten公司;MCR-302型流变仪 奥地利Anton Paar公司;Q-2000型差示扫描量热(differential scanning calorimetry,DSC)仪美国TA公司;AlPhal-4LDPlus冷冻干燥机 德国Christ公司;Phenom Pro台式扫描电镜 复纳科学仪器(上海)有限公司;VERTEX70傅里叶红外光谱仪德国Bruker公司。
1.3 方法
1.3.1 CS-ACEP复配体系的制备
根据Zhang Bao等[13]的方法并修改。准确称量2.5 g样品放入RVA专用铝盒中,加入去离子水,配成质量分数10%的悬浮液,其中ACEP添加量为质量分数0%、0.5%、1.0%、2.0%、5.0%和10.0%。使用塑料搅拌桨将样品完全溶解,避免样品结块、黏附以及挂壁。
1.3.2 指标测定
1.3.2.1 糊化性质的测定
取1.3.1节方法制备的复配体系,参考美国谷物化学师协会操作规程中的标准程序,采用升温-降温循环[14]:开始在50 ℃保持1 min,以12 ℃/min在3.75 min内升温到95 ℃,在95 ℃保持2.5 min,然后在3.75 min内下降到50 ℃。
1.3.2.2 热特性的测定
参考Zhang Xiaoyu等[15]的方法。称取5 mg样品加入坩埚中,其中ACEP添加量为0%、0.5%、1.0%、2.0%、5.0%和10.0%,按照质量比1∶2的比例加入去离子水,密封后在4 ℃条件下平衡24 h,以10 ℃/min的速率从30~100 ℃进行扫描,使用密封的空坩埚作为参考,记录凝胶化的起始温度(T0)、峰值温度(TP)、终止温度(Tc)和热焓值(ΔH)。
1.3.2.3 流变学特性的测定
参考Zhou Danian等[16]的方法稍作改动。取1.3.2.1节中RVA制备的淀粉糊,于25 ℃平衡5 min后置于流变仪上,采用平板-平板测量系统,平板直径4.0 cm,设置间隙1.0 cm,刮去平板外多余样品,加上盖板。
静态流变特性的测定:在温度25 ℃条件下,剪切速率(γ)从0~300 s-1递增,再从300~0 s-1递减。采用Herschel-Bulkley模型对数据点进行回归拟和,方程如下:
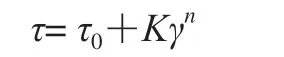
式中:τ为剪切应力/Pa;τ0为屈服应力/Pa;K为稠度系数/(Pag sn);γ为剪切速率/s-1;n为流体指数。
动态黏弹性质的测定:样品在扫描温度25 ℃、角频率0.1~100 rad/s、1%应变的条件下测定。记录储能模量(G’)及损耗模量(G”)随角频率的变化。
1.3.2.4 微观结构观察
取1.3.2.1节中RVA制备的糊化样品,冷冻干燥后切成薄片固定于样品台的导电双面胶上,横截面向上,参考郭宏伟等[17]的方法,喷金处理120 s后放在扫描电子显微镜中观察,选取最佳角度与放大倍数观察样品的形貌状态。
1.3.2.5 红外光谱扫描
取1.3.2.1节中RVA制备的糊化样品,冷冻干燥后粉碎并过100 目筛,干燥至质量恒定备用。使用傅里叶红外光谱测定样品的结构。参考Zhao Chengbin等[18]的方法并作部分改动:称取1 mg样品与150 mg溴化钾在红外灯下研磨混合均匀,置于模具中在15 MPa抽真空压片60 s。扣除溴化钾薄片的背景,在4 000~400 cm-1,扫描64 次,分辨率为4 cm-1,得到红外光谱图。采用OMNIC 8.0对谱图进行基线矫正和自动平滑处理,得到处理后的红外光谱图。另外,进行去卷积处理,去卷积参数选择半峰宽为40.4 cm-1,增强因子为3.1。
1.4 数据分析
实验均重复3 次,使用Origin 2018软件绘图,采用SPSS Statistics 23.0软件处理数据,通过ANOVA进行差异显著性分析,P<0.05,差异显著。
2 结果与分析
2.1 ACEP添加量对CS糊化特性的影响
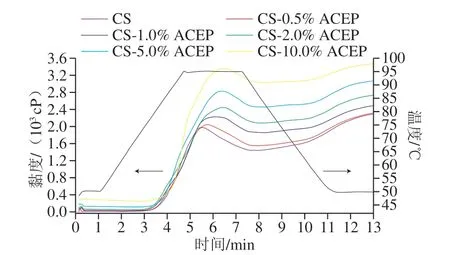
图1 CS-ACEP复配体系的糊化曲线Fig.1 Pasting curves of CS-ACEP blends
由图1可知,添加ACEP后,复配体系的RVA糊化曲线整体上移,且ACEP添加量越高,曲线上移位置越高。表1表明,ACEP显著增加了复配体系的峰值黏度、谷值黏度、最终黏度和峰值时间(P<0.05),且黏度的升高与ACEP添加量呈正相关。这种现象可能是由于ACEP和CS复配体系的两相性质[19]。一方面糊化过程中淀粉颗粒的膨胀导致多糖可用体积减少,ACEP处于体系连续相,其添加量增加,导致复配体系黏度随之增大。另一方面,ACEP是亲水性大分子,在复配体系中与CS竞争水分子,溶胀淀粉颗粒或浸出直链淀粉分子的有效添加量也会由于水分子的减少而增加。体系黏度的增加还可能是由于ACEP与浸出直链淀粉和低分子质量支链淀粉的相互作用,或浸出的淀粉链之间的相互作用。
与CS相比,添加1.0%和2.0% ACEP使体系糊化温度降低,而CS-10.0% ACEP的糊化温度显著升高(P<0.05)。这可能是由于少量的多糖对水分子的空间阻碍较小,多糖填充于复配体系,在淀粉颗粒间形成良好的桥梁,提高了淀粉颗粒与水分子间的亲和力,促进淀粉凝胶网络形成[20]。当多糖添加量增加,体系内可用水减少,淀粉颗粒无定形区域的水合作用减弱[21],紧密包裹的多糖层使淀粉颗粒膨胀受限[22],糊化变缓。此实验结果也很好地佐证了2.2节DSC的结果。
由表1可知,与CS相比,添加ACEP后,体系崩解值降低,淀粉糊的稳定性变好,在食品加工过程中更好地抵抗热处理和机械剪切。复配体系的回生值显著降低(P<0.05),CS短期回生受到抑制,特别是添加5.0% ACEP和10.0% ACEP时,体系的回生值分别降低了35.41%和50.89%。这可能是由于ACEP与淀粉竞争吸附体系中的水分以及ACEP与渗透出的直链淀粉通过氢键结合,都会抑制淀粉分子移动重排,降低回生值[23]。从应用的角度看,ACEP对淀粉长期回生的作用值得进一步研究,以开发口感好、保质期更长的淀粉基产品[24]。
2.2 ACEP添加量对CS热特性的影响
DSC可以用于淀粉的凝胶化、老化及相变化的定量分析,CS-ACEP复配体系的热特性曲线见图2。由表2可知,与对照CS相比,添加ACEP使体系的T0无显著变化(P>0.05),TP显著升高(P<0.05);0.5%~1.0% ACPE峰值温度Tc有所升高,2.0%~5.0% ACEP无显著变化,而10.0% ACEP使Tc显著升高4.52 ℃(P<0.05),这与Tester等[25]的实验结果相似。可能是由于非淀粉多糖的添加导致淀粉用于凝胶化转变的自由水分减少,淀粉颗粒无定形区域的水合作用减弱,从而导致淀粉凝胶化温度升高,且随着水的可用部分减少影响更强。

表1 CS-ACEP复配体系的RVA糊化特征参数Table 1 RVA gelatinization parameters of CS-ACEP blends
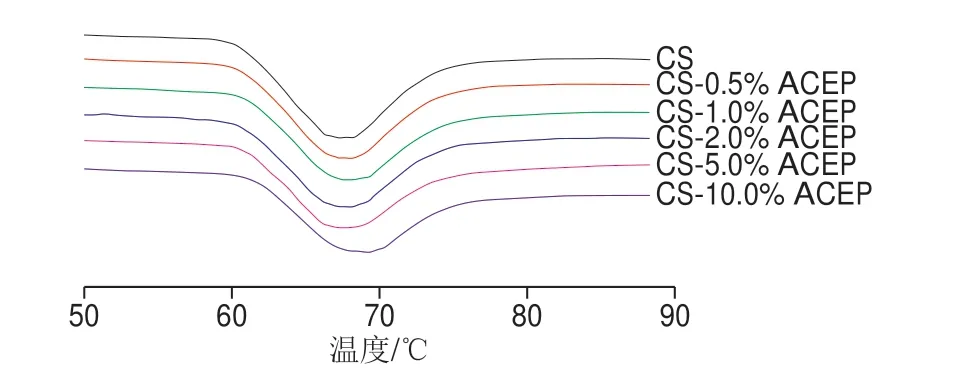
图2 CS-ACEP复配体系的热特性曲线Fig.2 DSC curves of CS-ACEP blends

表2 CS-ACEP复配体系的热力学参数Table 2 DSC parameters of CS-ACEP blends
体系的ΔH随ACEP添加量增大显著降低(P<0.05)。在其他淀粉-水胶体混合物研究中也得到ΔH降低的结果。可能是由于多糖的加入降低了水的可用性和/或流动性,导致淀粉颗粒中结晶区域的不完全熔化[26]。ΔH主要反映凝胶化时破坏淀粉双螺旋结构所需能量,衡量淀粉凝胶化之前淀粉颗粒内部分子链段有序性,淀粉颗粒有序结构破坏会导致ΔH下降[27]。也可能是淀粉双螺旋之间和相邻双螺旋之间的氢键的减少,形成晶体结构的双螺旋的迁移率增加[28]。
2.3 ACEP添加量对CS流变学特性的影响
2.3.1 静态流变特性
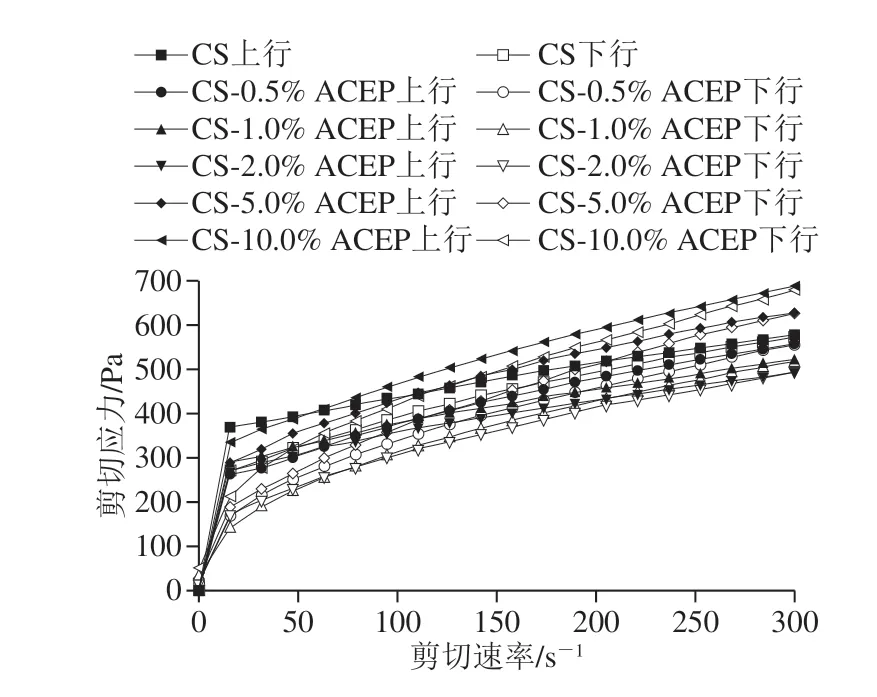
图3 CS-ACEP复配体系静态流变曲线Fig.3 Static rheology curves of CS-ACEP blends
由图3可知,所有样品的剪切应力均剪切速率的增加而增大。表3为用Herschel-Bulkley模型对复配体系流变拟合参数,结果表明该回归拟合具有较高精度(R2为0.998 2~0.999 8)。添加ACEP后,复配体系上行曲线和下行曲线的稠度系数K均显著增大(P<0.05),分子链在糊化过程中更加伸展,支链的缠绕程度更大,体系增稠作用更好[29],证实了糊化特性结果中ACEP使CS黏度增加的结论。流动指数n反映了流动行为的类型,所有样品的n值均小于1,表明复配体系仍为典型的假塑性流体,上行和下行曲线的n值均随ACEP添加量增加而减小,体系的假塑性更为明显。Chen Haiming等[30]报道的多糖对淀粉静态流变特性的影响也得到相似结论。所有样品都观察到应力-剪切滞后环(图3),具有强烈的触变效应,就淀粉糊而言,触变性能可归因于由连续剪切引起的凝胶网络结构的损坏[7]。触变环面积表示淀粉结构被破坏所需要能量,面积越大表示体系受外界作用后越难恢复至原先状态[31]。表3表明,与对照CS相比,添加ACEP的复配体系触变环面积显著减小(P<0.05),体系的剪切稳定性显著增强,但并未随ACEP添加量的增加呈现规律性的变化。
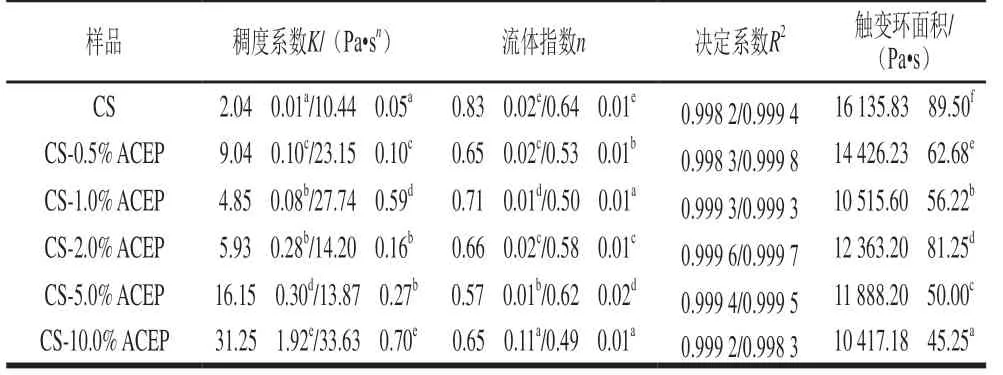
表3 CS-ACEP复配体系的静态流变学拟合参数Table 3 Static rheological fitting parameters of CS-ACEP blends
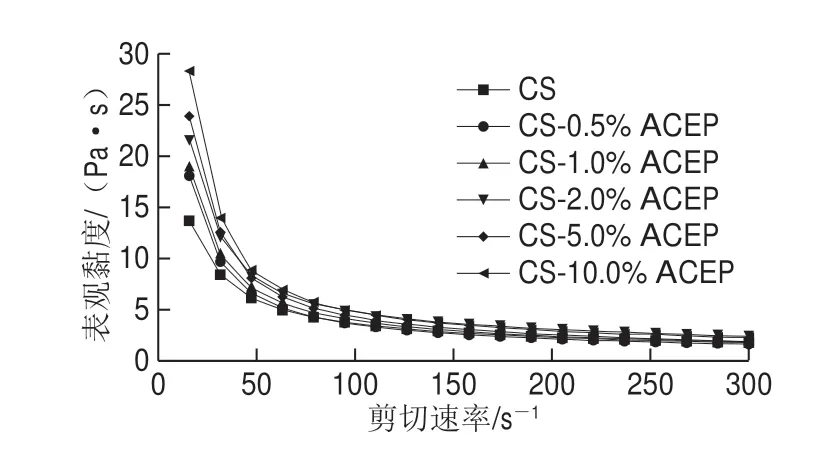
图4 CS-ACEP复配体系黏度曲线Fig.4 Viscosity curves of CS-ACEP blends
由图4可知,所有样品的表观黏度均随剪切速率的增加而降低,具有剪切稀化的特性。这是因为:凝胶体系中2 种大分子链以非共价氢键互相缠绕,分子链段间的缠绕点增加,流动时产生的黏性阻力增强,当受到高速剪切时,氢键部分断裂而产生解旋作用,分子链由于缠结点的减少被拉直取向,流层间的剪切应力减少,从而使体系的表观黏度降低[32]。与CS相比,复配体系的表观黏度显著增大,剪切变稀现象更明显,且与ACEP添加量呈正相关。这种趋势与糊化特性的结果非常一致(表1)。因此,如2.1节所述,ACEP与淀粉颗粒的相互作用及糊化过程中ACEP和淀粉有效添加量的增加可能是造成这种结果的原因。
2.3.2 动态流变学特性
动态黏弹性是糊状类弱凝胶体系的一项重要指标,对食品加工特性和质量控制具有很大应用价值。G’能够反映体系的弹性性质;G”反映体系的黏性性质。由图5可知,所有样品的G’与G”均无交叉,且G’均远大于G”,G’和G”均随角频率增加而增大,表现为一种典型的弱凝胶流变学动态体系。添加ACEP后,体系的G’和G”均高于原淀粉,CS-0.5% ACEP表现出最高的G’,可能是由于ACEP和淀粉彼此交联,分子链的缠结点增多,凝胶体系的网络结构增强[33],从而表现出更好的黏弹性。G”随ACEP添加量增加而增大的效果与RVA黏性数据一致(表1)。
2.4 ACEP添加量对CS微观结构的影响
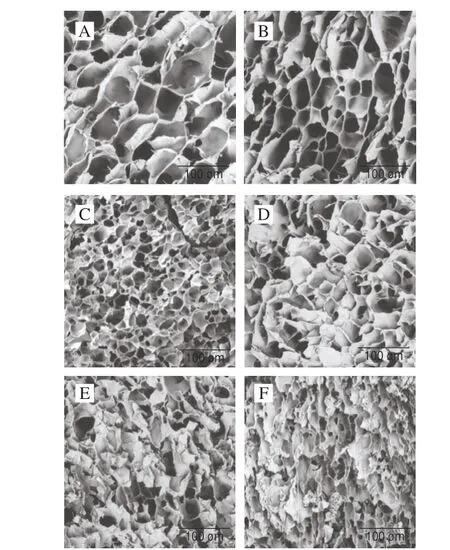
图6 CS-ACEP复配体系微观结构Fig.6 Microstructures of CS-ACEP blends
图6显示,添加ACEP导致体系凝胶结构发生较大改变,复配体系凝胶表面的孔隙减小(图6B~F)。孔隙代表在凝胶干燥之前的网络内水的位置[34]。ACEP参与体系内水分的竞争,导致进入颗粒内部的水分变少,凝胶内孔隙变小。ACEP填充于CS之间,与渗漏的低聚合度的支链淀粉分子和直链淀粉相互作用,形成的组织结构更加紧密,剪切稳定性增强[35]。添加0.5%和1.0% ACEP的复配体系孔隙整齐均匀,孔壁光滑较薄,颗粒的边界更清晰(图6B、C)。随ACEP添加量的进一步增加,凝胶孔隙表面开始形成相互交联支撑的网络片状结构。这可能是ACEP的包裹效应使淀粉颗粒中浸出的直链淀粉不足以产生均匀的网络,同时多糖可能与浸出的直链淀粉相互作用,围绕溶胀的淀粉颗粒,形成黏性相,导致网络片状结构。
2.5 ACEP添加量对CS红外光谱的影响
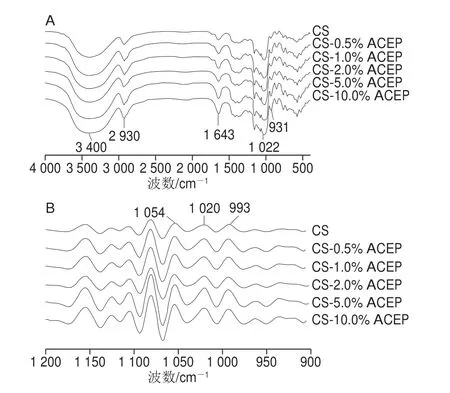
图7 CS-ACEP复配体系的红外光谱(A)和去卷积化光谱(B)Fig.7 Raw FTIR spectra (A) and deconvoluted FTIR spectra (B) of CS-ACEP blends
对ACEP和CS复配体系糊化后的样品进行红外分析,如图7A所示,在4 000~400 cm-1范围内,红外吸收峰形状及位置非常相似,无新的吸收峰出现或特征峰消失,且吸收峰无明显偏移,说明体系并未产生新的基团。样品在3 400、2 930、1 643 cm-1附近均具有较强吸收峰,它们分别是ü OH的伸缩振动吸收峰、ü CH2伸缩振动吸收峰、C=O伸缩振动峰[36]。与对照CS相比,添加0.5% ACEP部分特征吸收峰强度增大,而ACEP添加量大于0.5%时,吸收峰逐渐变窄变高。CS-10.0% ACEP吸收峰强度最小。
对红外光谱原始波谱1 200~900 cm-1谱段进行去卷积处理,采用(1 045/1 022)cm-1和(1 022/995)cm-1的吸收峰强度比值,可以分析淀粉有序结构的变化[37]。图7B显示所选区域出现8 个红外吸收峰,其中1 054 cm-1附近的吸收峰是淀粉结晶区的结构特征,对应于淀粉聚集态结构中的有序结构;1 020 cm-1附近处吸收峰代表无定型淀粉的特征,对应于淀粉大分子的无规线团结构,993 cm-1附近吸收峰对应脱水葡萄糖单元的羟基在淀粉分子间所形成的氢键有序化结构[38-39]。由表4可知,与CS相比,添加0.5% ACEP使(1 054/1 020)cm-1比值增大,(1 020/993)cm-1比值降低,表明淀粉分子间形成的氢键数量增多,淀粉链可以通过氢键的诱导排列聚集,体系形成有序的网络结构。当添加量大于0.5%,(1 054/1 020)cm-1比值降低,(1 020/993)cm-1比值升高,表明淀粉体系有序程度降低,一方面ACEP添加量增大可能导致淀粉分子链之间距离的增加,减少由淀粉分子间羟基形成的氢键,另一方面,ACEP可能通过自身的羟基与淀粉形成氢键,干扰淀粉有序结构的形成[40]。氢键的减少与2.1节中添加ACEP阻碍淀粉重新螺旋而抑制短期回生的结论一致。
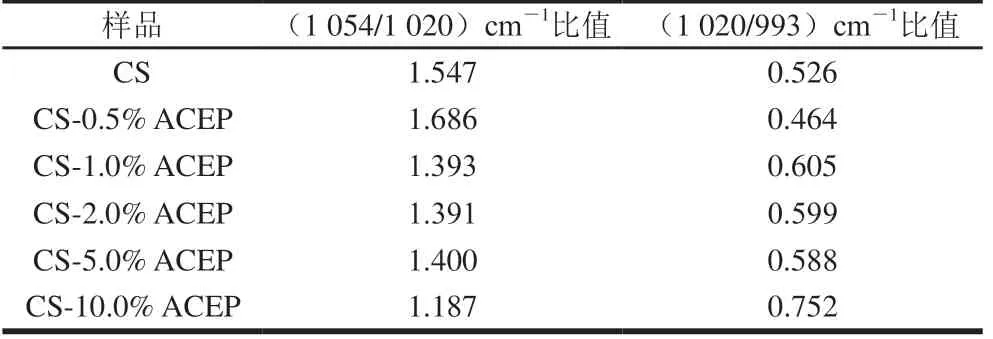
表4 CS-ACEP复配体系的短程有序结构参数Table 4 Short-range order structural parameters of CS-ACEP blends
3 结 论
本研究表明,不同添加量的ACEP改变了CS的糊化性质、流变性质和结构性质。CS-ACEP复配体系的黏度显著增大,崩解值、回生值降低,凝胶化转变温度升高,热焓值降低,体系的稳定性增强,老化得到延缓。随ACEP添加量的增加,体系的增稠效果、假塑性及剪切稀化现象更明显。添加ACEP使体系的凝胶孔隙变小,添加量较低时有利于体系形成更加均匀、致密的网络结构,但并未产生新的基团。目前的研究结果显示,ACEP作为功能因子赋予CS基食品功能特性的同时,也在一定程度上改善了CS的加工性质,这为ACEP对淀粉类食品特性的影响提供了基础数据,也为淀粉和多糖两种大分子间复杂的相互作用提供了一定参考。
——以高中化学“氢键”的教学为例

