中国荷斯坦牛PIN1 基因对产奶性状的遗传效应分析
林 珊 ,杨宇泽,刘 林,李艳华,韩 博,许令娜,张俊楠,麻 柱,张胜利,孙东晓*
(1.中国农业大学动物科学技术学院,北京 100193;2.北京市畜牧总站,北京 100107;3.北京奶牛中心,北京 100192)
产奶量、乳脂量、乳脂率、乳蛋白量和乳蛋白率是奶牛的主要生产性状,属于数量性状,由微效多基因控制[1]。与传统的以表型数据为基础的遗传评估相比,标记辅助选择可以利用DNA 水平的分子信息,从而获得更快的遗传进展。Meuwissen 于2001 年第一次提出基因组选择(Genomic Selection,GS)[2]。自2009 年始,美国、加拿大等奶业发达国家陆续将GS 技术应用于奶牛育种[3-5],我国从2012 年开始在全国范围内开展荷斯坦青年公牛基因组遗传评估工作[6-7]。基因组选择可实现青年公牛的早期选择,极大缩短世代间隔,加快遗传进展,节约育种成本[2,8]。Zhang 等[9]研究表明,在基因组选择所用的全基因组SNP 芯片中加入遗传效应较大的基因信息可提高基因组育种值估计准确性。因此,鉴定奶牛重要性状功能基因具有重要意义。
作者前期对8 头来自同胞或半同胞家系的极端高低乳脂乳蛋白率的荷斯坦公牛进行了全基因组重测序,通过生物信息学分析鉴定到17 个产奶性状候选功能基因[10]。其中,肽基脯氨酸顺反异构酶基因(Peptidylprolylcis/transisomerasesNIMA-interacting1,PIN1)参与乳脂、乳蛋白合成代谢相关通路,包括甘油三酯代谢、甘油磷脂代谢以及mTOR 信号通路,且位于产奶量和乳蛋白量性状的QTL 显著区间[11]。牛PIN1基因定位于7 号染色体上,全长12 255 bp(ARS-UCD1.2),编码肽基脯氨酸顺反异构酶,能够特异性催化磷酸化的丝/苏氨酸-脯氨酸基序[12],可参与调控细胞增殖及凋亡[13]、乳腺细胞增殖[14]、乳脂和乳脂蛋白相关通路PI3K/AKT/β-catenin 中多个关键蛋白的调控[15]。本研究以PIN1基因为研究对象,基于北京地区中国荷斯坦牛群体,进一步研究其多态性及其对产奶性状的遗传效应,以期为中国荷斯坦牛的分子标记辅助选择提供基因信息。
1 材料与方法
1.1 实验动物 本研究以北京首农畜牧绿荷牛业的40个公牛家系的987 头中国荷斯坦母牛为实验群体,牛只具有完整的系谱信息和规范的 DHI(Dairy Herd Improvement)测定记录,包括第1 泌乳期记录947 条和第2 泌乳期记录655 条,描述性统计量见表1 和表2。表型数据包括产奶量、乳脂率、乳脂量、乳蛋白率和乳蛋白量5 个性状,均由北京奶牛中心提供。

表1 中国荷斯坦牛试验群体的第1 泌乳期5 个产奶性状表型值描述性统计

表2 中国荷斯坦牛试验群体的第2 泌乳期5 个产奶性状表型值描述性统计
1.2 基因组DNA 的提取 中国荷斯坦母牛的基因组DNA 提取采用血液基因组 DNA 提取试剂盒(天根生化科技有限公司,北京)40 头公牛的冻精基因组提取采用优化的高盐法进行提取[16]。提取后DNA 采用 NannoDrop2000 分光光度计(Thermo Scientific,Hudson,DE,美国)和1.0% 琼脂糖凝胶电泳检测浓度和纯度,合格的DNA 置于1.5 mL 离心管,-20℃保存备用。
1.3 候选基因的多态性检测 根据GenBank(https://www.ncbi.nlm.nih.gov/nuccore)中牛PIN1基因(GenBankNo.AC_000165.1)的全部编码区以及上下游调控区2 000 bp,利用Primer5.0 设计9 对引物,扩增片段长度为471~839 bp(表3)。利用NanoDrop2000 分光光度计(ThermoScientific,Hudson,DE,美国)分别测定40头公牛基因组DNA 的浓度并将其稀释为50 ng/μL,吸取1μL 混池后PCR 扩增测序以检测基因的多态性。PCR反应体系为25μL:10 pmol/μL 上、下游引物各1.25 μL,2× Taq Master Mix 12.5 μL,混池基因组DNA(50~100 ng/μL)2 μL,ddH2O 8 μL。PCR 反应条件为:94℃5min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,35 个循环;最后72 ℃延伸7 min。PCR 反应产物以1.5% 琼脂糖凝胶电泳检测,将PCR 扩增产物送华大基因有限公司进行双向测序。基于测序结果,利用Chromas 和DNAMan6.0 软件鉴定多态位点及突变类型。利用靶向测序基因型(Genotyping By Target Sequencing,GBTS)技术对987 个个体进行SNP 基因型检测。
1.4 关联分析 本研究采用 SAS 9.2 软件中的 MIXED过程对实验群体的中国荷斯坦母牛产奶量、乳脂量、乳脂率、乳蛋白量和乳蛋白率5 个产奶性状和SNP 位点基因型进行关联分析,共利用2 827 头牛个体信息,采用动物模型如下:
Y=μ+hys+b×M+G+a+e
其中,y 为个体产奶性状(产奶量、乳脂量、乳脂率、乳蛋白量和乳蛋白率)表型值,μ 为总体均值,hys 为场年季效应,b 为协变量 M 的回归系数,M 为产犊月龄效应,G 为基因型,a 为个体随机加性效应,e 为随机残差效应。多重比较采用Bonferroni 法进行矫正。
加性效应、显性效应和替代效应的计算公式如下:
a=(AA-BB)/2;d=AB-(AA+BB)/2;α=a+d(q-p)
其中,a 为加性效应,d 为显性效应,α 为等位基因替代效应;AA、AB、BB 为相应基因型产奶性状最小二乘均值。

表3 用于PNI1 基因混池测序的9 对PCR 扩增引物序列信息
1.5 组织表达谱分析 为进一步检测PIN1基因的潜在功能,本研究进行了组织表达谱分析,包括乳腺、心脏、肝脏、脾脏、肺脏、肾脏、淋巴和胃。选择3 头泌乳期荷斯坦母牛,采集3 头牛的8 种组织,液氮保存待用。利用Trizol 试剂(Invitrogen,Carlsbad,CA,美国)提取每头母牛每个组织的总RNA,使用NanoDrop 2000 分光光度计(Thermo Scientific,Hudson,DE,美国)和1.0% 凝胶电泳检测RNA 的浓度和质量。利用PrimerScriptH RT 试剂盒(TaKaRa 生物技术有限公司,大连)进行反转录。根据NCBI 网站PIN1的cDNA 序列(NM_001034632.3)设计跨内含子引物,PCR 产物长度为252 bp,上、下游引物序列分别为:CATCACTAATGCCAGCCAGT 和CTGAACTGTGAGG CCAGAGA。
采用罗氏荧光定量PCR 仪(Roche,Penzberg,德国)检测PIN1基因的mRNA 相对表达量,反应体积为15 µL:cDNA 模板2 µL,上、下游引物(10 mmol/L)各0.375 µL,蒸馏水4.75 µL,SYBR Green 混合物7.5 µL。PCR 条件:95℃ 10 min;95℃ 10 s,58℃ 10 s,72℃ 10 s,45 个循环,最后72℃延伸7 min。定量PCR 使用3 个生物学重复和3 个技术重复,以GAPDH(Glyceraldehyde-3-Phosphate Dehydrogenase)基因为内参,用2-ΔΔCt方法对基因相对表达进行标准化[17]。
2 结果
2.1PIN1基因多态性鉴定结果 以40 头公牛的基因组混池DNA 为模板,利用9 对引物对PIN1基因分段PCR 扩增并进行PCR 产物直接测序,结果在内含子2鉴定到1 个G/A 突变,命名为 g.14432394G>A(图1)。SNP 位点的等位基因G、A 的频率分别为0.479 7 和0.520 3,基因型AA、AG 和GG 的频率分别为0.233 0、0.493 4 和0.273 6。卡方检验结果显示,该SNP 位点处于Hardy-Weinberg 平衡状态(P=0.716 8,表4)。
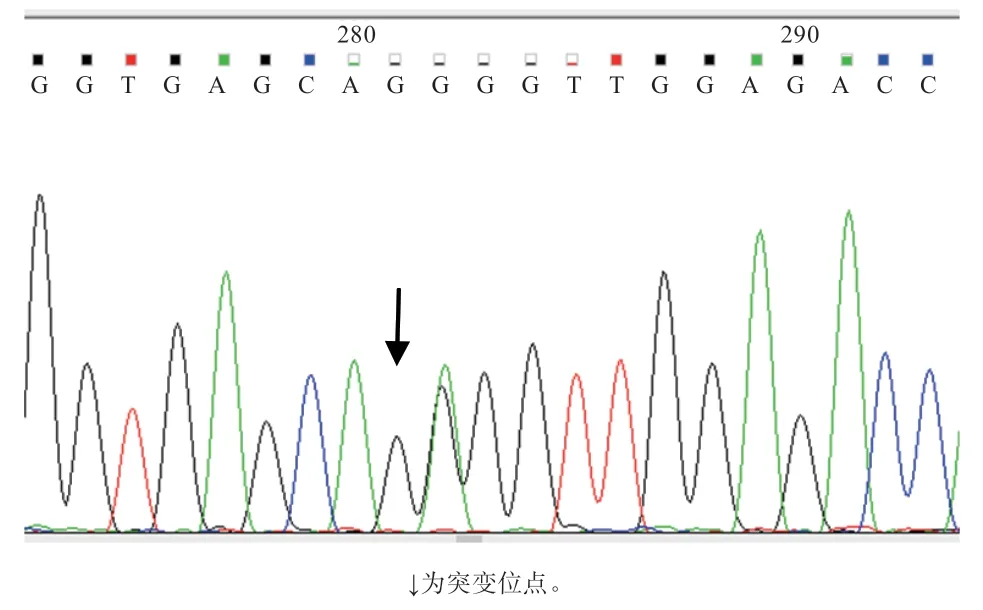
图1 中国荷斯坦牛PIN1 基因的SNP 位点测序结果
2.2PIN1基因与产奶性状的关联分析结果 SNP 位点g.14432394G>A 与5 个产奶性状(产奶量、乳脂量、乳脂率、乳蛋白量和乳蛋白率)的关联分析结果见表5。在第1 泌乳期,g.14432394G>A 与产奶量、乳脂量乳、蛋白量和乳蛋白率均达到显著(P=0.049 3)或极显著关联(P=0.000 1~0.001 9),与乳脂率关联不显著(P=0.616 9);第2 泌乳期,SNP 位点g.14432394G>A 与产奶量、乳脂率、乳脂量和乳蛋白率达到显著或极显著关联(P=0.000 1~0.010 4),与乳蛋白率关联不显著(P=0.369 9)。
PIN1基因等位基因加性效应、显性效应和替代效应检验结果见表6。SNP 位点 7:g.14432394G>A 对产奶量、乳脂量和乳蛋白量的加性效应或等位基因替代效应在第1 和第2 泌乳期均达到显著或极显著,而乳蛋白率仅在第1 泌乳期达到显著。即每个A 等位基因替代C等位基因会导致产奶量、乳脂量、乳蛋白量和乳蛋白率的减少。该位点对乳脂率的加性效应或等位基因替代效应在第1 和第2 泌乳期均不显著。
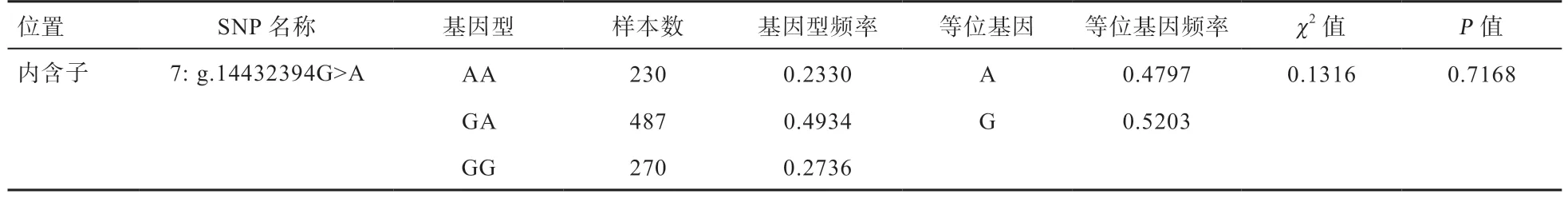
表4 PNI1 基因SNP 位点7:g.14432394G>A 的等位基因频率、基因型频率及哈代-温伯格平衡检验
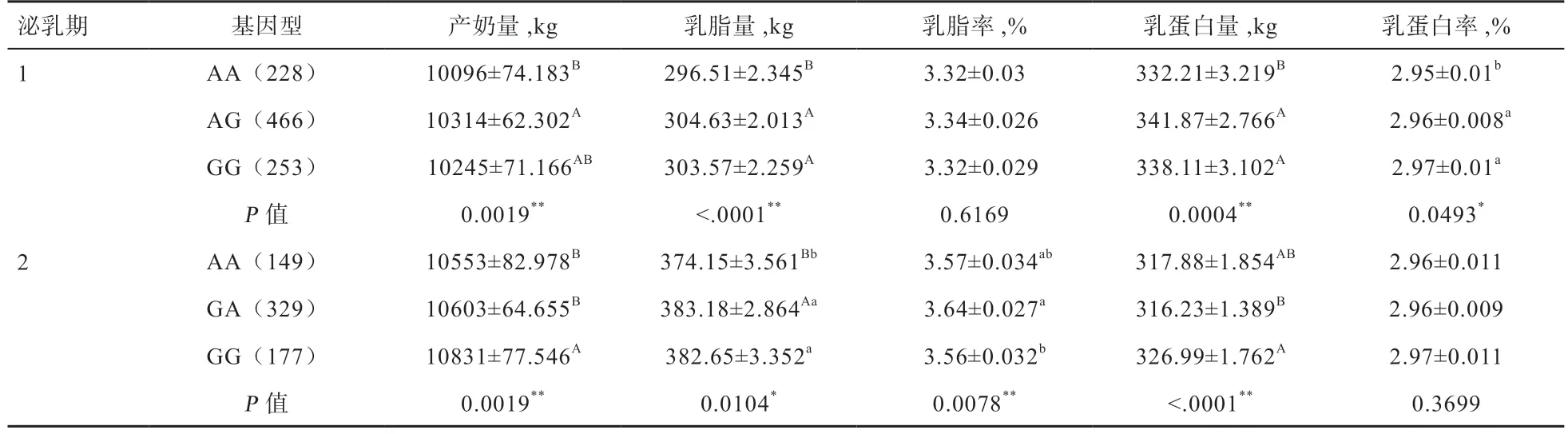
表5 PNI1 基因SNP 位点7:g.14432394G>A 与5 个产奶性状的遗传关联分析(最小二乘均值±标准误)

表6 PIN1 基因7:g.14432394G>A 位点等位基因加性效应、显性效应和替代效应检验
2.3 组织表达谱分析结果
2.3.1 总RNA 提取结果 利用1.0%琼脂糖凝胶电泳检测3 头泌乳期荷斯坦母牛8 种组织的总RNA,结果显示每个泳道均有3 条清晰条带,基本无降解(图2),OD260/280均在2.0 左右,OD260/230均在2.0 以上,RNA浓度1 000 ng/μL 左右,符合下一步实验要求。
PIN1 的cDNA 序列PCR 扩增产物1.5% 琼脂糖凝胶电泳结果显示PIN1基因的PCR 产物条带明亮清晰且单一可用于后续荧光定量实验(图3)。
2.3.2 组织表达谱分析结果 通过荧光定量PCR 扩增,PIN1基因的mRNA 在乳腺、心脏、肝脏、脾脏、肺脏、肾脏、淋巴和胃的相对表达量如图4 所示。结果显示,PIN1基因在乳腺和肝脏组织中表达量相对较高,表明PIN1可能参与了乳成分的合成。
3 讨 论
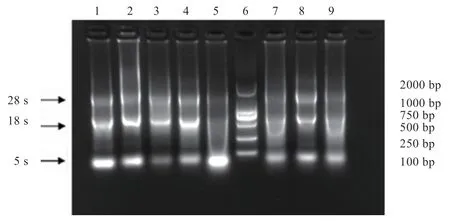
图2 荷斯坦牛不同组织中总RNA 的电泳检测结果
图3 PIN1 基因cDNA 的PCR 扩增检测结果

图4 PIN1 基因在泌乳荷斯坦牛8 种组织中的表达量分析
作者前期对极端高低乳脂乳蛋白率中国荷斯坦公牛全基因组重测序的研究鉴定PIN1为影响奶牛乳成分性状的候选功能基因[10]。本研究对PIN1基因进行深入遗传效应分析,结果证明该基因对中国荷斯坦牛产奶量、乳蛋白和乳脂性状确有显著影响。
3.1 内含子突变对基因调控作用的影响 前人对基因多态性的研究多集中在编码区和5´翼区,而忽略了对内含子多态性的研究。近年来,已有研究表明内含子具有调控功能。在玉米上,内含子可以增加细胞ADH1 和CAT 的表达[18]。在人上,SLC2A9基因内含子7 中的1 个SNP(rs734553)与血清尿酸和慢性肾脏疾病的进展密切相关[19]。在奶牛上,ECHS1基因的6 个内含子SNPs 与牛奶脂肪酸显著关联[20]。因此,本研究所发现的PIN1内含子SNP 可能对产奶性状有潜在调控功能。
3.2PIN1基因与产奶性状相关功能分析PIN1基因参与蛋白质分解代谢过程的负调控、甘油三酯和甘油磷脂代谢以及mTOR 信号通路,位于产奶量、乳蛋白率、乳蛋白量QTLs 区间内[21-23]。研究表明,PIN1在促进脂质堆积和炎症伴随的纤维化变化的恶化中起关键作用[24]。PIN1的靶蛋白胰岛素受体底物1(IRS-1)、AMP 激活的蛋白激酶(AMPK)和乙酰辅酶A 羧化酶1(ACC1)均参与脂质积累的过程[24]。本研究中,PIN1在乳腺组中高表达,而在人癌症研究中发现PIN1在乳腺癌患者乳腺中表达量明显上升,表明PIN1可能与乳腺细胞增殖相关[14]。在体内异种移植肿瘤模型中,PIN1过表达会导致PI3K、AKT 和β-catenin 通路中多个关键蛋白的下调[15]。其中,PI3K 和β-catenin 是与乳脂乳蛋白合成代谢相关的通路,可见PIN1对乳汁合成分泌过程有重要作用。
从关联分析结果可以看出,PIN1基因SNP 位点7:g.14432394G>A 与产奶量、乳脂量、乳脂率、乳蛋白量和乳蛋白率均呈显著或极显著关联,同时该位点对产奶量、乳脂量、乳蛋白量和乳蛋白率性状的加性效应和等位基因替代效应显著,说明不同基因型个体间的差异是可以遗传的,能将其应用于奶牛育种工作。通过传统的育种方法来进行优质高产奶牛的选育是一件长期而艰巨的工作,而在奶牛基因组选择中加入与产奶性状相关的基因,可以更准确、更早地进行选育工作,从而降低生产成本,加快遗传进展[9,25]。
4 结 论
作者前期的重测序研究将PIN1基因鉴定为奶牛产奶性状候选功能基因,本研究进一步证明,PIN1与奶牛产奶性状有显著关联。PIN1基因SNP 位点7:g.14432394G>A 与产奶量、乳脂量、乳脂率、乳蛋白量和乳蛋白率均呈显著或极显著关联,且加性效应和等位基因替代效应显著。可根据育种目标将PIN1基因及SNP 位点7:g.14432394G>A 作为遗传标记为中国荷斯坦牛的分子育种提供有价值的基因信息。

